
- •Ионная связь
- •Молекулярные орбитали
- •Гибридизация (2 заместителя)
- •Гибридизация (3 заместителя)
- •Гибридизация (4 заместителя)
- •Метан – два первых потенциала ионизации
- •Примеры
- •Октетная модель и границы ее применимости.
- •Правило октета. Пример. Окиси аминов.
- •Правило октета. Пример. «Триалкилдиалкоксиазоты».
- •Правило октета. Пример. Нитросоединения.
- •Правило октета. Пример. Борабензол.
- •Правило октета. Пример. Борабензол.
- •Электроотрицательность
- •Электроотрицательность атомов зависит от гибридизации
- •Электроотрицательность атомов зависит от заместителей (других атомов в окружении данного)
- •Взаимосвязь гибридизации и параметров атома и связи
- •Количественная корреляция между s–характером орбитали и константой спин-спинового взаимодействия (J 13C-1H)
- •Циклопропан
- •Циклопропан
- •Длины связей (нм) и понятие о ковалентном радиусе
- •Ковалентный радиус (нм)
- •Ковалентный радиус (нм)
- •Энергия связи
- •Принцип аддитивности
- •Принцип аддитивности
- •Принцип аддитивности
- •Принцип аддитивности - проверьте, совпадает ли расчёт с экспериментом для изомеров – изопентана и неопентана
- •Полярность ковалентной связи
- •Дипольный момент неподеленной электронной пары
- •Дипольный момент связи
- •Дипольные моменты моно- и дизамещённых бензолов
- •Нерегулярные заместители
- •Поляризуемость

Химическая связь в органических соединениях
Химические
связи
Ионная (электростатическое |
Ковалентная |
|
взаимодействие отрицательных |
(Электростатическая природа |
|
заключается в притяжении пары (пар) |
||
и положительных ионов) |
||
электронов к двум (нескольким) |
||
|
||
1. Ненаправленная |
ядрам атомов одновременно) |
|
1. Направленная |
||
2. Ненасыщаемая |
||
2. Насыщаемая |
||
|

Ионная связь
CH3COO K
Me2N


 C
C

Cl
|
NMe2 |
R |
CN |
|
|
|
NO2 |
R |
R CN |
|
NMe2 O2N |
NO2 |

 C
C

Na
|
|
NO2 |
|
R |
NC |
|
+ |
|
|
NO2 |
|
R |
R |
NC |
Ковалентная связь
Перекрывание (взаимодействие) атомных орбиталей
Образование молекулярных орбиталей

Молекулярные орбитали
•Узлы и относительная энергия орбиталей

•Форма орбиталей. Граничные поверхности
Пространственные решения уравнения Шредингера:
Молекула водорода:
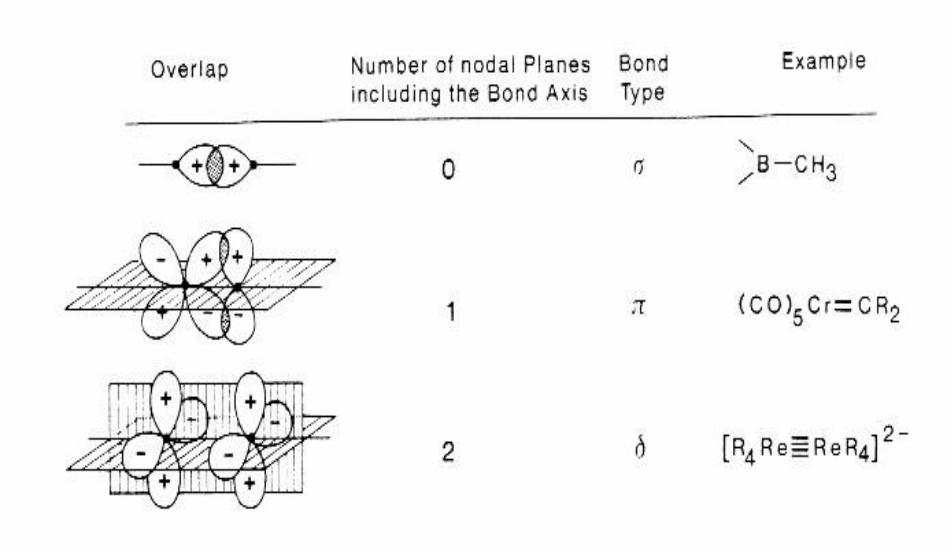
Ковалентная связь
Метод валентных связей и метод молекулярных орбиталей – два способа описания одного явления
Оба способа верны, оба имеют современные «высоконаучные» квантовохимические интерпретации, оба в чистом виде описывают только граничные случаи
Метод валентных связей оперирует понятиями гибридизации и резонанса
