
- •Теоретические основы органической химии
- •Теория отталкивания электронных пар
- •Число AXmEn
- •3. Неподеленная пара (E) занимает больший объем, чем пара связи (X):
- •4. Объем электронной пары типа А уменьшается с ростом электроотрицательности лиганда
- •5. Электронные пары двойной и тройной связи занимают больший объем, чем пара ординарной
- •6.Теория отталкивания е пар применима к метастабильным соединениям
- •Недостатки теории ОЭП
- •Взаимодействие удаленных пар
- •ГОШ - эффект
- •Граничные МО
- •Аномерный эффект – предпочтительны те конформации, в которых электроотри- цательный заместитель Х занимает
- •Аномерный эффект
- •Гетероатомы в 1,3
- •Взаимодействие неподеленных пар «через связь»
- •Участие связей
- •Диаграммы Уолша
Теоретические основы органической химии
Теория отталкивания электронных пар. Стереоэлектронные эффекты и метод МО.
Лекция 7 (электронно-лекционный курс)
Проф. Бородкин Г.И.
Теория отталкивания электронных пар
Сиджвик и Пауэлл, 1940 г.; развитие Гиллеспи
Положения:
1.Конфигурация связей многовалентного атома или иона обусловлена числом электронных пар в его валентной оболочке
2.Ориентация облаков электронных пар валентных орбиталей определяется min отталкиванием электронов
F ~ 1/rn , r – расстояние между «парами» е
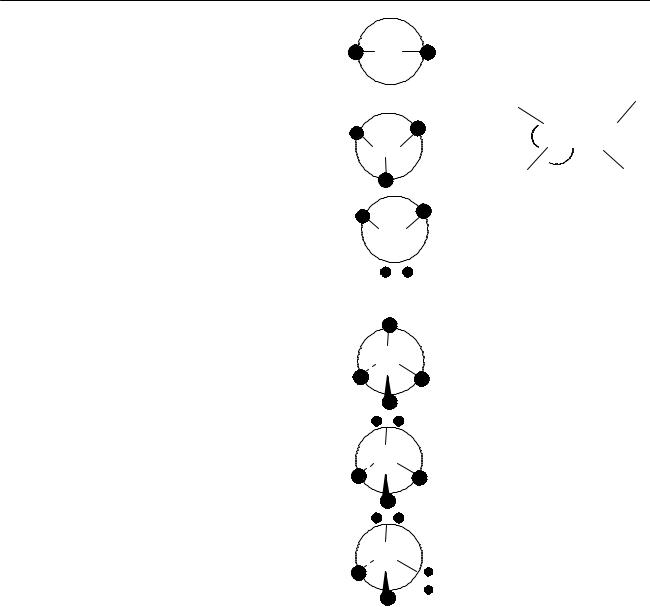
Число AXmEn |
Конфигурация |
Пример |
||
пар |
|
|
|
|
2 |
AX2 |
A |
H-C=C-H |
|
3 |
AX3 |
A |
H |
H |
117o |
C=C |
|||
|
|
|
H |
122o H |
3 |
AX2E |
A |
SnCl2 |
|
4 |
AX4 |
A |
CH4, BH4- |
4 |
AX3E |
A |
NMe3, H3O+ |
4 |
AX2E2 |
A |
Me2O, H2O |

3. Неподеленная пара (E) занимает больший объем, чем пара связи (X):
E-E > E-X > X-X
H |
|
H |
|
H C H |
H N H |
O |
104,5o |
H |
|||
H 109,5o |
H 107,2o |
|
|

4. Объем электронной пары типа А уменьшается с ростом электроотрицательности лиганда
H N H |
F N |
F |
H 107o |
F 102o |
|
|
Ср. правило Бенда |
|
5. Электронные пары двойной и тройной связи занимают больший объем, чем пара ординарной связи
> >
H |
H |
F |
F |
117o |
C=C |
114o |
C=C |
H |
122o H |
F |
123o F |
6.Теория отталкивания е пар применима к метастабильным соединениям
|
|
|
|
|
|
|
|
|
|
|
|
- |
|||
H |
|
|
|
H |
|||||||||||
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||
F- + H |
|
C |
|
F |
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
C |
|
F |
|
||||||||
|
|
|
|
|
|
|
|||||||||
|
|
|
|
||||||||||||
H |
|
|
H |
|
|
H |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
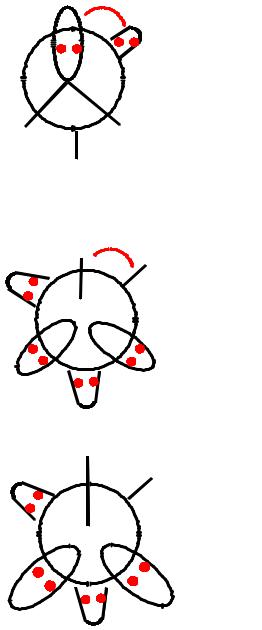
AX5
5 электронных пар
Недостатки теории ОЭП
1.Теория не приложима к молекулам с переходными элементами (отклонение от сферической симметрии е).
2.Участие d-орбиталей в связях, образуемых элементами низших периодов, приводит к отклонениям.
3.В соединениях типа АХ6Е и других с высоким координационным числом атома неподеленная пара является стереохимически инертной (анионы SbCl63-,
ТеСl62-).
4.Большие расхождения наблюдаются для соединений с высокополярными связями (Li2O – линеен).
5.В теории ОЭП характеристики заместителей X фактически не принимаются во внимание(π-сопряженние) (C(CN)3-, C(NO2)3- плоские).

Взаимодействие удаленных пар
- |
H2N-NH2 |
- |
||
|
- |
|
||
H |
H |
H |
||
|
||||
H |
H |
H |
H |
H |
? |
- |
|
|
|
||
гош |
анти |
|
ГОШ - эффект
Гош-эффект: в производных этана и их аналогах более предпочтительны конформации с max числом гош-взаимодействий между соседними электронными парами и/или полярными связями (типа C-F. C-OR и др.)
X X
Y
|
|
|
|
|
|
|
|
|
|
Y |
гош |
|
(выгодна !) |
|
|
||||
X,Y – пара е, С-F, C-OR и др.
H2N-NH2
HO-OH
Ar-S-S-R
= 90-95o
H
H |
H |
H |
= 111o |
H |
|
O |
H |
|
Ar = 103o
 R
R
S
