
Презентация лекция 7 ОПТИКА
.pdfТеория атома водорода по Бору
•Модели атома Томсона
•Опыт Резерфорда
•Ядерная (планетарная) модель атома
•Линейчатый спектр атома водорода
•Постулаты Бора
•Модель атома водорода по Бору
•Опыты Франка и Герца
|
1 |
|
1 |
|
|
v R |
|
|
|
|
n 3,4,5,... |
|
n2 |
||||
22 |
|
|
|
||
R - постоянная величина
Все видимые спектральные линии водорода представляют собой серию. Разные линии соответствуют различным целочисленным значениям n. Эта серия - серия Бальмера.
|
1 |
|
1 |
|
v R |
|
|
|
- формула Бальмера |
|
|
|||
m2 |
|
n2 |
|
|
где m и n - целые числа, причем m ˃ n.
n = m+1, m+2, m+3…

Модель атома Томсона
Объясняет излучение атомом электромагнитных волн определенной частоты колеблющимися электронами, выведенными из положения равновесия.
Не объясняет излучение большого числа спектральных
линий, |
не |
позволяет |
объяснить |
спектральные |
закономерности, найденные эмпирически, не дает возможности понять, что определяет размеры атомов.
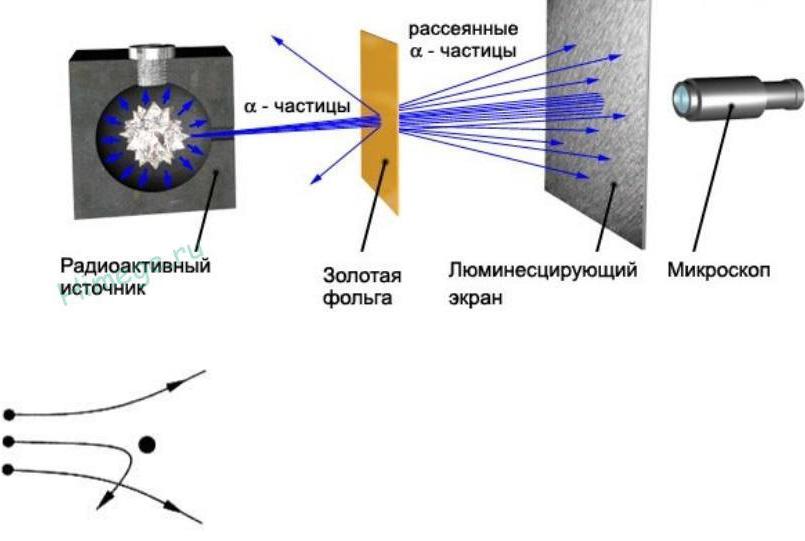
Опыт Резерфорда
Атомное ядро – тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома
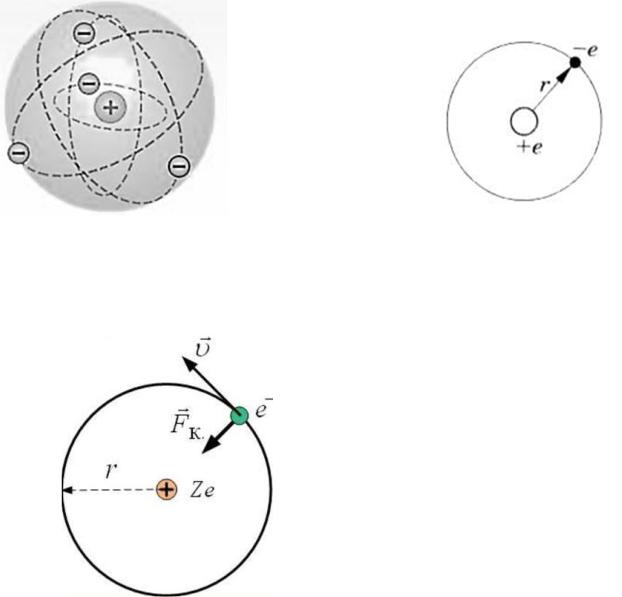
Ядерная (планетарная) модель атома
Размер атома – это радиус орбиты его электрона.
Zee |
|
m |
v2 |
||
|
|
|
e |
|
|
4 |
0 |
r 2 |
r |
||
|
|
|
|
|
|
Линейчатый спектр атома водорода
видимая область спектра
1 |
|
1 |
|
1 |
|
n 3,4,5,... |
|
R' |
|
|
|
|
|
|
|
|
||||
22 |
|
n2 |
|
|
||
R' 1,1 107 |
м 1 |
постоянная Ридберга |
||||||||
v R |
1 |
|
|
1 |
|
|
|
|
||
|
|
|
|
|
||||||
|
|
n |
|
3,4,5,... |
серия Бальмера |
|||||
22 |
n2 |
|
|
|
|
|
||||
R R'c 3,29 1015 c 1 |
постоянная Ридберга |
|||||||||

Ультрафиолетовая область спектра
|
1 |
|
1 |
|
n 2,3,4,... |
|
||
v R |
|
|
|
|
|
|
серия Лаймана |
|
2 |
|
2 |
||||||
|
1 |
|
n |
|
|
|
|
|
Инфракрасная область спектра
|
1 |
|
|
1 |
|
|||
v R |
|
|
|
|
|
|
|
|
32 |
|
|
|
|||||
|
|
|
|
n2 |
||||
|
1 |
|
|
1 |
|
|||
v R |
|
|
|
|
|
|
|
|
|
42 |
|
|
|
||||
|
|
|
n2 |
|||||
|
1 |
|
1 |
|
v R |
|
|
|
|
52 |
|
|||
|
|
n2 |
||
1 1
vR 62 n2
n 4,5,6,... |
серия Пашена |
n 5,6,7,... серия Брэкета
n 6,7,8,... |
серия Пфунда |
n 7,8,9,... серия Хэмфри
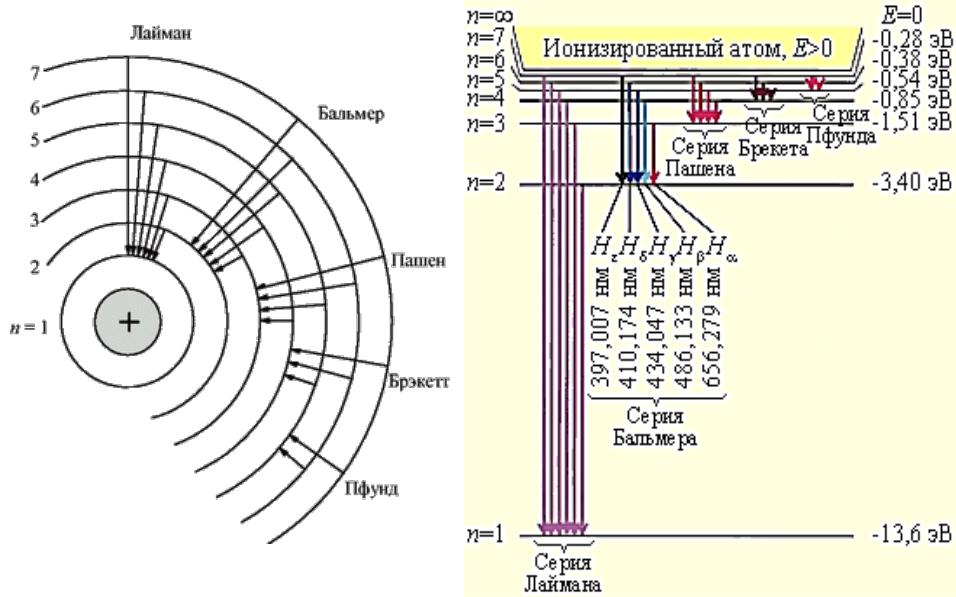
обобщенная формула Бальмера
|
1 |
|
1 |
|
v R |
|
|
|
|
|
n2 |
|||
m2 |
|
|
||
m - определяет серию спектра,
n - определяет отдельные линии этой серии
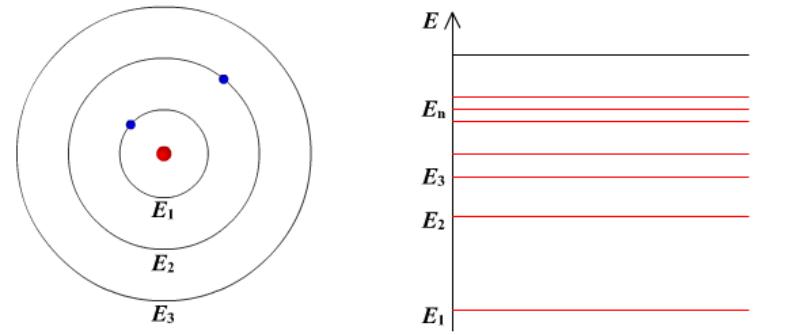
Постулаты Бора
Первый постулат Бора (постулат стационарных состояний):
в атоме существуют стационарные (не изменяющиеся со временем) состояния, в
которых он не излучает энергии
