Травень В.Ф. - Органическая химия. В 3 т. Т. 3
..pdf
Механизмы реакций синтеза гетероциклических соединений |
261 |
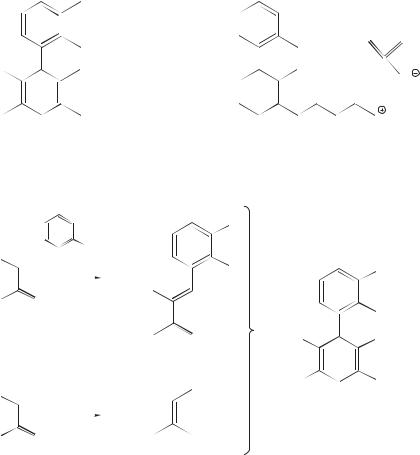
В состав нуклеиновых кислот входят также и производные пурина — аденин и гуанин. Эти производные называют пуриновыми основаниями.
NH2 |
|
|
O |
|
||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
HN |
|
|
N |
|||
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
N |
NH |
H2N N NH |
||||||||
аденин |
гуанин |
|
||||||||
И пиримидин, и пурин имеют плоские молекулы и замкнутые сопряженные π-электронные системы. Эти соединения и их производные также относятся к числу гетероароматических соединений.
Фрагменты пиримидина и пурина входят в состав и других природных соединений. Кофеин содержится в кофе и чае. Теобромин содержится в чае и какао.
|
O |
|
O |
||||||||
CH3 N |
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|||||||
|
|
N |
HN |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
||||
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
O |
N N |
O |
N N |
||||||||
|
|
|
|
|
|
||||||
|
CH3 |
|
CH3 |
||||||||
|
кофеин |
|
|
теобромин |
|||||||
Для углубленного изучения!
МЕХАНИЗМЫ РЕАКЦИЙ СИНТЕЗА ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ
Изучение механизмов синтеза гетероциклических соединений представляет интерес, по крайней мере, по двум причинам. Во-первых, гетероциклические соединения составляют, по некоторым оценкам, около двух третей всех органических соединений; во-вторых, синтезы гетероциклических соединений, как правило, основаны на многокомпонентных реакциях и проводятся в «одноколбовом» варианте. Это обстоятельство представляет химику уникальную возможность проследить, каким образом более простые органические реакции «работают» в тандеме и приводят к синтезу весьма сложных структур.
В качестве примеров в этом разделе обсуждаются некоторые наиболее известные именные реакции синтеза гетероциклических соединений.
262 |
Для углубленного изучения |
Синтез пирролов по Кнорру
Этот метод основан на реакции α-аминокетона и 1,3-дикарбонильного соединения [1]. Наиболее известный пример такого синтеза представляет собой получение «пиррола Кнорра» — 2,4-дикарбэтокси-3,5-диметил- пиррола [2]. Реакция проводится в одной колбе, протекает с выходом до 64% и включает следующие стадии:
O O |
|
NaNO2 |
O O |
|
Zn/CH3COOH |
|
O O |
|
||||
|
|
CH3COOH, H2O |
|
|
|
H2O, t |
|
|
|
OEt |
||
|
OEt |
|
|
OEt |
|
|
|
|||||
ацетоуксусный |
NOH |
|
NH2 |
|
||||||||
эфир |
|
|
|
|
|
|
|
|
|
|
|
|
Me |
O |
CO2Et |
|
|
Me |
|
|
CO2Et |
||||
|
|
|
|
|
|
|
|
|||||
|
+ |
|
|
CH3COOH |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
t |
|
|
|
|
|||||
|
|
|
|
|
|
N |
|
|
||||
EtO2C |
NH2 O |
Me |
|
|
EtO2C |
|
|
Me |
||||
|
|
H |
||||||||||
|
|
|
|
|
||||||||
пиррол Кнорра
Заключительная стадия синтеза — взаимодействие α-аминокетона и ацетоуксусного эфира — протекает по следующему механизму
|
O |
CO2Et |
|
O |
CO2Et |
|
Et2OC |
NH2 |
O |
Et2OC |
N |
OH |
–ОH |
|
||||||
|
|
|||||
|
|
|
|
H |
|
|
|
|
B |
|
|
|
|
|
|
H |
|
|
|
|
|
|
O |
CO2Et |
O |
CO2Et |
|
|
|
CO2Et N |
CO2Et N |
|
|
|
|
|
H |
|
H |
|
|
|
|
CO2Et |
|
CO2Et |
CO2Et |
|
HO |
H B |
|
|
|
|
|
|
|
|
H |
|
EtN |
|
|
CO2Et N |
|
N |
CO |
|
|
|
|
CO2Et H |
2 |
H |
|
|
|
H |
|
|
|
||


264 |
Для углубленного изучения |
Синтез индолов по Фишеру
Один из наиболее известных методов синтеза индолов в 1883 г. был открыт Эмилем Фишером [5–9]. В простейшей форме этот метод предполагает нагревание альдегида или кетона с фенилгидразином в кислой среде:
|
|
NH |
+ |
CH3COOH |
|
||
|
|
t |
|
||||
|
|
2 |
O |
|
|||
N |
N |
||||||
|
|
|
|
||||
H |
|
|
H |
||||
Первая стадия в механизме образования индола в этой реакции — получение фенилгидразона, который, как правило, может быть выделен в качестве стабильного соединения:
|
NH2 |
+ |
CH3COOH |
||||
|
|
|
|
|
|
||
|
|
|
|
N |
|||
N |
O |
|
N |
||||
|
|
|
|
|
|||
H |
|
|
H |
||||
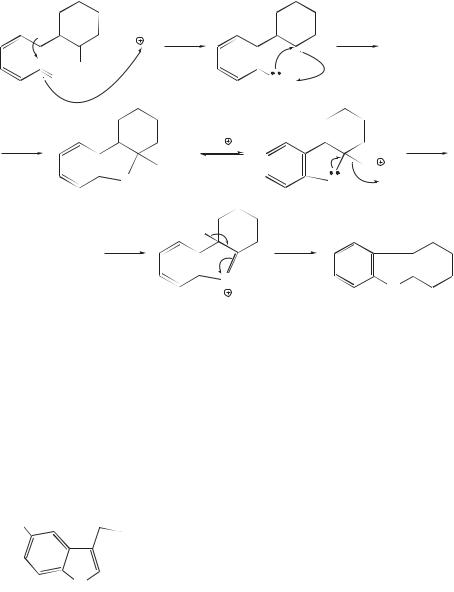
Фенилгидразон таутомеризуется далее до енамина, после чего имеет место [3,3]-сигматропная перегруппировка с образованием сильной С—С-связи и разрывом слабой N—N-cвязи с перемещением электронов в 6-членном цикле:
H
|
|
|
|
|
|
H |
[3,3] |
|||
H |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|||||
N |
|
|
|
|
NH |
|||||
|
|
|
|
|
||||||
|
N |
N |
||||||||
|
|
|
|
|
|
|
|
|||
H |
H |
|||||||||
NH
N
H
Затем следует реароматизация бензольного кольца с перемещением протона от С-атома к N-атому. Образовавшаяся NН2-группа внутримолекулярно атакует соседнюю иминогруппу, давая аминаль — N-эквивалент ацеталя. Опытами с мечеными атомами показано, что атом азота, связанный с
266 |
Для углубленного изучения |
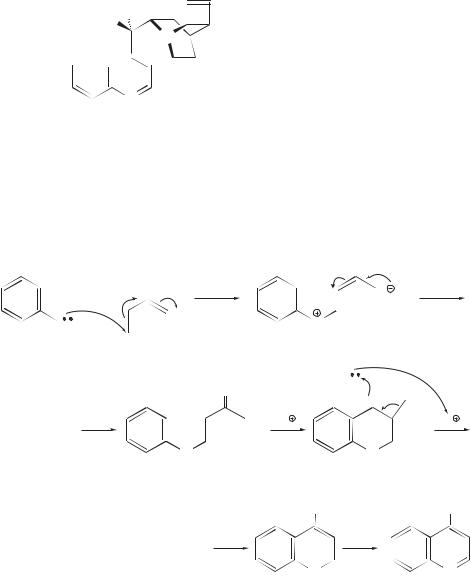
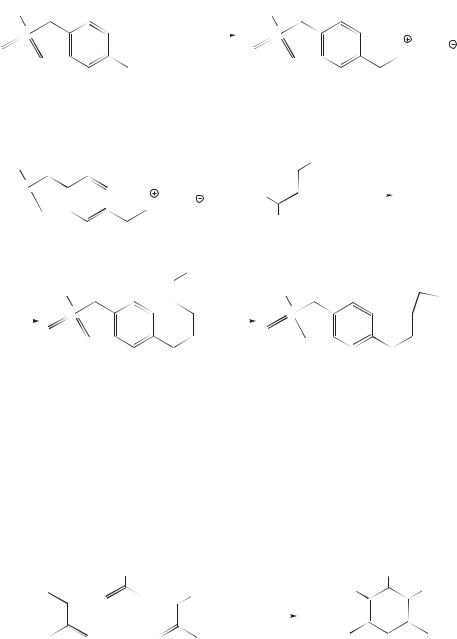
Другой пример применения метода Фишера дает синтез суматриптана (торговое название «Имигран»). Производное арилгидразина в этом синтезе получают по схеме
PhO |
|
|
|
|
|
|
PhO |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
1. NaNO2, HCl |
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
S |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
2. SnCl2, HCl |
|
|
|
|
|
|
|||||||
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
NH3 Cl , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
O |
|
|
|
|
|
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
NH2 |
|
|
|
|
|
N |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
||
а второй компонент реакции — 3-цианопропаналь — применяют в виде ацеталя, чтобы предотвратить его самоконденсацию. В присутствии кислоты ацеталь гидролизуется до альдегида, который и образует гидразон.
PhO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ EtO |
|
|
|
|
|
|
|
|
|
|
||
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
NH3 |
Cl |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
OEt |
|||||||||||||||||
|
|
|
|
|
арилгидразин |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
ацеталь 3-цианопропаналя |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CN |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
PhO |
|
|
|
|
|
|
|
|
|
|
|
|
|
PhO |
|
|
|
|
|
|
|
CN |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
|
|
|
|
|
|
|
|
|
|
ПФК |
|
|
|
|
S |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
N |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
гидразон |
|
|
|
|
|
|
|
|
|
|
|
суматриптан H |
||||||||||
«Имигран» — противомигренозное средство, которое представляет собой специфический и селективный агонист 5-НТ1-серотониновых рецепторов, локализованных преимущественно в сосудах головного мозга.
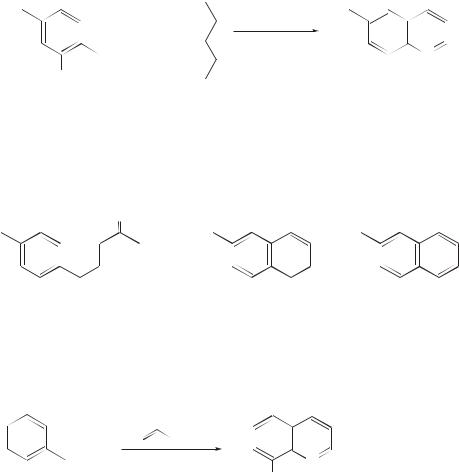
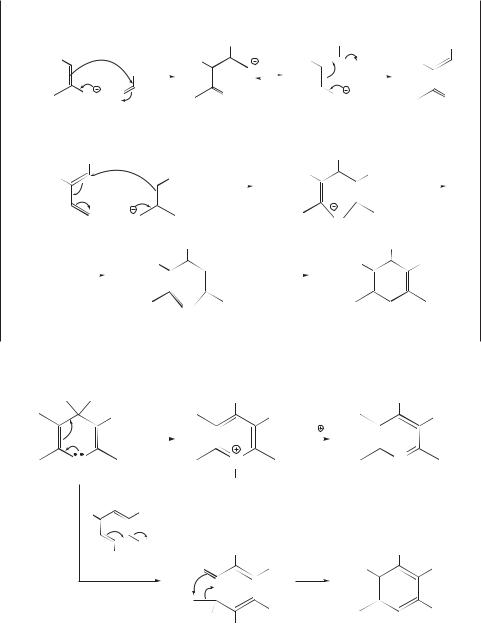
Синтез пиридинов по Ганчу
Ганч открыл свою уникальную реакцию синтеза пиридинов в 1881 г. [10]. Четырехкомпонентная реакция включает две молекулы кетоэфира, молекулу аммиака и молекулу альдегида. Ее продуктом оказывается молекула дигидропиридина, которая окисляется до производного пиридина действием HNO3, Ce(IV) или хинона:
|
|
|
|
|
|
R |
|
|
|
R |
|||||
EtO2 |
|
|
|
|
|
|
|
|
|
|
|
|
EtO2C |
|
CO2Et |
C |
|
|
|
|
|
|
|
|
|
O2CEt |
|
|
|||
|
|
|
O |
+ |
H |
|
|
|
EtOH |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH 8,5 |
|
|
||||||
|
|
|
|
|
|
|
N |
|
|||||||
|
|
|
O |
|
NH3 |
O |
|
|
|
|
|
||||
|
|
|
|
|
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||
Механизмы реакций синтеза гетероциклических соединений |
267 |
Реакция демонстрирует прекрасный пример молекулярного распознавания малыми молекулами. Ее механизм неоднократно изучался, в том числе с применением методов 15N и 13C ЯМР-спектроскопии [11].
Образовавшийся на первой стадии продукт имеет две карбонильные группы на одном конце двойной связи
EtO2C |
|
|
|
|
|
H |
R |
|
EtO |
|
C |
R |
|
|
|
|
R |
|||||
|
|
EtO |
C |
|
|
|
|
|
|
|
EtO |
|
C |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
R |
2 |
|
|
O |
2 |
|
|
OH |
2 |
|
|
|||||||||
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
O |
H |
O |
O |
O |
и поэтому является очень хорошим акцептором нуклеофила в реакции Михаэля. Таким нуклеофилом выступает вторая молекула исходного енолята:
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
EtO |
C |
|
|
|
|
|
|
|
CO Et |
|
|
EtO2C |
|
|
|
CO2Et |
||||||||||
2 |
|
|
+ |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OO |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
R |
||||
|
|
|
|
|
|
EtO2C |
|
|
CO2Et NH3 |
EtO2C |
|
|
|
|
CO2Et |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
OO |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
производное
дигидропиридина
Окисление дигидропиридина хиноном сопровождается ароматизацией двух молекул и протекает очень гладко.
|
|
R |
H |
R |
R |
|||||||
EtO2 |
|
|
|
CO2Et EtO2 |
|
|
|
|
||||
C |
|
|||||||||||
|
|
C |
CO2Et EtO2 |
C |
CO2Et |
|||||||
|
|
|
|
|
|
|
|
|
–H |
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
N |
|
N |
H |
|
H |
|
производное |
|
|
|
||
|
CN |
|
|
пиридина |
|
|
|
|
|
O |
CN |
|
|
|
Cl |
O |
CN |
|
CN |
|
Cl |
|
||
|
CN |
HO |
CN |
|
|
O |
H |
|
|
|
OH |
|
|
|
|
|
Cl |
|
|
Cl |
|
OH |
||
|
|
|
|
|
||||
|
|
Cl |
|
|
Cl |
|||
|
|
|
|
|
||||