23.4. Реакции |
|
|
|
191 |
Бромирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N(CH3)2 |
|
|
|
N(CH3)2 |
|
|
|
|
Br2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
CH3COOH, |
|
|
NO2 |
|
|
|
|
|
|
|
20 °C |
|
|
|
N,N-диметил- |
|
|
|
Br |
3-нитроанилин |
|
|
4-бром-N,N-диметил- |
|
|
|
|
|
|
3-нитроанилин |
Ацилирование |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N(CH3)2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
2 |
|
|
COCl2–ZnCl2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH3)2N |
|
C6H4 |
|
C |
|
C6H4 |
|
N(CH3)2 |
|
|
|
20 °C |
|
|
|
|
|
|
|
4,4'-бис(диметиламино)бензофенон
N,N-диметил- анилин
23.4.4. Реакции аминов с азотистой кислотой
Ароматические амины
При взаимодействии первичных ароматических аминов с азотистой кислотой образуются устойчивые соли диазония, которые нашли широкое синтетическое применение (см. гл. 24). Фактическим реагентом при этом взаимодействии является смесь соляной (или серной) кислоты и нитрита натрия:
ArNH2 + 2HCl + NaNO2 |
|
|
|
ArN2 |
Cl + NaCl + 2H2O, |
|
0–5 °C |
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
+ NaNO2 |
+ 2HCl |
|
|
|
|
|
|
|
|
|
0–5 °C |
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N2 |
Cl |
|
|
|
|
|
|
|
|
|
|
+ NaCl + 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3
п-толуолдиазоний- хлорид
Реакцию получения ароматических солей диазония называют диазотированием. Впервые эту реакцию провел П. Грисс в 1858 г.
Вторичные амины при взаимодействии с азотистой кислотой образуют N-нитрозоамины (нитрозамины):
|
NHCH3 |
|
|
N |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
NaNO |
|
|
|
|
CH3 |
+ NaCl + H2O |
|
|
|
2 |
|
|
|
|
|
|
|
|
HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N-метиланилин |
N-нитрозо- |
|
|
|
|
N-метиланилин |
|
Согласно предложенному механизму реакции, нитрозирующим агентом выступает нитрозилхлорид:
HNO2 + HCl |
|
|
|
|
|
NOCl + H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ δ |
|
|
|
|
|
R |
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2NH + Cl |
|
N |
|
|
|
O |
|
|
|
R |
|
N |
|
N |
|
O |
|
R |
|
N |
|
N |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–Cl |
|
|
|
|
|
–H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
Третичные амины ароматического ряда реагируют с азотистой кислотой, но реакция нитрозирования идет не по аминогруппе, а в ароматическое ядро как электрофильное ароматическое замещение. В качестве продукта образуется С-нитрозосоединение:
|
N(CH3)2 |
|
|
|
|
N(CH3)2 |
|
+ HONO |
|
|
|
|
+ H2O |
|
|
N,N-диметиланилин |
|
O |
|
N |
|
|
|
|
|
|
|
п-нитрозо- |
|
|
|
|
N,N-диметиланилин |
Алкиламины
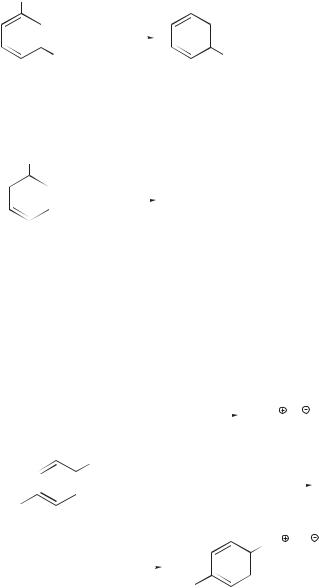
При подкислении водного раствора нитрита натрия образуется ряд частиц, которые могут выполнять роль нитрозирующего агента. Среди этих частиц наиболее активным электрофилом является нитрозил-катион, в заметной концентрации образующийся в концентрированной серной кислоте:
H2SO4
H O N O –HSO4
–HSO4  H O N O
H O N O –H2O
–H2O
 N O
N O + HSO4
+ HSO4

Наиболее простые превращения при взаимодействии с нитрозирующим агентом претерпевают вторичные амины:
R2N +
+  N
N O
O
 R2N N
R2N N O
O

 R2N N
R2N N O
O
–H
H H
N-Нитрозоамины образуются по этой реакции с выходом до 90%.
(C2H5)2NH |
NaNO2, HCl |
(C2H5)2N N |
|
O |
|
|
|
|
|
H O |
|
|
|
2 |
|
|
|
|
диэтиламин |
|
|
|
N,N-нитрозодиэтиламин |
|
|
|
|
(90%) |
|
|
Нитрозоамины встречаются в окружающей среде. Следует отметить, что эти соединения весьма токсичны и могут являться причиной онкологических заболеваний.
|
N |
CH3 |
|
|
O |
N |
|
|
|
N |
|
N |
N |
CH3 |
|
|
|
|
|
|
O |
|
|
|
N-нитрозо- |
N-нитрозо- |
норникотин |
диметиламин |
(присутствует |
(образуется при обработке |
в табачном дыме) |
коки таннином) |
Более сложно протекает нитрозирование первичных аминов. Реакция сопровождается образованием алкандиазониевого иона в качестве промежуточной частицы:
R NH2 NaNO2, H
 R N N
R N N 
 R N
R N N
N
Алкандиазоний-ионы неустойчивы. Поэтому первичные амины алифатического ряда реагируют с азотистой кислотой с выделением азота, образованием спиртов, а также значительного количества алкенов и продуктов изомеризации.
RNH2 + HNO2 + HCl |
|
R |
|
OH + N2 + Cl + H2O |
|
|
|
0–5 °C |
CH3CH2CH2NH2 |
NaNO2 |
|
HCl |
|
1-пропиламин |
|
|
|
CH3CH2CH2OH + CH3CH CH2 + N2 + NaCl + H2O |
пропанол |
пропен |
Реакция диазотирования первичных алифатических аминов препаративного значения не имеет. Однако механизм реакции диазотирования алкиламинов представляет несомненный интерес.
Стадия 1 — образование азотистой кислоты: NaNO2 + HCl → HNO2 + NaCl
Стадия 2 — образование нитрозилхлорида:
→
HNO2 + HCl ← NOCl + H2O
Стадия 3 — получение N-нитрозоамина и его превращение до алкилдиазонийиона:
H
R |
|
NH2 |
+ Cl |
|
δ δ |
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
O |
|
|
|
|
|
|
N |
|
N |
|
O |
|
|
|
|
|
|
|
|
R |
|
N |
|
N |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
–H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N-нитрозоамин |
|
|
|
|
|
|
|
|
R |
|
N |
|
|
N |
|
OH |
|
|
H |
|
|
R |
|
N |
|
|
N |
|
|
O |
|
H |
|
|
|
|
|
R |
|
|
N |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
алкандиазоний- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ион |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Стадия 4 — распад алкандиазоний-иона: R N
N N
N
 R
R + N2
+ N2
Образующийся при разложении диазоний-иона карбокатион стабилизируется далее различными путями: выбросом протона, перегруппировкой или взаимодействием с нуклеофильным агентом, например с водой:
23.5.СПЕКТРАЛЬНЫЙ АНАЛИЗ
ИК-спектры. Характеристическое поглощение аминов в ИК-спектрах связано с валентными колебаниями N–H. Первичные алкил- и ариламины обнаруживают два перекрывающихся пика в области от 3000 до 3500 см–1, что соответствует симметричным и антисимметричным колебаниям N–H.
|
|
|
H |
|
|
H |
R |
|
N |
симметричные |
R |
|
N |
|
|
|
колебания N—H |
|
|
|
|
|
|
H |
|
|
H |
антисимметричные колебания N—H
В ИК-спектре бутиламина, например, эти пики наблюдаются при 3270 и 3380 см–1. В ИК-спектрах вторичных аминов в той же области наблюдается
лишь одиночный сигнал.
ЯМР-спектры. В спектрах ПМР аминов сигналы NH-протонов наблюдаются в несколько более сильном поле (~1,5 м. д.) по сравнению с сигналами
23.5. Спектральный анализ |
195 |
ОН-протонов (~2,0 м. д.) вследствие меньшей электроотрицательности атома азота по сравнению с атомом кислорода. Сигналы NH-протонов также чувствительны к растворителю, изменениям концентрации и температуры.
Аналогичные закономерности в значениях химических сдвигов характерны для спектров 13С ЯМР аминов. В частности, сигнал атома углерода в спектре метиламина наблюдается в более сильном поле, нежели сигнал атома углерода в спектре метанола.
CH3NH2 CH3OH
26,9 м. д. |
49,3 м. д. |
метиламин |
метанол |
Масс-спектры. Как уже отмечалось, соединения, в состав которых входят только атомы углерода, водорода и кислорода, имеют значение m/z для молекулярного иона, равное четному числу. Присутствие атома азота делает это значение в масс-спектрах аминов нечетным.
Наиболее характерное направление фрагментации аминов — β-распад молекулярного иона. Для вторичных и третичных аминов предпочтительно отщепление фрагмента с большей углеродной цепью.
Задача 23.7. В ИК-спектре амина C6H15N в области 3500–3200 см–1 отсутствует поглощение. В спектре ПМР этого соединения присутствуют два синглета δ1 1,00 м. д. и δ2 2,10 м. д. с соотношением интенсивностей 3 : 2. Определите строение амина.
НАИБОЛЕЕ ВАЖНЫЕ ПРЕДСТАВИТЕЛИ
Метиламин CH3NH2 получают взаимодействием метанола и диметилового эфира с NH3. Бесцветный газ, т. кип. –6,5 °С, растворяется в воде и органических растворителях. Применяют в производстве инсектицидов, фунгицидов, ускорителей вулканизации, ПАВ, лекарственных средств, красителей. Т. самовоспл. 410 °С. ПДК в воздухе
1 мг/м3, в воде 1 мг/л.
Триэтиламин (C2H5)3N получают взаимодействием этанола с аммиаком и восстановительным аминированием ацетальдегида. Бесцветная жидкость, т. кип. 89,7 °С, растворяется в воде и этаноле. Применяют в производстве ускорителей вулканизации, ингибиторов коррозии, а также в качестве основного растворителя. Т. самовоспл.
510 °С. Слабо раздражает слизистые оболочки дыхательных путей.
Этилендиамин (1,2-диаминоэтан) H2NCH2CH2NH2 получают взаимодействием 1,2-ди- хлорэтана с аммиаком. Бесцветная жидкость, т. кип. 117,2 °С, растворяется в воде, этаноле, ацетоне. Применяют в производстве ПАВ, гербицидов, лекарств, инсектицидов, а также в качестве присадки к моторным маслам. Т. самовоспл. 403 °С. Раздражает слизистые оболочки верхних дыхательных путей и кожу, поражает печень.
ПДК в воздухе 2 мг/м3, в воде 0,2 мг/л.
Пиперидин (CH2)5NH получают каталитическим гидрированием пиридина. Является структурным фрагментом многих алкалоидов (лобелин, морфин, анабазин). Бес-
196 |
Для углубленного изучения |
цветная жидкость, т. кип. 106,3 °С, смешивается с водой, этанолом и диэтиловым эфиром. Применяют для синтеза лекарственных средств, а также в качестве основного растворителя и компонента смазочных масел.
Анилин C6H5NH2 получают каталитическим восстановлением нитробензола водородом. Бесцветная жидкость, т. кип. 184,4 °С; растворим в воде (6% при 90 °С) и в органических растворителях. Применяют в производстве N,N-диметиланилина, дифениламина, лекарственных средств, антиоксидантов, ускорителей вулканизации и фотоматериалов. ПДК 0,1 мг/м3.
Для углубленного изучения!
ОСНОВНЫЕ И НУКЛЕОФИЛЬНЫЕ СВОЙСТВА ПРОСТРАНСТВЕННО-ЗАТРУДНЕННЫХ АМИНОВ
Закономерности изменения основности и нуклеофильности, рассмотренные в разд. 23.4.1 на примере простейших аминов, не соблюдаются в тех соединениях, которые осложнены пространственными эффектами. В частности, по причине именно этих эффектов основность и нуклеофильность затрудненных аминов не изменяются синхронно.
Вследствие крайне малого размера протона, реакция протонирования значительно менее чувствительна к пространственным затруднениям в амине, нежели, например, его взаимодействие с галогеналканами в реакции SN2. Известны амины, в которых пространственное экранирование неподеленной электронной пары атома азота углеводородными фрагментами резко снижает их нуклеофильность (сродство к углероду), однако практически не сказывается на основности (сродство к протону). Они представляют особый интерес для синтетической практики. Некоторые из таких аминов показаны ниже.
|
5 |
6 |
8 |
|
|
|
5 |
|
|
7 |
N |
9 |
7 6 |
N |
|
|
|
4 |
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
4 |
N |
|
10 |
8 |
N |
|
3 |
|
|
|
|
|
|
3 |
1 |
11 |
|
9 |
1 |
2 |
|
|
2 |
|
|
|
диизопропил- |
1,8-диазабицикло- |
1,5-диазабицикло- |
этиламин (ДИЭА) |
[5.4.0]ундец-7-ен (ДБУ) |
[4.3.0]нон-5-ен (ДБН) |
Вразд. 13.4.3 (т. II) указывалось, что для преимущественного проведения реакции элиминирования Е2 особенно рекомендуются основания, обладающие низкой нуклеофильностью. Их применение подавляет конку-
рирующую реакцию SN2.
Для примера рассмотрим две реакции, каждую из которых удается провести лишь с использованием громоздкого ненуклеофильного основания.
Впервой реакции исходный 1,2-эпокси-4-бромтетрагидронафталин гладко подвергается элиминированию с образованием 1,2-эпокси-1,2-

Основные и нуклеофильные свойства пространственно-затрудненных аминов |
197 |
дигидронафталина, а реакции нуклеофильного замещения и раскрытия оксиранового цикла сведены к минимуму:
O O
ДБН
 1,2-эпокси- Br 1,2-дигидро-
1,2-эпокси- Br 1,2-дигидро-
1,2-эпокси-4-бромтетра- нафталин гидронафталин
Как видим, в этой реакции бициклический амин проявляет только основные свойства и не «работает» как нуклеофил.
Аналогичная ситуация наблюдается и во второй реакции — применение ДИЭА в качестве основания позволяет провести с метиловым эфиром 2-бромметил-3-бромпропановой кислоты только реакцию элиминирования и превратить его в метиловый эфир 2-бромметилакриловой кислоты:
Br |
O |
|
CH2 |
O |
|
|
ДИЭА, 20 °C |
|
|
|
(эфир) |
|
|
Br |
OCH3 |
|
Br |
OCH3 |
метиловый эфир |
|
метиловый эфир |
2-бромметил-3-бром- |
|
2-бромметилакриловой |
пропановой кислоты |
|
кислоты |
Этот пример заслуживает особого внимания, поскольку образующийся продукт является бромидом аллильного типа и отличается исключительной активностью в реакциях SN2.
Вместе с тем, известны примеры пространственных затруднений и в реакциях протонирования аминов. Особенности пространственного строения некоторых аминов таковы, что создают препятствия подходу к НЭП атома азота даже для такой малой частицы, как протон. В частности, по мере увеличения размеров бициклического алифатического амина аминный фрагмент приобретает возможность перехода в эндо-пирамидальную конформацию. В такой конформации находится, например, амин А (6Н-1- азабицикло[4,4,4]тетрадекан) [1, 2]:
H N
N
A
Этот амин обладает очень низкой основностью. Значение рКа его сопряженной кислоты оценивается величиной +0,6. Полагают, что и в растворе,

198 |
Для углубленного изучения |
и в газовой фазе амин А может протонироваться только с «внешней» стороны. Такое предположение подтверждается тем фактом, что энергия инверсии этого амина оценивается величиной 71,2 кДж/моль (17 ккал/моль), практически совпадающей со снижением сродства этого амина к протону по сравнению с трибутиламином.
 ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
Сродство к протону АН(В) измеряется в газовой фазе как энергия гетеролитической диссоциации сопряженной кислоты
Величина сродства к протону, таким образом, не зависит от сольватационных эффектов.
Интересные особенности протонирования и нуклеофильности имеют бициклические амины — аналоги амина А, в которых n-орбиталь атома азота может перекрываться через пространство с n-орбиталью второго N- атома, π-орбиталью С=С-связи или карбонильной группы [3]. Оказалось, например, что в низкоэнергетической области фотоэлектронного спектра 1-азабицикло[4,4,4]тетрадец-5-ена (амин Б), так же как и в спектрах аналогичных бициклических диаминов, имеются две полосы ионизации, что соответствует эффективному взаимодействию через пространство НЭП атома азота и π(С=С)-орбитали.
N
Б
Показанная ниже диаграмма иллюстрирует указанное взаимодействие.
N |
С—H |
N |
|
|
|
|
азабицикло- |
азабицикло- |
бицикло- |
тетрадекан А |
тетрадецен Б |
тетрадецен |
|
|
7,30, (n – π) |
|
7,85, π(N) |
|
8,10, π(С=С) |
Основные и нуклеофильные свойства пространственно-затрудненных аминов |
199 |
Методом молекулярной механики была рассчитана структура амина Б: конформация с «внешней» ориентацией НЭП атома азота оказалась почти на 41 кДж/моль менее устойчивой, чем конформация с «внутренней» ориентацией, благоприятной для перекрывания n(N)- и π(С=С)-орбиталей. Неэмпирическими квантово-химическими расчетами было показано, что указанные орбитали перекрываются, причем энергия такого взаимодействия достигает 0,64 эВ.
Важно отметить, что не только электронные уровни, но и химическое поведение амина Б определяется трансаннулярным взаимодействием НЭП азота и π(С=С)-орбитали. По существу, это соединение ведет себя как енамин. Оно легче окисляется, чем его насыщенный аналог — амин А, а при протонировании легко образует катион В (даже этанол оказывается для амина А слишком сильной кислотой). Будучи растворен в этом растворителе, Б уже через 9 мин при 25 °С полностью превращается в катион В:
Подробное изучение структурных особенностей бициклических аминов А и Б обусловлено тем, что их фрагменты находятся в составе многих алкалоидов, отличающихся высокой биологической активностью и известных как сильные лекарственные средства (атропин, кокаин, хинин, морфин, кодеин и др.). Например, совершенно аналогично амину Б, N-метилтетра- гидроберберин протонируется в этаноле с образованием соответствующего катиона: время полупревращения составляет 2 мин [4].
О
Me
О
 N
N
OMe
OMe
N-метилтетрагидроберберин
Наличие трансаннулярной связи между N-атомом и С-атомом карбонильной группы в молекуле алкалоида Г доказывается данными ИК-спек- тра: значение частоты валентных колебаний С=О-группы, равное 1675 см–1, соответствует карбонильной группе амида, а не арилкетона (1693 см–1). При
200 Для углубленного изучения
протонировании алкалоида Г полоса валентных колебаний С=О исчезает вовсе, что соответствует образованию структуры Д:
MeО |
Me |
MeО |
|
N |
|
Me |
|
H |
|
|
N |
|
|
|
MeО |
О |
MeО |
|
O |
|
|
О |
|
О |
|
|
|
|
Г |
|
Д |
О |
Методом рентгеноструктурного анализа установлено, что НЭП атома азота в молекулах алкалоидов группы тетрагидроберберина направлена внутрь цикла, а атомы азота и углерода сближены. Ниже указаны длины трансаннулярных связей между N и С(О) в некоторых алкалоидах по данным рентгеноструктурного анализа [4, 5].
|
|
OMe |
|
|
О |
|
|
|
|
OMe |
|
|
О |
|
O |
|
|
|
|
O |
|
О |
N |
|
|
|
О |
N |
|
Me |
криптопин, |
Me |
протопин, |
О |
|
0,258 нм |
О |
0,255 нм |
|
|
|
|
O |
|
Me |
|
|
Me |
О |
|
|
Et |
|
|
|
Me |
Me |
|
|
|
|
O |
|
|
|
|
O |
|
|
|
Me |
|
O |
|
|
O |
О |
О |
|
O |
|
|
О |
|
|
|
|
О O |
OH |
О |
|
|
|
|
|
|
|
|
|
|
N |
|
|
кливорин, |
|
N |
ретузамин, |
|
Me |
|
|
|
Me |
O |
|
|
0,199 нм |
|
0,164 нм |
|
|
|
NBs |
|
|
|
H2N |
MeO |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
О |
|
N |
|
|
|
|
MeO |
|
|
О |
N-брозилмитомицин, |
|
|
|
Me |
|
|
|
|
|
|
|
0,149 нм |
|
|
|
Данные о длинах связей между N и С(О) в обсуждаемых алкалоидах оказались интересны тем, что на их основе был составлен пространственный












 H O N O
H O N O

 N O
N O
 +
+  N
N O
O
 R
R O
O

 R
R O
O
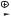
 R N N
R N N 
 R N
R N N
N N
N N
N
 R
R + N
+ N 1,2-эпокси-
1,2-эпокси-  N
N ОБРАТИТЕ ВНИМАНИЕ!
ОБРАТИТЕ ВНИМАНИЕ!
 N
N