
Билет № 4.
2. Расположение нуклеосом на молекуле ДНК. АТФ-зависимое «ремоделирование» хроматина.
Связывание гистонов с ДНК не является специфичным в отношении последовательности так как гистоны не не образуют водородных связей с азотистыми основаниями. Тем не менее, позиционирование нуклеосом на ДНК подчиняется определенным закономерностям. Существует две важных характеристики: СПЕЙСИНГ
ФАЙЗИНГ.
Секвенирование фрагментов ДНК, накрученных на нуклеосомные глобулы, позволило выявить последовательности ДНК предпочтительные и, наоборот, неудобные для посадки нуклеосом. Как изучали? После жесткой обработки стафилококковой нуклеазой, не деградированной остается только ДНК, связанная с нуклеосомными глобулами. Затем выделяли 145 п.н. фрагменты и секвенировали.
Некоторые последовательности ДНК являются предпочтительными для посадки нуклеосом в силу способности легко накручиваться на гистоновый октамер. Другие последовательности, напротив, вообще не могут накручиваться на гистоновый октамер.

С учетом выявленных закономерностей разработано несколько компьютерных программ, позволяющих достаточно точно предсказать расположение нуклеосом на любой последовательности ДНК.
Жесткое позиционирование нуклеосом может препятствовать связыванию транскрипционных факторов. Присутствие нуклеосом на регуляторных последовательностях (например, на промоторах) может создать серьезные проблемы для работы регуляторных механизмов.Эти проблемы решаются при участии комплексов ремоделирования хроматина. Существует три основных группы комплексов ремоделирования хроматина: GROP, PROTOTIPE, ATPase. Пример GROP – Swi/Snf переносит нуклеосому на другой участок ДНК, а одна из PROTOTIPE, а именно NURF передвигает (sliding) нуклеосому от гена. Этот процесс требует затраты АТФ – swi2/snf2 передвигает нуклеосому на 50 п.н. на одну молекулу АТФ, другие ремоделирующие системы – по 10 п.н. на одну АТФ.

Некоторые участки генома (часто места локализации различных регуляторных последовательностей) всегда свободны от нуклеосом. Такие участки генома предпочтительно атакуются нуклеазами (участки гиперчувствительности к нуклеазам).
Билет № 6.
2. Нуклеосома как единица структурной организации хроматина. Октамер гистонов в составе нуклеосомы. Линкер и линкерные гистоны. 30 нм хроматиновая фибрилла.
Упаковка ДНК в клетке осуществляется в несколько этапов:

Компактизация ДНК в ядре осуществляется при посредстве сложного комплекса белков, среди которых принято выделять гистоны и негистоновые белки. Гистоны являются чрезвычайно консервативными белками. Выделяют 5 основных типов гистонов: Н1, Н2А, Н2В, Н3, Н4. Гистоны Н2А, Н2В, Н3, Н4 входят в состав минимальной нуклеосомы (так называемой “Core Particle”). По-этому их нередко называют «коровыми» гистонами. Н1 – линкерный гистон.
К открытию нуклеосом привели две группы экспериментов:
1. Электронная микроскопия препаратов хроматина в низкой ионной силе
2. Анализ продуктов расщепления хроматина стафилококковой нуклеазой
Нуклеосома является базовой структурной единицей первого уровня упаковки ДНК в хроматине. Она представляет собой белковую глобулу, или, точнее говоря некое подобие диска, на который намотан фрагмент ДНК протяженностью 146 п.н. (1,65 витка) Глобула состоит из восьми молекул гистонов: тетрамера (Н3)2-(Н4)2 и двух димеров Н2А-Н2В. Диаметр глобулы-диска составляет ~11 нм, а высота - ~ 5,7 нм.
Модульный принцип посторения нуклеосомнорго ядра отражает характер его сборки:

 Нуклеосомные
частицы не являются вполне идентичными
благодаря модификациям гистонов и
наличию вариантных гистонов. N-концевые
фрагменты гистонов выходят за пределы
нуклеосомного ядра. На них находится
много мишеней для модификаций, имеющих
сигнальное значение. Плюс к рисунку:
полиАДФрибозилирование, которому
подвергается остаток глутаминовой
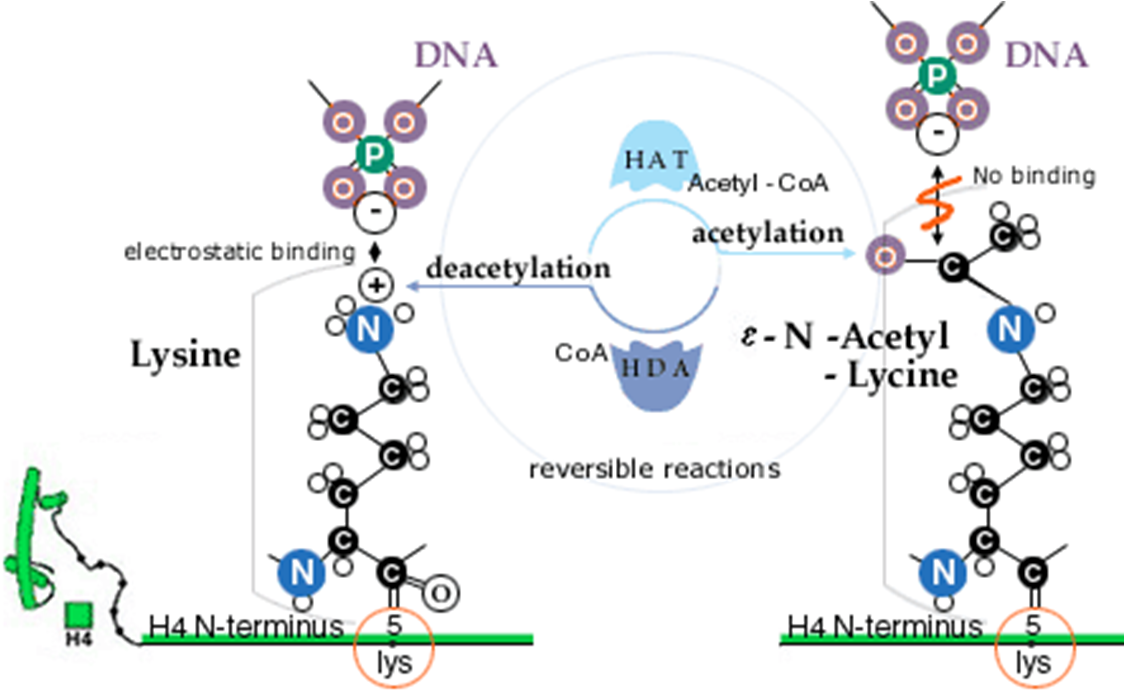
кислоты. В результате ацетилирования
Н4 гистона (лизина на N-конце) положительный
заряд лизина пропадает и связывание
ДНК не происходит.
Нуклеосомные
частицы не являются вполне идентичными
благодаря модификациям гистонов и
наличию вариантных гистонов. N-концевые
фрагменты гистонов выходят за пределы
нуклеосомного ядра. На них находится
много мишеней для модификаций, имеющих
сигнальное значение. Плюс к рисунку:
полиАДФрибозилирование, которому
подвергается остаток глутаминовой
кислоты. В результате ацетилирования
Н4 гистона (лизина на N-конце) положительный
заряд лизина пропадает и связывание
ДНК не происходит.
Метилирование лизина и аргинина:

Убиквитинилирование и сумоилирование – присоединение к остаткам лизина коротких полиептидов (С-концевая аминокислота убиквитина или SUMO присоединяется ε-аминогруппе лизина). Убиквитин – короткий (76 аминокисл. остатков) полипептид. Крайне консервативен (всего три различия между убиквитином человека и дрожжей). SUMO (Small Ubiquitin Modifier) 98 аминокислотных остатков. Присоединение через изопептидную связь (амидная связь между не альфа-аминогруппой лизина гистонов и кабоксильной группой на С-конце пептидов).
Модификации гистонов могут:
1. прямо влиять на свойство октамера гистонов (например посредством
снижения заряда)
2. Выполнять сигнальную функцию, способствую привлечения различных
белков (ГИСТОНОВЫЙ КОД).
Важен не только тип модификации, но и количественные характеристики модификаций. Например, монометилирование и триметилирование лизина могут иметь прямо противоположные последствия.
В последние годы охарактеризовано много «вариантных» форм гистонов, некоторые из которых выполняют специальные функции. Примеры: H1 имеет варианты Н5 в эритроцитах птиц, варианты Н11-Н18 в мышиных клетках. Н2А: macro H2A имеет 64% гомологии с H2A, присутствует в неактивной копии Х хромосомы, Н2А.Х маркирует мишени для репарации. Н3 имеет вариантные формы CENP-A и Cid, встречающиеся в центромерах. Н3.3 – активный хроматин.
«Основные» и «вариантные» формы гистонов кодируются разными генами.
Следующий уровень компактизации – 30 нм фибрилла:

Последние исследования показали, что канонической 30 нм фибриллы просто не существует. В ядре присутствует набор разнообразных компактных хроматиновых фибрилл, толщина которых близка к 30 нм.
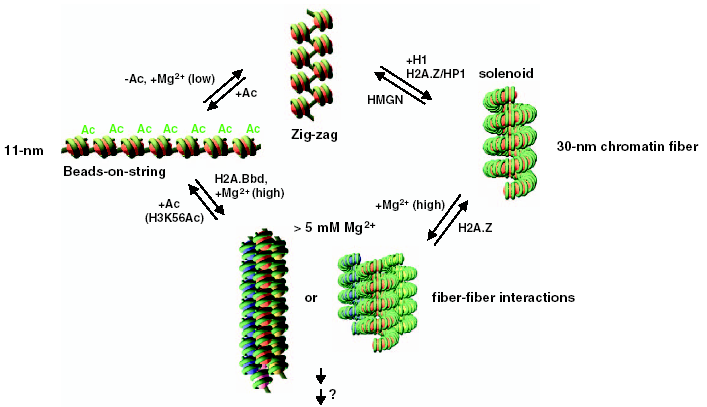
Существует целый ряд факторов, влияющих на степень конденсации хроматина, среди которых наиболее изучено ацетилирование гистонов: выявлено, что ацетилирование ведёт к эухроматинизации (т.е. открытию фибрилл, деконденсации). Распределение ацетилированных форм гистонов в протяженных доменах генома можно изучать с использованием метода иммунопреципитации хроматина (ChIP). Профиль ацетилирования гистонов в общих чертах совпадает с профилем чувствительности к ДНКазе I.
Важную сигнальную роль играет ацетилирование/метилирование гистона H3 по позиции К9 (лизин-9).

Ферменты, выполняющие модификации: гистонацетилазы, гистонметилазы, гистонфосфорилазы. Выполняющие удаление модификаций: гистондеацетилазы и тому подобное. В узнавании сигналов участвуют специфические белковые домены: бромодомен узнаёт ацетилирование К9 в Н3, а хромодомен – метилирование того же остатка. Ферменты, как правило, входят в состав мультисубъединичных комплексов. Например, в такие:

Суммарная информация по влиянию различных модификаций на активность хроматина:
-
Ацетилирование активизирует хроматин, как и метилирование аргинина.
-
Эффект метилирования лизина зависит от позиции.
-
Н3К4 триметилирование – связывание промоторов.
-
Н3К4 диметилирование – связывание энхансеров.
-
Н3К9 ди- и триметилирование ведет к образованию конститутивного гетерохроматина.
-
Н3К27 триметилирование ведет к образованию факультативного гетерохроматина.
Бромодомены (связывание с активным хроматином) содержат следующие белки:
1. RSC комплекс ремоделирования хроматина
2. TAF(II)250/CCG1 (белок, ассоциированный с TFIID)
3. коактиваторы транскрипции полимеразой II (p300)
4. некоторые транскрипционные факторы
Хромодомены (связывание с гистоном Н3, метилированным по К9 или К27, т.е. с неактивным хроматином) содержат эти белки:
1. HP1, Рс
2. Mi2 (AТФазная субъединица комплекса NURF сочетающего ремоделирующую хроматин и гистон-деацетилазную активности).
Ацетилирование Н3К9 может вызвать лавинообразную реакцию гиперацетилирования, благодаря активации НАТ (histone acetylase), имеющей бромодомен.

Создание неактивного хроматина инактивирует гены, как и метилирование ДНК (последнее, напомню, проиходит по CpG сайтам под действием ДНК-метилтрансферазы).
Неактивность хроматина не является конститутивным положением ДНК, а наоборот, требует создания. Важнейшими факторами в гетерохроматинизации являются элементы PEV-системы. PEV связан с упаковкой домена в конститутивный гетерохроматин. Существует целый ряд мутаций, подавляющих PEV (Suvars). Изучение соответствующих генов позволило идентифицировать ключевые белковые продукты, необходимые для поддержания компактной упаковки неактивных доменов. Важнейшими из них являются гистонметилазы и структурные белки гетерохроматина (HP1 у человека, Sir белки у дрожжей). Su(var)3-9 – SET-доменный белок, метилирующий Н3К9, что приводит к конденсации хроматина.
Репликационно-зависимая сборка нуклеосом:
В цитоплазме Н3-Н4 димеры подвергаются ацетилированию Hat1 (которая не участвует в ацетилирование собранных нуклеосом). Затем гетеродимеры транспортируются в ядро шаперонами CAF-1 и ASF-1 (комплексы с ним называются RCAF). Затем CAF1 привлекается PCNA в репликационную вилку, а ASF1 привлекается туда же CAF1. Здесь из гетеродимеров собирается тетрамер. Спустя некоторый лаг-период фермент HDAC1 деацетилирует гистоны. В течение лаг-периода комплекс не устойчив и главные формы гистонов могут быть заменены на варианты. Гетеродимеры Н2А-Н2В собираются в цитоплазме и переносятся в ядро при посредстве шаперона NAP1 (Nucleosome Assembly Protein 1). В ядре они связываются с уже собранными тетрамерами (H3-H4)2. Комплексы ремоделирования хроматина RCF and ACF обеспечивают регулярное распределение нуклеосом.
КАК ЭПИГЕНЕТИЧЕСКИЕ МОДИФИКАЦИИ ВОСПРОИЗВОДЯТСЯ ПОСЛЕ КЛЕТОЧНОГО ДЕЛЕНИЯ?
В случае неактивных доменов важную роль играет DNMT1.

