
БТПп2 / химия 3 семестр . Аналитика / Краткий курс лекций
.pdf31
О.Б. Чалова
Лекция 8. Кривые титрования в методе нейтрализации
Ключевые слова: кривые титрования, процент оттитрованности, рН раствора, точка Эквивалентности, начало скачка, конец скачка.
Качественного подхода при выборе индикатора недостаточно, необходимы количественные методы выбора индикатора. Таких методов два:
1)метод построения «кривых титрования»;
2)метод расчета индикаторной ошибки титрования.
Кривая титрования в методе нейтрализации - это графическая зависимость изменения рН раствора от процента оттитрованности (или от объема добавленного рабочего раствора, или от количества вещества рабочего раствора). Кривая титрования может быть рассчитана либо получена экспериментально - измерением рН раствора в ходе титрования. При расчете кривой титрования, как правило, задаются следующими исходными данными: в колбе для титрования находится VА = 100 мл анализируемого раствора с
концентрацией NА = 0,1 моль/л; в бюретке – рабочий раствор с концентрацией NВ = 0,1 моль/л. Объем рабочего раствора (VВ) - величина переменная,
изменяется от 0 до 200 мл. Поскольку концентрации анализируемого и рабочего раствора одинаковые, по закону эквивалентов из соотношения
NА VА = NВ VВ получаем, что на 1 мл анализируемого раствора расходуется 1 мл рабочего раствора, и в точке эквивалентности объем рабочего раствора VВ =100 мл. Это соответствует 100% оттитрованности, и каждый 1 мл добавленного рабочего раствора соответствует 1% оттитрованности. На кривой титрования в методе нейтрализации выделяют следующие участки:
1участок: до начала титрования. В колбе для титрования – только
анализируемый раствор, VВ = 0 мл; рН раствора определяется свойствами и концентрацией анализируемого раствора.
2участок: от начала титрования до точки эквивалентности.
Добавлено некоторое количество рабочего раствора: 0 <VВ< 100 мл. Реакция между анализируемым и рабочим раствором прошла не полностью, в
колбе для титрования находятся продукты реакции и некоторый избыток анализируемого вещества. На этом участке рассчитывают рН раствора, если добавлено 50, 90, 99, 99,9 мл рабочего раствора. Особенно важной является точка – начало скачка (VВ = 99,9 мл), что соответствует недотитрованности всего на 0,1%.
3 участок: точка эквивалентности.
Добавлено эквивалентное количество рабочего раствора: VВ = 100 мл. Реакция между анализируемым и рабочим раствором прошла полностью, в
колбе для титрования находятся только продукты реакции, нет избытка анализируемого или рабочего раствора; рН раствора определяется свойствами и концентрацией продуктов реакции.

32
4 участок: после точки эквивалентности.
Добавлено избыточное количество рабочего раствора: VВ >100 мл. Реакция между анализируемым и рабочим раствором прошла полностью, в
колбе для титрования находятся продукты реакции и избыток рабочего раствора; рН раствора определяется свойствами и концентрацией избыточного рабочего раствора. На этом участке рассчитывают рН раствора, если добавлено 100,1, 101, 110, 150 и 200 мл рабочего раствора. Особенно важной является точка – конец скачка (VВ = 100,1 мл), что соответствует перетитрованности всего на 0,1%.
При расчете рН используют некоторые упрощения; как правило, не учитывается изменение объема раствора в колбе. В точке эквивалентности объем увеличивается в два раза относительно исходного . Без учета изменения объема в расчет рН вносится погрешность, равная ∆рН = lg2 ≈ 0,3. Такая ошибка на выводах не отразится, и поэтому с ней можно не считаться.
Результаты расчетов записывают в таблицу:
|
Добавлено |
|
0 |
|
50 |
|
90 |
|
99 |
99,9 |
100 |
|
100,1 |
101 |
110 |
150 |
200 |
||
0,1 н. NaOH, мл |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
рН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Характерные |
|
|
|
|
|
|
|
|
Начало |
Точка |
|
Конец |
|
|
|
|
|||
|
|
точки |
|
|
|
|
|
|
|
|
скачка |
экв. |
|
скачка |
|
|
|
|
|
|
|
Строят график в координатах: по оси ординат откладывают рН от 0 до 14, |
|||||||||||||||||
по оси абсцисс - % оттитрованности от 0 до 200. |
|
|
|
|
|
|
|||||||||||||
рН |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
|
|
|
|
|
Линия |
эквивалентности |
|
|
|
|
|
|
|
|
||||
12 |
|
2 участок: |
рН |
от начала |
|
|
|
|
|
|
|
|
|
|
|
||||
11 |
|
титрования |
до |
|
|
точки |
|
|
|
|
|
|
|
|
|
|
|
||
10 |
|
эквивалентности |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 |
|
|
|
|
|
Линия |
нейтральности |
|
|
|
|
|
|
|
|
||||
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
4 участок: рН после точки |
|
|
|
|
|
|
||||
4 |
|
|
|
|
|
|
|
|
эквивалентности |
|
|
|
|
|
|
|
|
||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
100 |
200, % оттитрованности |
|
1 участок |
3 участок: точка |
|
|
|
до начала титрования |
эквивалентности |
|
|
|
Контрольные вопросы
1.Что такое кривая титрования в методе нейтрализации?
2.Какие исходные данные принимают для расчета кривой титрования? 3.Какие участки выделяют на кривой титрования?
4.Что такое начало скачка; конец скачка?
5.Чем определяется рН в растворе?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 127.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.98 - 99.

33
Ф.Н. Латыпова, С.Ю. Шавшукова
Лекция 9. Кривая титрования сильных кислот сильными основаниями
Ключевые слова: кривая титрования, точка эквивалентности, начало скачка, конец скачка, факторы, влияющие на величину скачка, выбор индикатора.
Рассмотрим кривую титрования сильной кислоты сильным основанием, например, 100 мл 0,1н. раствора HCl титруют 0,1н. раствором NаОН.
1 участок: до начала титрования. В колбе для титрования - 0,1н.
раствор НС1, для которого СМ (HCl) = NHCl = 0,1 моль/л. Сильная кислота диссоциирует полностью. При вычислении рН раствора сильной кислоты
концентрацию ионов Н+ можно приравнять к общей концентрации кислоты: HCl → H+ + Cl-.
[H+] = СM (HCl) ; pH = -lg[H+] = -lg0,1 = 1.
2 участок: от начала титрования до точки эквивалентности.
Добавлено некоторое количество раствора NаОН: 0 < VNаОН < 100 мл. Частично прошла реакция между соляной кислотой и щелочью:
HCl + NaOH → NaCl + H2O.
избыток
В колбе для титрования находятся продукты реакции и некоторый избыток раствора соляной кислоты, рН раствора определяется концентрацией оставшейся соляной кислоты, которую рассчитывают по формуле
С΄M (HCl) = [NHCl·VHCl - NNаОН·VNаОН ]/ (VHCl + VNаОН).
Подставим значения концентраций и объемов и для упрощения вычислений будем считать, что общий объем раствора при титровании не меняется. Рассчитываем рН раствора, если добавлено 50, 90, 99, 99,9 мл рабочего раствора NaOH: pH = -lg[H+] = -lg С΄M (HCl);
С΄M (HCl) |
= |
0,1 [100 VNaOH ] |
; |
рН = lg |
0,1 [100 VNaOH |
] |
. |
100 |
100 |
|
|||||
|
|
|
|
|
|
3 участок: точка эквивалентности.
Добавлено эквивалентное количество рабочего раствора: VNаОН = 100 мл. Реакция между растворами соляной кислоты и щелочи прошла полностью, в
колбе для титрования находятся только продукты реакции (NaCl и H2O), рН раствора соли сильной кислоты и сильного основания равен 7.
4 участок: после точки эквивалентности.
Добавлено избыточное количество раствора NaOH: VNаОН >100 мл. В
колбе для титрования находятся продукты реакции и избыток рабочего раствора NaOH; рН раствора определяется концентрацией избыточного раствора щелочи. Сильное основание диссоциирует полностью на ионы:
NaOH → Na+ + OH-.
При вычислении рН раствора сильных оснований концентрацию ионов ОН– можно приравнять к общей концентрации основания, которую в общем случае можно рассчитать по формуле
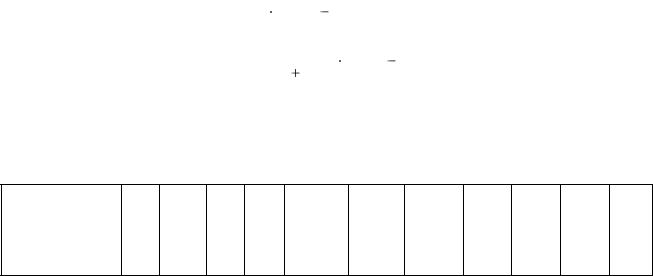
34
[OH-] = С΄M (NаОН) = [NNаОН·VNаОН - NHCl·VHCl]/ (VHCl + VNаОН).
После подстановки значений получаем упрощенную формулу:
- |
|
0,1 [VNaOH |
100] |
|
- |
[OH ] = С΄M (NаОН) |
= lg |
|
|
; |
pOH = -lg[OH ] = - lg С΄M (NаОН); |
100 |
|
||||
|
|
|
|
|
pH = 14 - pOH;
рН =14 lg |
0,1 [VNaOH |
100] |
. |
100 |
|
||
|
|
|
Рассчитываем рН раствора, если добавлено 100,1, 101, 110, 150 и 200 мл рабочего раствора NaOH.
Рассчитанные значения рН при титровании 100 мл 0,1 н. раствора НС1 0,1 н. раствором NaOH приведены в таблице и на кривой титрования (рис.1).
Добавлено |
0 |
50 |
90 |
99 |
99,9 |
100 |
100,1 |
101 |
110 |
150 |
200 |
0,1 н. NaOH, мл |
|
|
|
|
|
|
|
|
|
|
|
рН |
1 |
1,3 |
2 |
3 |
4 |
7 |
10 |
11 |
12 |
12,7 |
13 |
|
|
|
|
|
|
|
|
|
|
|
|
Характерные |
|
|
|
|
Начало |
Точка |
Конец |
|
|
|
|
точки |
|
|
|
|
скачка |
экв. |
скачка |
|
|
|
|
При прибавлении почти всей (99,9 мл) щелочи рН изменяется всего на 3 единицы (от 1 до 4). Переход от 0,1 мл избытка кислоты к 0,1 мл избытка щелочи (от 99,9 мл до 100,1 мл прибавленного NаОН) ведет к изменению рН на 6 единиц (от 4 до 10). Таким образом, вблизи точки эквивалентности происходит резкое изменение рН раствора, на кривой титрования сильной кислоты раствором щелочи присутствует скачок рН от 4 до 10 единиц.
Величина скачка на кривой титрования кислоты основанием зависит от
многих факторов. Во-первых, от силы кислоты и основания: чем слабее кислоты и основания, тем меньше скачок. Поэтому в качестве рабочих
растворов в методе нейтрализации используют только сильные кислоты или сильные основания. Во-вторых, скачок зависит от концентраций растворов: с уменьшением концентрации уменьшается скачок. Например, при титровании растворов с концентрациями N = 1 н. скачок рН лежит в интервале
от 3 до 11 единиц, а с концентрациями 0,01н. скачок изменяется от 5 до 9
единиц рН (рис. 1). Оптимальными в методе нейтрализации являются концентрации 0,1 моль/л, так как с разбавленными растворами уменьшается скачок, а с более концентрированными растворами увеличивается «капельная ошибка», связанная с внесением в конце титрования избыточной капли рабочего раствора.
Рассматривая кривую титрования 0,1 н. раствора соляной кислоты 0,1 н. раствором щелочи, видим, что точка эквивалентности совпадает в данном случае с нейтральной точкой (рН = 7). Очевидно, что может быть употреблен такой индикатор, окраска которого меняется при рН = 7, то есть как раз в точке эквивалентности данного титрования, например лакмус или бромтимоловый синий, показатели титрования которых лежат около 7. Однако, учитывая скачок рН на кривой титрования, видим, что можно применять, например, метилоранж, хотя с ним титрование заканчивают не при рН = 7, а при рН ≈ 4. Действительно, из таблицы и рис.1. видно, что рН = 4 достигается в тот момент, когда прибавлено 99,9 мл раствора NаОН. Следовательно, индикаторная

35
ошибка титрования составляет 0,1 мл на 100 мл или 0,1% недотитрованности. С фенолфталеином титрование заканчивают при рН ≈ 9, и раствор перетитровывается на величину, меньшую 0,1 мл на 100 мл, что соответствует
индикаторной ошибке менее 0,1 %. Отсюда следует основное правило выбора индикатора: для каждого данного титрования можно применять только
те индикаторы, показатели титрования которых лежат в области скачка рН на кривой титрования.
При титровании 0,1 н. растворов сильных кислот сильными основаниями (или обратно) можно применять индикаторы, с показателями титрования от 4 до 10: метиловый оранжевый (рТ≈4,0), метиловый красный (рТ ≈ 5,5), лакмус (рТ ≈ 7), фенолфталеин (рТ ≈ 9), тимолфталеин (рТ≈10). Если же концентрации растворов будут равны 0,01н., то скачок рН лежит в пределах от 5 до 9. Поэтому метилоранж (рТ≈4) и тимолфталеин (рТ≈10) применять нельзя. В этом случае подойдут только такие индикаторы, как метиловый красный (рТ ≈ 5,5), лакмус (рТ ≈ 7), фенолфталеин (рТ ≈ 9).
Скачок является очень важной характеристикой кривой титрования. Если
на кривой титрования скачка нет, не удается подобрать индикатор и , следовательно, прямое титрование оказывается невозможным.
100 |
% оттитрованности |
100 |
% оттитрованности |
Рис. 1. Кривые титрования раствора |
Рис. 2. Кривая титрования 0,1 н. |
||
HCl раствором NaOH в зависимости |
раствора NaOH 0,1 н. раствором HCl |
||
от концентраций |
|
|
|
Кривая титрования 0,1 н. раствора сильного основания 0,1 н. раствором сильной кислоты приведена на рис. 2, из которого следует, что скачок рН лежит также в интервале от 10 до 4 и титрование возможно с теми же индикаторами: метилоранж, метиловый красный, лакмус, фенолфталеин, тимолфталеин.
Контрольные вопросы
1.Какие точки определяют «скачок» на кривой титрования?
2.Какие способы подбора индикаторов можно применять в методе нейтрализации?
3.Какие факторы влияют на величину скачка на кривой титрования?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 127 – 131.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.98 - 99.

36
С.Б. Денисова, О.И. Михайленко
Лекция 10. Кривая титрования слабой кислоты сильным основанием
Ключевые слова: кривая титрования слабой кислоты сильным основанием.
При расчете кривой титрования слабой кислоты щелочью следует учитывать тот факт, что до точки эквивалентности в растворе присутствует буферная смесь, состоящая из неоттитрованной слабой кислоты и ее соли, образованной за счет взаимодействия слабой кислоты со щелочью. В точке эквивалентности в растворе присутствует соль, образованная слабой кислотой и сильным основанием, она подвергается гидролизу по аниону, и среда становится щелочной. За точкой эквивалентности в растворе, как и в случае титрования сильной кислоты, будет находиться в избытке щелочь, и ее содержание в растворе будет определять рН.
Например, построим кривую титрования 100,0 мл 0,1 н. CH3COOH 0,1 н. раствором NaOH.
1 участок: до начала титрования. В первоначальный момент (без добавления NaOH) в растворе присутствует слабая кислота, которая обратимо
диссоциирует: |
|
|
CH3COO- + H+. |
||||
CH3COOH |
|
|
|||||
|
|
||||||
рН исходного раствора слабой кислоты рассчитывают, ис пользуя ее |
|||||||
константу диссоциации: |
|
||||||
Ккисл = |
[CH 3COO ] [H ] |
. |
|||||
[CH |
3COOH ] |
|
|||||
|
|
||||||
В растворе на каждый образующийся катион водорода приходится один |
|||||||
анион кислоты: |
[H+] = [СН3СОО–]. |
||||||
Если степень диссоциации кислоты <5% и выполняется условие |
|||||||
Ккисл/СМ (кисл) < 10-2, то можно принять, что [СН3СООН] ≈ СМ (кисл), тогда |
|||||||
[H ] = 
 КкислСМ (кисл) .
КкислСМ (кисл) .
Расчет рН проводят по формуле
рН = |
1 |
( рКкисл lg CМ (кисл) ) . |
|
2 |
|||
|
|
Для 0,1 н. CH3COOH рН = ½(4,76 – lg0,1) = 2,88.
2 участок: от начала титрования до точки эквивалентности.
Добавлено некоторое количество NaOH (VNaOH < 100 мл). В растворе присутствуют недотитрованная слабая кислота СН3СООН и ее соль CH3COONa, полученная в результате протекания реакции:
CH3COOH + NaOH → CH3COONa + H2O.
CH3COONa (соль) является сильным электролитом, полностью
диссоциирующим на ионы, следовательно, [СН3СОО–] ≈ СМ (соли).
Диссоциация слабой кислоты в присутствии одноименного иона
(СН3СОО–) подавлена, поэтому [СН3СООН] ≈ СМ (кисл).
Таким образом, в растворе до точки эквивалентности присутствуют слабая кислота и соль, образованная этой кислотой и сильным основанием –

37
кислотная буферная смесь. Концентрацию H+ находят из выражения для константы диссоциации слабой кислоты, используя допущенные приближения:
К |
|
= |
СМ (соли ) |
[H ] |
, отсюда [H ]= K |
|
СМ (кисл) |
. |
кисл |
|
|
кисл |
|
||||
|
|
СМ (кисл) |
СМ (соли ) |
|||||
|
|
|
|
|||||
Поскольку |
исходные концентрации |
кислоты и щелочи одинаковые, |
||||||
отношение молярных концентраций оставшейся кислоты и образовавшейся соли в растворе определяется соотношением их объемов:
СМ (кисл)/СМ (соли) = [100 - VNаОН]/(VNаОН).
Поэтому до точки эквивалентности расчет рН ведут по формуле для кислотной буферной смеси:
рН = рКкисл lg |
CМ (кисл) |
; |
|
[100 VNaOH ] |
||
|
рН = рКкисл |
lg |
|
|||
СМ (соли ) |
VNaOH |
|||||
|
|
|
|
|||
3 участок: точка эквивалентности.
В точке эквивалентности (добавлено 100,0 мл 0,1 н. NaOH) в растворе присутствует только соль CH3COONa, образованная слабой кислотой и
сильным основанием, которая подвергается гидролизу по аниону:
CH3COO- + H2O  CH3COOH + OH-.
CH3COOH + OH-.
рН гидролизующейся соли рассчитывается через ее Кгидр:
|
|
|
|
[CH |
3 |
COOH ] [OH ] |
К Н |
О |
|
||||||||||
|
К |
|
= |
|
|
|
|
|
|
|
|
|
|
|
= |
2 |
|
. |
|
гидр |
|
|
|
[CH 3COO ] |
|
Ккисл |
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
Так как [СН3СООН] = [ОН–], а при низкой степени гидролиза |
|||||||||||||||||||
[СН СОО–] ≈ С |
М (соли) |
, поэтому |
|||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
[OH ]2 |
= |
К Н О |
= |
10 |
14 |
, откуда рОН = 7 - ½ рКкисл - ½lgСМ (соли) и |
|||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СМ (соли ) |
|
|
Ккисл |
|
|
Ккисл |
|
|
|
|
|
|||||||
рН = 7 + ½ рКкисл + ½lgСM (соли).
4 участок: после точки эквивалентности. Добавлен избыток раствора
NaOH, который присутствует в растворе вместе с образовавшейся при реакции солью CH3COONa. Гидролиз соли подавлен избыточным количеством гидроксид-ионов, наличие которых и определяет рН раствора на этом участке. После точки эквивалентности расчет рН ведется, как и в случае титрования сильной кислоты щелочью (см. лекцию 9): pOH = -lg[OH-] = - lg С΄M (NаОН);
pH = 14 - pOH; |
рН =14 lg |
0,1 [VNaOH |
100] |
. |
|
|
|||
|
100 |
|
|
|
Результаты вычислений значений рН в ходе титрования слабой уксусной кислоты щелочью приведены в таблице:
Добавлено |
0,0 10,0 50,0 90,0 99,0 99,9 100,0 100,1 101,0 110,0 150,0 200,0 |
0,1 н. NaOH, мл |
рН |
2,88 3,80 |
4,75 |
5,70 |
6,75 |
7,75 |
8,87 |
10 |
11 |
12 |
12,7 |
13 |
Характерные |
|
|
|
|
Начало |
Точка |
Конец |
|
|
|
|
точки |
|
|
|
|
скачка |
экв. |
скачка |
|
|
|
|
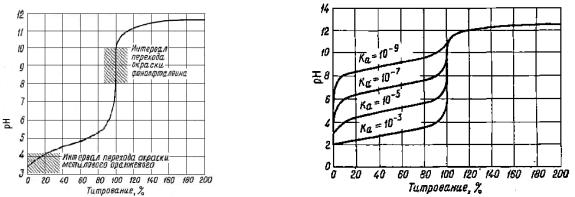
Характерной особенностью кривых титрования слабых одноосновных кислот является несовпадение точки эквивалентности с точкой нейтральности, а также расположение точки эквивалентности в щелочной области рН на
38
кривой титрования (рис. 1). Величина скачка на кривой титрования слабой уксусной кислоты щелочью (от 7,75 до 10) значительно меньше, чем в случае титрования сильной кислоты щелочью. В данном случае в качестве индикатора
можно использовать только фенолфталеин, метилоранж применять нельзя.
Рис. 1. Кривая титрования 0,1 н. раствора |
Рис. 2. Зависимость величины скачка на |
СН3СООН 0,1 н. раствором NaOH |
кривой титрования слабой кислоты щелочью |
|
от константы диссоциации кислоты |
Величина скачка уменьшается с уменьшением концентрации кислоты, с повышением температуры, а также с уменьшением константы диссоциации слабой кислоты. Влияние константы диссоциации слабой кислоты на величину скачка показано на рис 2. Скачок отсутствует, если Kкисл ≤ 10-7. Таким образом,
прямое титрование и определение точки эквивалентности при помощи
индикатора возможно только в том случае, если выполняется условие
Kкисл·СМ(кисл) ≥ 10-8.
Контрольные вопросы
1.Приведите формулу расчета рН слабой кислоты до начала титрования.
2.По какой формуле рассчитывают рН титруемого раствора слабой
кислоты щелочью до точки эквивалентности? Какая система при этом образуется?
3.Как рассчитывают рН в точке эквивалентности при титровании слабой кислоты щелочью? Совпадает ли рассчитанное значение с точкой нейтральности?
4.Как рассчитывают рН после точки эквивалентнсоти при титровании слабой кислоты щелочью?
5.Какие факторы влияют на величину скачка на кривой титрования при титровании слабой кислоты щелочью?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 136 – 140.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 102 - 106.

39
С.Б. Денисова, О.И. Михайленко
Лекция 11. Кривая титрования слабого основания сильной кислотой
Ключевые слова: кривая титрования слабого основания сильной кислотой.
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу по катиону и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Например, построим кривую титрования 100,0 мл 0,1 н. NH4OH раствором 0,1 н. HCl.
1 участок: до начала титрования. В первоначальный момент (без добавления HCl) в растворе присутствует слабое основание, которое обратимо
диссоциирует: |
NH4+ + OH- . |
|
||||||
NH4OH |
|
|
|
|||||
|
|
|||||||
рН исходного раствора слабого основания рассчитывают, используя его |
||||||||
константу диссоциации: |
Косн = |
[NH 4 ] [OH ] |
. |
|||||
[NH 4OH ] |
|
|||||||
|
|
|
|
|
|
|||
В растворе на каждый образующийся гидроксид-ион приходится один |
||||||||
катион основания: |
[OН–] = [NH4+]. |
|
||||||
Если степень |
диссоциации основания |
<5% и выполняется условие |
||||||
Косн/СМ (осн) < 10-2, то можно принять, что [NH4OH] ≈ СМ (осн), тогда
[OH  ] =
] = 
 Косн СМ (осн )
Косн СМ (осн ) 
Расчет рН проводят по формуле
рН = 14 |
1 |
( рКосн lg CМ (осн) ) . |
|
2 |
|||
|
|
Для 0,1 н. NH4OH: рН = 14 - ½(4,76 – lg0,1) = 11,12.
2 участок: от начала титрования до точки эквивалентности.
Добавлено некоторое количество HCl (VHCl <100 мл). В растворе присутствуют недотитрованное слабое основание NH4OH и его соль NH4Cl, полученная в результате протекания реакции:
NH4OH + HCl → NH4Cl + H2O.
Соль NH4Cl является сильным электролитом, полностью
диссоциирующим на ионы, следовательно, [NH4+] ≈ СМ (соли).
Диссоциация слабого основания в присутствии одноименного иона
(NH4+) подавлена, поэтому [NH4OH] ≈ СМ (осн).
Таким образом, в растворе до точки эквивалентности присутствуют слабое основание и соль, образованная этим основанием и сильной кислотой – основная буферная смесь. Концентрацию OН– находят из выражения для

40
константы диссоциации слабого основания, используя допущенные
приближения: |
|
|
|
|
||||
К |
|
= |
СМ (соли ) [OH ] |
|
, отсюда [OH ] = К |
|
СМ (осн ) |
. |
осн |
СМ (осн ) |
осн |
|
|||||
|
|
|
СМ (соли ) |
|||||
|
|
|
|
|
||||
Поскольку исходные концентрации кислоты и основания одинаковые, отношение молярных концентраций оставшегося основания и образовавшейся соли в растворе определяется соотношением объемов:
СМ (осн)/ СМ (соли) |
= |
[100 - VHCl]/(VHCl). |
|
|
|
|
|
||
Поэтому до точки эквивалентности расчет рН ведут по формуле для |
|||||||||
основной буферной смеси: |
|
|
|
|
|
|
|||
рН =14 рКосн |
lg |
CМ (осн ) |
рН =14 |
рКосн |
lg |
[100 |
VHCl ] |
. |
|
|
; |
VHCl |
|||||||
|
|
СМ (соли ) |
|
|
|
|
|||
3 участок: точка эквивалентности. |
|
|
|
|
|
||||
В точке эквивалентности (добавлено |
100,0 |
мл 0,1 |
н. HCl) в растворе |
||||||
присутствует только соль NH4Cl, образованная слабым основанием и сильной кислотой, которая подвергается гидролизу по катиону:
NH4+ |
|
+ H2O |
|
|
|
|
|
|
NH4OH + H+. |
|
|
||||||||
|
|
|
|
|
|
|
|||||||||||||
Для |
гидролизующейся |
|
|
соли рН рассчитывается через ее константу |
|||||||||||||||
гидролиза (Кгидр): |
|
|
|
|
|
|
[NH |
4 |
OH ] |
[H ] |
К Н |
О |
|
||||||
К гидр |
= |
|
|
|
|
|
|
= |
2 |
|
. |
||||||||
|
|
[NH 4 |
] |
Косн |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Так как [NH4OH] = [Н+], а при низкой степени гидролиза [NH4+] ≈ СМ (соли), |
|||||||||||||||||||
поэтому: |
|
[H ]2 |
= |
К |
Н |
О |
|
= |
10 14 |
|
, откуда рН = 7 - ½ рКосн - ½lgСМ (соли). |
||||||||
|
|
|
2 |
|
|
|
|
|
|
||||||||||
|
СM (соли ) |
Косн |
|
|
Косн |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
4 участок: после точки эквивалентности. Добавлен избыток раствора
HCl, который присутствует в растворе вместе с образовавшейся при реакции солью NH4Cl. Гидролиз соли подавлен избыточным количеством катионов водорода, наличие которых и определяет рН раствора на этом участке. После точки эквивалентности расчет рН ведется, как и в случае титрования сильного основания сильной кислотой (см. лекцию 9):
|
|
+ |
|
|
|
|
|
0,1 [VHCl 100] |
|
|
||||
pH = |
-lg[H ] = |
-lg С΄M (HCl); |
|
рН = lg |
|
|
|
. |
|
|
||||
|
|
100 |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Результаты вычислений значений рН в ходе титрования слабого |
||||||||||||||
основания NH4OH сильной кислотой приведены в таблице: |
|
|
|
|
||||||||||
Добавлено |
|
0,0 |
50,0 |
90,0 |
99,0 |
99,9 |
100,0 |
100,1 |
101,0 |
110,0 |
200,0 |
|||
0,1 н. HCl, мл |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
рН |
|
11,13 |
9,25 |
8,30 |
7,25 |
6,25 |
5,13 |
4 |
3 |
2 |
13 |
|||
Характерные |
|
|
|
|
|
Начало |
Точка |
Конец |
|
|
|
|
||
точки |
|
|
|
|
|
скачка |
экв. |
скачка |
|
|
|
|
||
При титровании слабого основания сильной кислотой скачок на кривой титрования (рис. 1) и точка эквивалентности лежат в кислой области значений рН. Величина скачка на кривой титрования гидроксида аммония сильной кислотой (от 6,25 до 4) значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно
