
БТПп2 / химия 3 семестр . Аналитика / Краткий курс лекций
.pdf101
Л.Н. Зорина
Лекция 33. Жѐсткость воды
Ключевые слова: карбонатная, некарбонатная, общая жѐсткость, индикатор, комплексы, эквивалент.
Для определения общей жѐсткости природной воды применяют комплексонометрическое титрование.
Жесткость воды обусловливается наличием в ней ионов Са2+ и Mg2+.
Для большинства производств жесткость воды является основным показателем еѐ качества. Жесткость количественно выражается числом миллимолей
(миллиграмм – эквивалентов) ионов кальция и магния в 1 л воды (ммоль/л;
мг-экв/л; мэкв/л): 1мг-экв/л жесткости соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,15 мг/л ионов Mg2+. Различают жѐсткость общую,
карбонатную и некарбонатную.
Карбонатная жесткость связана с присутствием в воде в основном гидрокарбонатов кальция и магния, которые при кипячении воды переходят в нерастворимые средние или основные соли и выпадают в виде плотного осадка
– «накипи»:
Са(НСО3)2 → СаСО3↓+Н2О+СО2↑;
2Mg(HCО3)2 → (MgOH)2CО3↓ +3СО2↑ +Н2О.
Таким образом, при кипячении карбонатная жесткость устраняется. Некарбонатная (постоянная) жесткость не разрушается кипячением. Она
обусловливается присутствием в воде кальциевых и магниевых солей сильных
кислот, главным образом сульфатов и хлоридов.
Общая жѐсткость воды представляет собой сумму карбонатной и некарбонатной жесткости и обусловливается суммарным содержанием в воде растворенных солей кальция и магния и выражается количеством ммоль эквивалентов в 1 л (ммоль /л, или мэкв/л, мг-экв/л).
Определение общей жесткости воды
Анализируемую воду подщелачивают аммонийной буферной смесью до рН ≈ 10. Индикатором служит обычно хромоген черный, образующий с ионами
Са2+ и Mg2+ растворимые комплексы винно-красного цвета:
Са2+ + HInd2- → CaInd- + Н+ ;
винно-красный
Mg2+ + HInd2- → MgInd- + H+ .
винно-красный
Константы нестойкости этих комплексов равны соответственно 3,9·10-6 и 1·10-7. Смесь титруют раствором ЭДТА, при этом свободные ионы Ca2+ и Mg2+ связываются в более прочные бесцветные комплексы:
Сa2+ + [H2Y]2- → [CaY]2- + 2H+; Mg2+ + [H2Y]2- → [MgY]2- + 2H+.
Константы нестойкости комплексов Са2+ и Mg2+ с ЭДТА гораздо меньше (2,7·10-11 и 2·10-9), поэтому при дальнейшем титровании в точке эквивалентности комплексы металлов c индикатором разрушаются и

102
образуются более прочные комплексы с ЭДТА:
CaInd- + [H2Y]2- |
→ [CaY]2- + HInd- + H+ |
винно-красный |
синий |
MgInd- + [H2Y]2- |
→ [MgY]2- + HInd- + H+ |
винно-красный |
синий |
В эквивалентной точке винно-красная окраска раствора сменяется синей вследствие накопления свободного индикатора (HInd).
По закону эквивалентов:
∑ nэкв(Me2+) = nэкв(ЭДТА) = NЭДТА· VЭДТА.
Следовательно общую жесткость воды можно вычислить по формуле
Жобщ = NЭДТА VЭДТА  1000,
1000,
VH 2O
где VЭДТА и NЭДТА — соответственно объем и нормальная концентрация ЭДТА; VH2O - объем исследуемой воды.
Определение карбонатной жесткости
Временную (или карбонатную) жесткость определяют обычно по методу нейтрализации, измеряя объѐм соляной (или серной) кислоты, пошедшей на титрование пробы воды в присутствии индикатора метилового оранжевого:
Са(НСО3)2 + 2HCl → СаСl2 + H2CО3; HCO3- + H+ → H2O + CO2.
В соответствии с законом эквивалентов: NHCl·VHCl = Nсоли·VH2O.
Отсюда |
Жкарб = |
NHCl VHCl |
1000, |
|
|||
|
|
VH 2O |
|
где Nсоли, NHCl - нормальная концентрация соли и кислоты соответственно; VHCl — объѐм раствора кислоты, пошедшей на титрование, мл;
VH2O — объѐм пробы исследуемой воды, мл.
Определение некарбонатной жесткости.
Некарбонатную жесткость воды (Жнк) рассчитывают по разности:
Жнк = Жобщ - Жкарб.
Контрольные вопросы
1.Жесткость воды, виды жѐсткости.
2.Определение общей жѐсткости воды.
3.Определение карбонатной жесткости.
4.Расчет некарбонатной жѐсткости воды.
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 200203.
2.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 238 - 239.
103
С.Б. Денисова, О.И. Михайленко
Лекция 34. Основные понятия гравиметрии. Классификация методов гравиметрического анализа
Ключевые слова: гравиметрия; методы выделения, осаждения, отгонки; электрогравиметрия; осаждаемая и гравиметрическая (весовая) формы; этапы гравиметрического определения.
Гравиметрия (весовой анализ) – метод количественного анализа, основанный на точном измерении массы определяемого вещества или его составных частей, выделяемых в химически чистом состоянии или в виде соответствующих соединений строго определенного состава. Гравиметрический анализ основан на законе сохранения массы веществ при химических превращениях. К достоинствам гравиметрического метода
можно отнести высокую точность анализа (предел обнаружения гравиметрии составляет 0,1 %, правильность – 0,2 отн. %), а также отсутствие каких-либо стандартизаций или градуировок по стандартным образцам. Он наиболее точный из методов количественного анализа, потому что на аналитических весах можно взвесить вещества с высокой степенью точности. Существенным недостатком метода являются длительность и трудоемкость определения, особенно при серийных анализах большого числа проб. Другим недостатком гравиметрии является неселективность метода – реагенты-осадители за небольшим исключением редко бывают специфичными. Поэтому гравиметрические методы широко используют для стандартизации, а из большинства стандартных исследований гравиметрию вытеснили титриметрические и физико-химические методы анализа.
В гравиметрии используют реакции обмена, замещения, разложения и комплексообразования, а также электрохимические процессы. Гравиметрические методы разработаны для большинства неорганических катионов и анионов, а также для нейтральных соединений, таких как вода, диоксид серы, углекислый газ и йод. Целый ряд органических соединений также можно определить гравиметрически, например лактозу, салицилаты, фенолфталеин, никотин, холестерин и др. Гравиметрические методы делят на три группы: методы выделения, методы отгонки и методы осаждения.
В методах выделения определяемый компонент количественно выделяют в свободном состоянии из анализируемого вещества и взвешивают на аналитических весах. Примером подобного определения является определение процентного содержания золы в твердом топливе, основанное на сжигании и прокаливании до постоянной массы навески топлива в предварительно взвешенном тигле. По массе золы, оставшейся в тигле, вычисляют ее процентное содержание в данном образце твердого топлива. К методам выделения относят также электрогравиметрию – метод количественного анализа, в котором определяемый компонент под действием электрического
104
тока выделяется на одном из электродов электролитической ячейки. В настоящее время ее применяют прежде всего для электровыделения металлов из сложных смесей.
В методах отгонки определяемый компонент анализируемого объекта должен быть летучим или превращаться в летучее соединение по той или иной химической реакции. Методы отгонки подразделяют на прямые и косвенные.
Прямые методы отгонки могут быть применены в следующих модификациях:
–определяемое вещество отгоняют из смеси и образовавшийся отгон взвешивают;
–определяемое вещество отгоняют, поглощают каким-либо поглотителем
ивзвешивают поглотитель, по прибавке в массе определяют количество отогнанного вещества.
В косвенных методах летучий компонент при определенной температуре отгоняют из точной навески, после окончания отгонки навеску снова взвешивают и по разнице в массе определяют количество отгона. Естественно, что в анализируемом веществе должны отсутствовать другие летучие при данной температуре компоненты.
Методы отгонки не универсальны и малочисленны. Наиболее известны два гравиметрических метода, основанные на отгонке, – определение углекислого газа и определение воды. Определение СО2 в карбонатных породах является примером прямого метода отгонки. Оно основано на разложении карбонатов кислотами:
t
CaCO3 + 2H+ → Ca2+ + CO2 + H2O.
Выделившийся СО2 отгоняют в предварительно взвешенный сосуд, содержащий поглотитель (натронная известь – смесь NaOH и CaO, или аскарит
– асбест, пропитанный NaOH):
СО2 + 2NaOH → Na2СО3 + Н2О.
По увеличению массы сосуда судят о содержании СО2 в анализируемом образце.
Определение воды может быть проведено как прямым, так и косвенным методами отгонки. Прямой метод определения основан на поглощении воды каким-либо твердым осушителем, по увеличению массы которого судят о массе воды. Косвенный метод часто используют при определении влажности материалов и кристаллизационной воды в кристаллогидратах, например:
BaCl2·2H2O –t→ BaCl2 + 2H2O.
Методом отгонки также можно определять сульфиды и сульфиты. В этом случае после обработки пробы кислотой сероводород или диоксид серы удаляют из раствора и поглощают подходящим абсорбентом.
В методах осаждения определяемый компонент количественно переводят в малорастворимое соединение (осаждаемая форма). Полученный осадок отделяют, промывают, высушивают или прокаливают. При этом осадок может превратиться в новое вещество строго определенного состава, которое
105
взвешивают на аналитических весах (весовая или гравиметрическая форма). Например, при определении сульфат-ионов методом осаждения их катионами бария, формулы осаждаемой и весовой форм совпадают:
SO42- + Ba2+ → BaSO4↓ |
–t→ BaSO4 . |
|
определяемый |
осаждаемая |
весовая |
компонент |
форма |
форма |
При определении ионов железа, осаждаемых в виде гидроксида, формула весовой формы отличается от формулы осадка:
2Fe3+ + 6OH- → 2Fe(OH)3↓ |
–t→ Fe2O3 . |
|
определяемый |
осаждаемая |
весовая |
компонент |
форма |
форма |
Из перечисленных методов гравиметрии наиболее широко применяют метод осаждения.
Гравиметрическое определение по методу осаждения обычно состоит из нескольких этапов:
1)доведение пустого тигля до постоянной массы;
2)взятие навески;
3)растворение;
4)осаждение определяемого компонента (с пробой на полноту осаждения);
5)созревание (для кристаллических осадков);
6)декантация и фильтрование;
7)промывание осадка;
8)перенос осадка на фильтр;
9)высушивание, обугливание фильтра и прокаливание осадка;
10)доведение тигля с осадком до постоянной массы и взвешивание;
11)вычисление результатов анализа.
Контрольные вопросы
1.Дайте определение гравиметрического анализа и охарактеризуйте его методы.
2.Перечислите достоинства и недостатки гравиметрии.
3.Приведите примеры методов выделения, отгонки и осаждения.
3.Перечислите этапы гравиметрического определения.
4.Что такое осаждаемая форма?
5.Что такое весовая форма?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 281 - 295.
2.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные)
методы анализа. – М.: Высшая школа, 2001. – С. 38 - 46.

106
Л.Е. Салова
Лекция 35. Расчѐт навески. Выбор и расчет осадителя
Ключевые слова: осаждаемая форма, выбор осадителя, расчѐт навески и объѐма осадителя.
Расчѐт и взятие навески анализируемого образца. Допустимая ошибка гравиметрических определений не должна превышать 0,1%. Абсолютная погрешность взвешивания на аналитических весах составляет ± 0,0001 г. С увеличением массы навески относительная погрешность взвешивания
уменьшается: отн. погр. = (0,0001/mнавески). Минимальная навеска (с относительной погрешностью ± 0,1%) рассчитывается следующим образом:
mнавески = (0,0001г ·100%)/0.1% = 0,1 г. То есть минимальная навеска, которую следует взвешивать на аналитических весах, должна быть не меньше 0,1 г.
При выборе навески анализируемого образца исходят из практической целесообразности и удобства работы с осадками. При расчете навески образца следует учитывать, какую структуру имеет осаждаемая форма. Особенно трудоемкой является обработка аморфных осадков. Поэтому для них навеску рассчитывают исходя из минимального необходимого количества получаемой
весовой формы: mосадка ≈ 0,1 г. В зависимости от структуры осадка масса весовой формы может колебаться в следующих интервалах:
аморфный (Fe2О3 ·nH2О) |
≈ 0,1 г |
кристаллический, легкий (СаСО3) |
0,1—0,15 г |
кристаллический, тяжелый (BaSО4) |
0,2—0,4 г |
кристаллический, очень тяжелый (PbSО4) |
до 0,5 г |
Масса кристаллического осадка не должна |
превышать 0,5 г. Это |
обеспечивает удобство работы при фильтровании и промывании осадков. Эти примерные критерии служат основанием для оценки массы пробы (навески), необходимой для анализа. Расчѐт навески анализируемого вещества осуществляют по уравнению реакции, составляя пропорцию или осуществляя расчет через количество вещества (моль) и молярные массы. Например, при определении бария в хлориде бария навеску вычисляют по уравнению реакции.
BaCl |
2H O + H SO |
4 |
BaSO4 + 2HCl +2H2O |
|
2 |
2 |
2 |
|
|
Поскольку из 1 моль BaCl2·2H2O образуется 1 моль BaSO4, можно составить пропорцию:
M(BaCl2·2H2O) =244 г/моль ~ M(BaSO4) = 233 г/моль
m(BaCl2·2H2O) ~ m(BaSO4)
Следовательно: m(BaCl2·2H2O)=m(BaSO4)·M(BaCl2·2H2O)/M(BaSO4)≈0,5·244/233≈ 0,5 г.
Можно рассчитывать массу навески образца через количества веществ. По уравнению реакции: n(BaCl2·2H2O) = n(BaSO4) = m(BaSO4)/M(BaSO4);
m(BaCl2·2H2O) = n(BaCl2 ·2H2O)·M(BaCl2·2H2O).
Так как молярная масса хлорида и сульфата бария близкие по величине, расчетная масса навески равна примерно 0,5 г. Учитывая содержание примесей в анализируемом образце, масса навески может быть увеличена до 1 г.

107
Для аморфных осадков рекомендуемая масса весовой формы равна 0,1г. Например, для анализа содержания железа в нитрате железа (III) проводят цепочку реакций по схеме, в соответствии с которой необходимо учесть соответствующие стехиометрические коэффициенты:
|
6OH- |
|
0 |
|
2Fe(NO ) |
9H O |
2Fe(OH)3 |
t |
Fe2O3, тогда |
3 3 |
2 |
|
|
|
2M(Fe(NO3)3 ·9H2O) |
~ M(Fe2O3) |
|
||
m(Fe(NO3)3 |
·9H2O) ~ |
m(Fe2O3) |
|
|
m(Fe(NO3)3·9H2O) = [m(Fe2O3)·2M(Fe(NO3)3·9H2O)]/M(Fe2O3) = = [0,1·2M(Fe(NO3)3·9H2O)]/M(Fe2O3)
Навеску на аналитических весах взвешивают в специальных чистых и сухих стаканчиках – бюксах. Взятие навески можно провести двумя способами.
1-й способ взятия навески. Предварительно на технических, а затем
аналитических весах определяют массу пустого бюкса (mпустого бюкса). Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и
взвешивают бюкс с навеской сначала на технических, а затем на аналитических весах (m бюкса с навеской). Точную массу навески определяют по разности:
m навески = (m бюкса с навеской - m пустого бюкса).
Взвешенную навеску переносят количественно (без потерь) в химический стакан для приготовления раствора пробы, бюкс тщательно промывают несколько раз небольшими порциями воды (растворителя).
2-й способ взятия навески. Предварительно на технических весах определяют массу пустого бюкса. Затем в бюкс насыпают примерное близкое к рассчитанному количество навески и взвешивают бюкс с навеской сначала на
технических, а затем на аналитических весах (m бюкса с навеской). Навеску переносят количественно (без потерь) в химический стакан, бюкс с остатками
пробы взвешивают на аналитических весах (m пустого бюкса с остатками). В этом случае бюкс не промывают. Точную массу навески определяют по разности:
m навески = (m бюкса с навеской - m пустого бюкса с остатками).
Требования к осаждаемой форме. В методе осаждения определяемый ион переводят в труднорастворимый осадок - осаждаемую форму, который отфильтровывают, промывают, прокаливают и получают весовую форму. Сульфат бария - BaSO4 - это и осаждаемая и весовая формы. В некоторых анализах после прокаливания получают вещество - весовую форму - отличное по составу от осаждаемой формы. Например, Fe(OH)3 – осаждаемая форма, Fe2O3 –весовая форма.
К осаждаемой форме предъявляются следующие требования:
- малая растворимость; чтобы потери определяемого компонента при анализе составляли не более 0,0001 г, осаждение должно протекать количественно, то есть концентрация оставшегося определяемого компонента в растворе не более 10-6 моль/л;
- по возможности иметь кристаллическую структуру, так как кристаллические осадки меньше загрязняются и легче обрабатываются (промываются, фильтруются);

108
- легко превращаться в весовую форму при прокаливании.
Эти требования определяют выбор осадителя. Он должен осаждать количественно определяемый компонент в труднорастворимый осадок и быть летучим веществом, чтобы не загрязнять осадок после прокаливания. Например, при определении ионов бария в хлориде бария в качестве осадителя выбирают раствор серной кислоты, а не растворимую соль – сульфат натрия, потому что во время прокаливания (~ 10000C) сульфата бария избыток осадителя – серная кислота разлагается на летучие продукты: воду и оксид серы. Соль - сульфат натрия - адсорбированная на поверхности осадка загрязняет его, так как при прокаливании не разлагается и таким образом увеличивает массу осадка весовой формы.
Расчѐт необходимого количества осадителя проводят по уравнению реакции, аналогично описанному выше расчету массы навески анализируемого образца. Рассмотрим на примере определения ионов бария и произведем расчѐт по уравнению реакции:
BaCl |
2H O + H SO |
4 |
BaSO4 + 2HCl + 2H2O |
|
2 |
2 |
2 |
|
|
1 моль BaCl2·2H2O взаимодействует с 1 моль H2SO4, составляем пропорцию:
M(BaCl2·2H2O) = 244г/моль |
~ M(H2SO4) = 98 г/моль |
|
m навески(BaCl2 2H2O) |
~ |
m(H2SO4) |
m(H2SO4) = [m навески(BaCl2·2H2O)·M(H2SO4)]/M(BaCl2·2H2O) = m навески(BaCl2·2H2O)·98/244
Для осаждения необходимо использовать очень разбавленные растворы осадителя. Их готовят разбавлением более концентрированных растворов. Рассчитаем необходимый объем 2 н. (1М) раствора серной кислоты. Если концентрация раствора серной кислоты равна 1 моль/л, в 1000 мл раствора содержится один моль кислоты, то есть 98 г. Составим пропорцию:
В 1000 мл 2 н. раствора |
~ 98 г H2SO4 |
V мл 2 н. раствора ~ |
m(H2SO4) |
Следовательно: V = m(H2SO4)·1000/98= (m навески(BaCl2 ·2H2O)·98/244)·1000/98 =
= m навески(BaCl2·2H2O) ·1000/244 ≈ 4 m навески(BaCl2 ·2H2O).
Для количественного полного осаждения объѐм осадителя, следует брать в полтора раза больше рассчитанного:
V(изб) =1,5·V = 1,5·4 m навески(BaCl2 ·2H2O) = 6·m навески(BaCl2·2H2O)(мл).
Контрольные вопросы
1.Как рассчитать минимальную массу навески?
2.Какие требования предъявляются к осаждаемой форме?
3.Как выбрать осадитель и рассчитать объѐм раствора осадителя?
Список рекомендуемой литературы
1.Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С.281 - 295.
2.Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.38 - 52.

109
Л.Е. Салова
Лекция 36. Произведение растворимости. Расчѐт растворимости
Ключевые слова: насыщенный раствор, произведение растворимости, растворимость малорастворимых электролитов.
При проведении гравиметрического анализа для выбора осадителя очень важно рассчитать растворимость осадка и его возможные потери за счѐт растворимости. Раствор, содержащий максимальное количество вещества, которое может раствориться в данном количестве растворителя при данной температуре, называют насыщенным.
Если электролит растворяется в воде мало, то быстро наступает равновесие: вещество в осадке – ионы вещества в насыщенном растворе. Например:
BaSO4 |
растворение |
Ba2+ + SO42- |
||
осаждение |
|
|||
осадок |
насыщенный раствор |
|||
Константа равновесия такого гетерогенного процесса называется
произведением растворимости (ПР) и для нашего примера в отсутствии других сильных электролитов записывается следующим образом:
ПРBaSO4 = [Ba2+]·[SO42-],
где [Ba2+] и [SO42-] - равновесные молярные концентрации соответствующих ионов в насыщенном растворе.
В насыщенном растворе малорастворимого сильного электролита произведение молярных концентраций ионов в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при постоянной температуре.
Численные значения констант (ПР) для стандартной температуры определяются экспериментально и приводятся в таблицах. Выражение для константы ПР определяется составом электролита и его электролитической диссоциацией на ионы. В общем случае для плохо растворимого сильного
электролита, диссоциация которого осуществляется по уравнению:
AnBm  nAm+ + mBn-.
nAm+ + mBn-.
Выражение для константы ПР записывается по следующей форме:
ПР AnBm = [Am+]n ·[Bn-]m,
где [Am+] и [Bn-] – равновесные молярные концентрации соответствующих катионов и анионов в насыщенном растворе; n, m – коэффициенты, показывающие число соответствующих ионов, образующихся при электролитической диссоциации формульной единицы электролита.
Например, для ортофосфата кальция: |
|
|||
Ca3(PO4)2 |
|
|
3 Ca2+ + 2 PO43- |
(уравнение диссоциации) |
|
|
|||
ПРCa3(PO4)2 |
= [Ca2+]3 · [PO43-]2. |
|
||
По величине константы произведение растворимости (ПР) можно рассчитать концентрации ионов в насыщенных растворах, изменение концентрации одних ионов в зависимости от изменения концентрации друг их
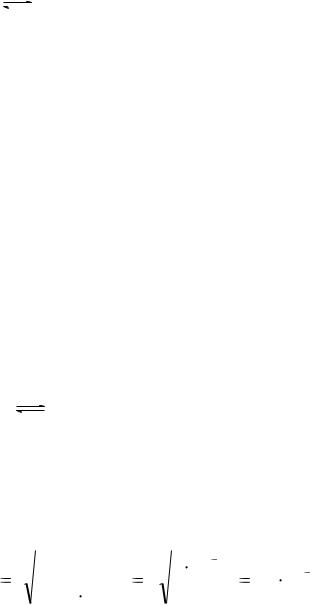
110
ионов, делать предварительные выводы о выпадении, не выпадении или растворении осадков, о влиянии одноимѐнных ионов.
Обычно величины ПР могут быть вычислены по данным растворимостей (S), найденным экспериментальным путѐм. И, наоборот, по величине ПР рассчитывают растворимость плохо растворимых сильных электролитов.
Растворимость - это концентрация насыщенного раствора при данной температуре. Она может быть выражена молярной концентрацией растворенного вещества (моль/л) в насыщенном растворе либо массой (г) растворенного вещества в 1 л насыщенного раствора, либо массой растворенного вещества (г), необходимой для насыщения 100 г растворителя.
Рассмотрим расчѐт растворимости по величине ПP на следующих примерах.
Пример 1. Определить растворимость в воде сульфата бария (BaSO4) в
моль/л и в г/л. |
|
|
|
|
|
|
Решение. |
|
|
|
|||
BaSO4 |
|
|
Ba2+ |
+ |
SO42- |
(уравнение диссоциации) |
|
|
|||||
S моль/л |
|
|
S моль/л |
S моль/л |
|
|
ПРBaSO4 |
= [Ba2+] · [SO42-] |
= 1,1· 10-10 . |
|
|||
Если в 1 л растворилось S моль/л BaSO4, то концентрации ионов в |
||||||
соответствии с уравнением диссоциации равны: |
|
|||||
[Ba2+] = |
[SO42-] = S (моль/л). Подставим это значение в выражение для |
|||||
ПРBaSO4 и получим уравнение с одним неизвестным: |
ПРBaSO4 = S2 . |
|||||
Следовательно, S = |
[ПРBaSO4 ]1/2 = [1,1 ·10-10 ]1/2 = 1,05 ·10-5 моль/л. |
|||||
Расчет массы BaSO4 |
в 1 л насыщенного раствора (растворимости в г/л) |
|||||
осуществляем по соотношению
СBaSO4= S·M(BaSO4) = 1,05·10-5 ·233= 2,45·10-3 г/л.
Поскольку по результатам расчета растворимость сульфата бария в воде: S = 1,05·10-5 > 10-6 моль/л, его осаждение не является количественным, полным при использовании эквивалентного количества осадителя – серной кислоты. Считается, что ион практически полностью осаждѐн, если потерю его массы невозможно взвесить на аналитических весах.
Пример 2. Вычислить растворимость (моль/л) в воде Ca3(PO4)2, если |
|||
ПРCa3(PO4)2= 3 10-33. |
|
|
|
Решение. |
3 Ca2+ |
+ 2 PO43- |
|
Ca3(PO4)2 |
(уравнение диссоциации) |
||
S моль/л |
3S моль/л |
2S моль/л |
|
В соответствии с уравнением диссоциации, если S моль/л Ca3(PO4)2 |
||||||||||
растворилось в 1 л, концентрации ионов равны: [Ca2+] = 3S и [PO43-] = 2S. |
||||||||||
Подставляем эти значения в выражение для ПРCa3(PO4)2, и решаем |
||||||||||
уравнение с одним неизвестным: |
|
|
|
|||||||
ПРCa3(PO4)2 |
= [Ca2+]3 · |
[PO43-]2 = |
3 ·10-33. ; (3S)3· (2S)2 = 3·10-33. |
|||||||
|
|
|
|
|
|
|
|
|
||
SCa3 ( PO4 )2 |
5 |
|
ПРCa ( PO ) |
2 5 |
3 10 |
33 |
1,2 10 7 моль/л. |
|||
|
3 |
|
4 |
|
|
|||||
|
|
3 |
2 |
2 |
|
|
108 |
|||
|
|
3 |
|
|
|
|
||||
