
- •Вычислите, чему равна энтропия 1 г натрия в форме идеального кристалла при 0 k.
- •Через стандартные энергии Гиббса образования
- •Через энтропию и энтальпию
- •Через концентрации ионов
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Часть 2
- •18. Кремний, олово и свинец. Физические и химические свойств. Оксиды и гидроксиды: кислотно-основные и окислительно-восстановительные свой- ства. Соли кремниевых кислот. Биологическая роль углерода.
- •Биологическая роль углерода:
- •19. Бор. Особенности химии бора. Диагональное сходство бора и кремния. Гидриды, оксид и гидроксиды бора. Описание кислотных свойств борной кислоты с помощью теории Льюиса. Бура
- •1. Природные соединения
- •2. Содержание
- •3. Изотопный состав
Часть 2
1.Водород. Изотопы водорода. Свойства водорода. Получение и применение водорода. Гидриды. Классификация гидридов и их свойства. Биологическая роль водорода.
Водород занимает особое положение в Периодической системе элементов; его атомный номер – 1, заряд атома +1, электронная конфигурация атома 1s1. Водород принято относить к первой группе, однако в соответствии с электронной конфигурацией атом водорода может не только отдавать, но и присоединять один электрон. Формально водород можно отнести к галогенам, т.к. для завершения валентного уровня им также не хватает 1 электрона, также можно провести аналогию с 14-ой группой, т.к. их валентный уровень тоже занят наполовину.
Помимо изотопа водорода
(протия)
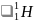 , ядро атома которого представляет
собой элементарную частицу – протон.
Существует еще дейтерий
, ядро атома которого представляет
собой элементарную частицу – протон.
Существует еще дейтерий
 (D), ядро которого содержит протон и
нейтрон; тритий
(D), ядро которого содержит протон и
нейтрон; тритий
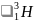 (T), содержащий 1 протон и 2 нейтрона. Также
есть сверхтяжелые изотопы
(T), содержащий 1 протон и 2 нейтрона. Также
есть сверхтяжелые изотопы
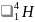 и
и
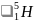 .
В природной смеси протий составляет
99,984 мас. %, дейтерий – 0, 016 мас. %. Тритий
радиоактивен с периодом полураспада
около 12 лет. Время жизни атомов остальных
изотопов составляет доли секунды.
.
В природной смеси протий составляет
99,984 мас. %, дейтерий – 0, 016 мас. %. Тритий
радиоактивен с периодом полураспада
около 12 лет. Время жизни атомов остальных
изотопов составляет доли секунды.
Обычный водород сжижается при температуре 20,6 К, дейтерий - при 23,5 К, тритий – при 25 К.
На Земле водород присутствует только в связанном состоянии, в виде простого в-ва встречается крайне редко.
В химическом отношении с элементами первой группы водород роднит большое количество соединений с водородом в степени окисления +1 и его восстановительные свойства. Однако энергий ионизации водорода больше, чем щелочных металлов, поэтому образование несвязанного иона H+ в реальных химических процессах невозможно.
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
Получение:
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O = H2 + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000°C:
H2O + C = H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O = CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 = 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти
В лаборатории
1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl = ZnCl2 + H2
2.Взаимодействие кальция с водой:
Ca + 2H2O = Ca(OH)2 + H2
3.Гидролиз гидридов:
NaH + H2O = NaOH + H2
4.Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Zn + 2KOH + 2H2O = K2[Zn(OH)4] + H2
5.С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e- = H2 + 2H2O
Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
И с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
N2 + 3H2 = 2NH3
С галогенами образует галогеноводороды:
F2 + H2 = 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 = 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 = CH4
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 = 2NaH
Ca + H2 = CaH2
Mg + H2 = MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O = Ca(OH)2 + 2H2
Оксиды восстанавливаются до металлов:
CuO + H2 = Cu + H2O
Fe2O3 + 3H2 = 2Fe + 3H2O
WO3 + 3H2 = W + 3H2O
Использование:
При производстве аммиака, метанола, мыла и пластмасс
При производстве маргарина из жидких растительных масел
Зарегистрирован в качестве пищевой добавки E949 (упаковочный газ)
Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли водородом. Но в 30-х гг. XX в. произошло несколько катастроф, когда дирижабли взрывались и сгорали. В наше время дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.
Водород используют в качестве ракетного топлива.
Гидриды
Молекулярные гидриды. Водород образует с элементами-неметаллами 13-17 групп молекулярные гидриды с ковалентным типом связи. В простейших случаях их молекулы имеют состав ЭНm, где m – валентность неметалла. Большинство простейших молекулярных гидридов при комнатной температуре являются газами. Водородные соединения элементов второго периода отличаются водородными связями, определяющими аномально высокие температуры кипения и плавления (при стандартных условиях H2O – жидкость).
Кислотно-основные св-ва. При взаимодействии с водой могут проявлять с-ва кислот или оснований. В первом случае среда – кислая, во втором – основная. Водородные соединения элементов 17-ой группы – кислоты, за исключением фтороводорода – сильные. Кислотные св-ва увеличиваются в ряду – HCL – HBr – HI. Кислотные св-ва гидридов 16-ой группы также усиливаются от H2S к H2Te, но они являются гораздо менее сильными кислотами. Водородные соединения 15-ой группы кислотных св-в не проявляют, однако общая закономерность ослабления связывания протонов при движении сверху вниз по группе сохраняется. Но вместо усиления склонности к отдаче протона наблюдается ослабление стремления к его присоединению. Водородные соединения 14-ой группы не могут ни присоединять, ни отдавать протон.
Солеобразные (ионные) гидриды. Наиболее активные металлы – щелочные и щелочноземельные образуют солееобразные гидриды. Связь в этих в-вах по типу близка к ионной и степень окисления водорода равна -1. Эти гидриды представляют собой белые кристаллические вещества, похожие по физическим свойствам на соли. При нагревании они, кроме LiH и CaH2 , еще до плавления разлагаются на металл и водород. В твердом состоянии тока не проводят, но расплавы LiH и CaH2 обладают электропроводностью, связанной с движением ионов. Солеобразные гидриды бурно реагируют с водой с выделением водорода. Являются чрезвычайно сильными восстановителями.
Промежуточные гидриды. BeH2, МgH2, AlH3, GaH3 и InH3 по свойствам занимают промежуточное положение между молекулярными и ионными гидридами. Связь в них является ковалентной, они все – полимерные кристаллические в-ва с мостиковыми многоцентровыми связями.
Металлоподобные гидриды. Гидриды с преимущественно металлическим типом связи; их образуют переходные d- и f-металлы. Металлоподобные гидриды можно рассматривать как концентрированные твердые растворы внедрения, в которых металл сохраняет свою структуру, а атомы водорода заполняют имеющиеся пустоты. Металлоподобные гидриды представляют собой твердые хрупкие в-ва.
Биологическая роль водорода. Входит во все без исключения органические соединения, а также в состав воды. Некоторые архебактерии используют водород как источник энергии. Формирование пространственной структуры белков, а также взаимное распознавание азотистых оснований были бы невозможны без образования водородных связей.
2.Галогены. Строение и свойства атомов. Физические и химические свойства простых веществ. Энергетические диаграммы МО. Фазовые диаграммы. Взаимодействие галогенов с водой. Окислительные свойства галогенов. Биологическая роль галогенов.
Галогены - рождающие соли.
На валентных орбиталях - 7 электронов ns2np5. Являются сильными окислителями, присоединяя ион образуют отрицательно заряженные галогениды.
Хлор, бром, йод, астат имеют степени окисления +1 +3 +5 +7, фтор - с самой высокой электроотрицательностью, имеет только СО -1. От фтора к астату радиусы атома возрастают, уменьшается: энергия ионизации, сродство к электрону, электроотрицательность - неметалл свойства - ослабевают.
Образуют двухатомные молекулы Г2. В ряду F2-Cl2-Br2-I2 прочность связи убывает из за снижения плотности перекрывания валентных орбиталей с ростом главного кв. числа. В этом же ряду увеличивается ван-дер-ваальсово взаимодействие (рост темп. плавления) и снижается окислительная активность.
Физические св-ва
Фтор - бледно-зеленый газ, температура плавления -219оС, кипения -188оС, в воде растворен быть не может, так как интенсивно с ней взаимодействует.
Хлор - желто-зеленый газ, температура плавления -101оС, кипения -34оС, легко сжижается при 20оС и давлении 6 атм (0,6 Мпа), растворимость в воде при 20оС - 2,5 л в 1 л воды. Раствор хлора в воде практически бесцветен и называется хлорной водой.
Бром - красно-бурая жидкость, температура плавления -70оС, кипения +59оС, растворимость в воде при 20оС равна 0,02 г в 100 г воды. Раствор брома в воде - бромная вода - бурого цвета.
Йод - черно-фиолетовые с металлическим блеском кристаллы, плавятся при +113,6оС, температура кипения жидкого йода +185,5оС. Кристаллический йод легко возгоняется (сублимируется) - переходит из твердого в газообразное состояние. Растворимость в воде при 20оС равна 0,02 г в 100 г воды. Образующийся раствор светло-желтого цвета называется йодной водой. Значительно лучше, чем в воде, йод и бром растворяются в органических растворителях: четыреххлористом углероде, хлороформе, бензоле.
Т. кипения/плавления с ряду F2-Cl2-Br2-I2 = -219/-188, -101/-34, -7/60, 113/185
Хим. свойства
- образуют кислородные соединения - оксиды и оксокислоты
- растворимы в спиртах бензоле простых эфирах
- в водном растворе все кроме фтора диспропорционируют, равновесие смещается влево
- фтор окисляет воду
- образую галлогениды с металлами
- убывание окислительной активности: Н2 + Г2 =2НГ (фтор в темноте, хлор на свету, бром ещё и при нагреве, а йод - ещё и обратима)
- вытесняют из солей более слабые Г - хлор вытесняет бромиды и йодиды (Cl2 + 2KBr=Br2+2KCl)
Различная окисл. способность влияет на живые организмы - хлор и бром - отравляющие, а йод - антисептик
Применение:
Хлор - поливинилхлорид, хлорбензол и т.д. для отбеливания тканей, очищения воды, дезинфекции, а производные (KClO3) являются компонентами ракетного топлива.
Бром - как краситель и лекарственный препарат.
Йод - получение металлов высокой степени чистоты, как катализатор в орг. синтезе, как антисептик и лекарство
Получение:
В природе эти элементы встречаются в основном в виде галогенидов (за исключением йода, который также встречается в виде йодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. Основным способом получения простых веществ является окисление галогенидов Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения йода из природных рассолов, богатых I-. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха
В природе встречаются следующие стабильные изотопы галогенов: фтора - 19F, хлора - 35Cl и 37Cl, брома - 79Br и 81Br, йода - 127I.
Галогены в природе находятся только в виде соединений, причем в состав этих соединений галогены входят (за редчайшим исключением) только в степени окисления -1. Практическое значение имеют минералы фтора: CaF2 - плавиковый шпат, Na2AlF6 - криолит, Ca5F(PO4)3 - фторапатит и минералы хлора: NaCl - каменная соль (это же вещество - главный компонент, обуславливающий соленость морской воды), KСl - сильвин, MgCl2 х KCl х 6H2O - карналлит, KCl х NaCl - сильвинит. Бром в виде солей содержится в морской воде, в воде некоторых озер и в подземных рассолах. Соединения йода содержатся в морской воде, накапливаются в некоторых водорослях. Существуют незначительные залежи солей йода – KIO3 и KIO4 - В Чили и Боливии.
Взаимодействие галогенов с водой
Фтор в отличие от других галогенов воду окисляет: 2H2O + 2F2 = 4HF + O2.
Реакция взаимодействия фтора с водой протекает очень бурно с выделением большого кол-ва теплоты. При насыщении льда фтором при -400С образуется соединение HFO.
Из остальных
галогенов лучше всего в воде растворяется
бром, а хуже всего – йод. Водные растворы
хлора, брома и йода называют соответственно
хлорной, бромной и йодной водой. Охлаждая
хлорную воду, можно выделить кристаллогидрат
Сl2 x 6H2O, который при плавлении
разлагается на воду и Cl2. При
растворении хлора в воде теплота
выделяется, поэтому с ростом температуры
растворимость хлора уменьшается. Йод
растворяется в воде с поглощением
теплоты и его растворимость растет с
повышением температуры. Растворимость
брома сопровождается очень малым
тепловым эффектом. Растворимость йода
в воде повышается при добавлении иодида
калия. В результате образуется KI3,
содержащий комплексные ионы
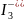 .
Молекулы галогенов в водных растворах
гидратируются и часть их диспропорционируют
с образованием двух кислот –
галогеноводородной и кислородсодержащей:
Г2 + H2O = H+ + Г- +
НГО.
.
Молекулы галогенов в водных растворах
гидратируются и часть их диспропорционируют
с образованием двух кислот –
галогеноводородной и кислородсодержащей:
Г2 + H2O = H+ + Г- +
НГО.
Константы равновесия в ряду галогенов от хлора к йоду уменьшаются.
Окислительные свойства галогенов
Фтор окисляет практически все металлы и неметаллы.
Са + F2 = CaF2
H2 + F2 = 2HF
C + 2F2 = CF4
2P + 5F2 = 2PF5
Единственный из галогенов фтор взаимодействует с кислородом и инертными газам – ксенонов, криптоном и радоном.
O2 + F2 = O2F2 Kr + F2 = KrF2 Xe + 2F2 = XeF4 Хлор менее активен, чем фтор. Тем не менее он реагирует с многими неметаллами (кроме углерода, азота и кислорода) и с подавляющим числом металлов. В атмосфере хлора самопроизвольно загораются порошок сурьмы, белый и красный фосфор. Фтор и хлор реагируют с водородом необратимо, а в случае брома и йода в реакционной смеси устанавливается равновесие. С большинством металлов хлор реагирует при нагревании Сu + CL2 = CuCl2 Бром и йод также достаточно активно реагируют с некоторыми неметаллами и металлами. Например, красный фосфор, алюминий и цинк загораются в жидком броме 3Вr2 + 2P = 2PBr3. Экзотермическая реакция алюминия с йодом начинается после добавления к смеси йода и порошка металла капли воды. Окислительная способность галогенов убывает от фтора к йоду.
Биологическая роль. В живых организмах соединения галогенов выполнят различные физиологические функции и поэтому концентрируются в разных органах. Фтор содержится в зубной эмали и костных тканях. Во многих химических реакциях фторид-ионы играют роль ингибитора. Хлор присутствует в живых организмах в виде хлорид-ионов. Соляная кислота содержится в желудочном соке и участвует в процессе пищеварения, раствора хлорида натрия и хлорида калия участвуют в регулировании осмотических процессов организма, поддержании жизнедеятельности клеточных мембран, активации ферментов. Хлориды входят в состав физиологического раствора. Бром содержится в основном в железах внутренней секреции. Его соединения влияют на работу надпочечников и на состояние центральной нервной системы. Йод участвует в синтезе гормона щитовидной железы тироксина.
Фазовая диаграмма
галогенов:

Энергетическая
диаграмма молекулярных орбиталей
галогенов:
3.Соединения галогенов с водородом. Физические и химические свойства. Свойства водных растворов. Энергетические диаграммы МО. Восстановительные свойства галогеноводородных кислот и галогенид ионов (на примере их взаимодействия с концентрированной серной кислотой).
При стандартных условиях HГ представляют собой газы. Химическая связь в молекулах ковалентная полярная, электронная плотность смещена к более электроотрицательному атому – галогену. Дипольный момент, характеризующий полярность связи, в ряду HF – HCl – HBr – HI уменьшается. В этом же ряду понижается энергия связи и возрастают энтальпия и энергия Гиббса образования.
Фтороводород имеет аномально высокие температуры плавления и кипения, обусловленные способностью молекул HF образовывать друг с другом прочные водородные связи, соединяющие отдельные молекулы в цепи. Способность к образованию водородных связей у хлорводорода значительно ниже, поэтому он плавится и кипит при более низких температурах, чем фтороводород. Далее температуры плавления и кипения бромоводорода и йодоводорода возрастают.
Галогеноводороды обладают высокой растворимостью в воде. Особенно велика она у фтороводорода, что объясняется образованием прочных водородных связей между H2O фтороводородом. Водные растворы галогенводородов являются кислотами. Сила кислот возрастает в ряду HF – HCl – HBr – HI, хотя слабой кислотой является только плавиковая.
Галогеноводородные кислоты по свойствам похожи на большинство разбавленных неорганических кислот Fe + 2HГ = FeГ2 + H2
При взаимодействии с основными оксидами и основаниями они образуют соли – галогениды: MgO + 2HCl = MgCl2 + H2O Ca(OH)2 + 2HBr = CaBr2 + 2H2O
Плавиковая кислота образует не только средние соли, но и кислые.
Фтороводород и плавиковая кислота также реагируют с диокисдом кремния и силикатами.
(Особенностью плавиковой кислоты является способность разъедать стекло.)
Восстановительные свойства галогеноводородов. С увеличением размера и уменьшением энергии ионизации атома галогена восстановительная способность в ряду HF-HCl-HBr-HI увеличивается. Например, плавиковая HF и соляная HCl кислоты с концентрированной серной кислотой не взаимодействуют, а HBr и HI ею окисляются:
2HBr + H2SO4(конц) = Br2 + SO2 + 2H2O
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O.
Газообразные НХ выделяются при действии нелетучих сильных кислот на твердые ионные галогениды металлов: на практике пользуются 70-85%-ным р-ром серной к-ты, т.к. реакция идет на поверхности кристаллов соли. Если брать конц. к-ту, осаждается NaHSO4. При использовании разб. серной к-ты значительная часть HCl остается в р-ре. Выделяющийся HCL сушат над конц. серной к-той. Оксид фосфора для этого непригоден так как взаимодействует с HCL: P4O10 + 12HCL = 4POCl3 + 6H2O
CaF2 + H2SO4(конц) = CaSO4 + 2HF
NaCl + H2SO4(конц) = NaHSO4 + HCl
NaCl + H2SO4(конц.) (150 °C) > NaHSO4 + HCl


4.Оксиды и оксокислоты галогенов. Устойчивость, кислотные и окислитель-но-восстановительные свойства. Свойства солей.
Оксиды хлора – Cl2O, ClO2, Cl2O7. Все они термически неустойчивы и могут быть синтезированы только косвенным путем. Cl2O получают действием хлора на оксид ртути: 2Cl2 + 3HgO = HgCl2 х 2HgO + Cl2O
Сl2O – желто-коричневый газ, взрывающийся без видимых причин уже при комнатной температуре. При взаимодействии с холодной водой или водными растворами щелочей дает хлорноватистую кислоту HClO или ее соли – гипохлориты, т.е. является кислотным оксидом. Сl2O + Н2О = 2HClO, Сl2O + 2NaOH = 2 NaClO + Н2О
ClO2 образуется в виде желто-зеленого газа при взаимодействии хлора с растворами хлоратов некоторых металлов, например с хлоратом серебра Cl2 + 2AgClO3 = O2 + 2AgCl + 2ClO2
Оксид ClO2 тоже неустойчив и разлагается на хлор и кислород уже при небольшом нагревании. Единственный оксид хлора, который, благодаря своим сильным окислительным свойствам, находит практическое применение
Cl2O7 при стандартных условиях – бесцветная жидкость. Наиболее устойчивый из всех оксидов хлора. Получение: 4HClO4 + P4O10 = 4HPO3 + 2Cl2O7
C водой и водными растворами образует хлорную кислоту и перхлораты: Cl2O7 + H2O = 2HClO4, Cl2O7 + 2NaOH = 2NaClO4 + H2O
Оксиды брома и большинство оксидов йода гораздо менее устойчивы и потому менее изучены. Только I2O5 имеет отрицательную энтальпию образования и поэтому устойчив в определенном температурном интервале. Получение: (нагревание в токе сухого воздуха) 2HIO3 = I2O5 + H2O
Гипогалогенитные кислоты HXO известны лишь в разбавленных водных растворах. Их получают взаимодействием галогена с суспензией оксида ртути:
2X2 + 2HgO + H2O = HgO + HgХ2+2HOX.
Гипогалогенитные кислоты являются слабыми.
Растворы гипогалогенитов имеют сильно щелочную реакцию, а пропускание через них СО2 приводит к образованию кислоты, например,
NaClO + H2O + CO2 = NaHCO3 + HClO.
Высокую окислительную способность гипохлоритов иллюстрируют следующие реакции:
NaСlO +2NaI + H2O = NaCl + I2 + 2NaOH
2NaClO + MnCl2 + 4NaOH = Na2MnO4 + 4NaCl + 2H2O.
Из оксокислот HXO2 известны лишь хлористая кислота HClO2. Водные растворы HClO2 получают обработкой Вa(ClO2)2 серной кислотой с последующим отфильтровыванием осадка BaSO4 :
Ba(ClO2)2 + H2SO4 = BaSO4 + 2HClO2
HClO2 является кислотой средней силы: рКа = 2.0. Хлориты используют для отбеливания. Их получают мягким восстановлением ClO2 в щелочной среде:
2СlO2 + Ba(OH)2 + H2O2 = Ba(ClO2)2 + 2H2O + O2
2СlO2 + PbO + 2NaOH = PbO2 + 2NaClO2 + H2O.
Оксокислоты HXO3 более устойчивы, чем HXO. Хлорноватая HClO3 кислота получена в растворах с концентрацией ниже 30%
Растворы HClO3 получают действием разбавленной H2SO4 на растворы соответствующих солей, например,
Ba(ClO3)2 + H2SO4 = 2HClO3 + BaSO4.
При концентрации растворов выше 30% кислоты HBrO3 и HClO3 разлагаются со взрывом.
Водные растворы HXO3 являются сильными кислотами
Соли более устойчивы к нагреванию, чем соответствующие кислоты. В частности, некоторые из йодатов встречаются в природе в виде минералов, например, лаутарит NaIO3. При нагревании твердого КСIO3 до 500оС возможно диспропорционирование 4KClO3 = 3KClO4 +KCl,
Хлорная кислота (Тпл.= -102оС, Ткип.= 90оС) получена в индивидуальном состоянии нагреванием твердой соли КClO4 с концентрированной H2SO4 с последующей отгонкой при пониженном давлении:
КClO4 ,тв.+ H2SO4,конц = HClO4 + KHSO4
HClO4 легко взрывается при контакте с органическими веществами
Хлорная кислота - одна из сильных кислот
Бесцветная концентрированная HClO4 даже при комнатной температуре синтеза темнеет из-за образования оксидов хлора с более низкими степенями окисления.
Устойчивость солей выше, чем соответствующих оксокислот HXO4. Кристаллы солей, например, KClO4, построены из ионов K+ и ClО, электростатическое взаимодействие которых увеличивает энергию кристаллической решетки и повышает стабильность.
5.Элементы 16 группы. Строение и свойства атомов, проявляемые степени окисления. Физические и химические свойства. Оксиды и кислородсодержащие кислоты.
S, Se, Te, Po
Атомы имеют по 6 электронов на sp орбиталях внешнего уровня.
В ряду элементов S-Se-Te-Po уменьшается энергия ионизации и электроотрицательность, увеличивается размер атомов и ионов, усиливаются восстановительные свойства, ослабляются неметаллические признаки. Кислород по ЭО-ти уступает только фтору. Другие элементы (-1), (-2) с металлами, с неметаллами (+4), (+6). В живых организмах - S Se (-2)
Хим. св-ва
Сера
S + 3F2 = SF6
S + Cl2 = SCl2
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
S + 2H2SO4(конц.) = 3SO2 + 2H2O
S + O2 = SO2
2Na + S = Na2S
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Сера
При стандартных условиях устойчива ромбическая сера, которая состоит из циклических молекул S8. Ромбическая сера представляет собой полупрозрачные кристаллы или порошок светло-желтого цвета. Если ее расплавить и медленно охладить, то при кристаллизации расплава получаются игловидные кристаллы моноклинной формы. Моноклинная сера состоит из таких же молекул, как и ромбическая, однако в кристалле они упакованы иначе. Моноклинная сера ниже 95,6 °С превращается в ромбическую. Если расплавленную и нагретую до температуры кипения серу вылить в холодную воду, то можно получить ее пластическую форму. Она похожа на каучук и имеет темно-янтарный цвет. Она состоит из линейных молекул Sn с длиной цепочки в сотни и тысячи атомов. При комнатной температуре она довольно быстро переходит в ромбическую серу.
Селен
Селен — аналог серы. Так же, как и серу, его можно сжечь на воздухе. Горит синим пламенем, превращаясь в двуокись SeO2. Только SeO2 — не газ, а кристаллическое вещество, хорошо растворимое в воде. Получить селенистую кислоту (SeO2 + H2O = H2SeO3) ничуть не сложнее, чем сернистую. А действуя на неё сильным окислителем (например, HClO3), получают селеновую кислоту H2SeO4, почти такую же сильную, как серная.
Химически теллур менее активен, чем сера. Он растворяется в щелочах, поддается действию азотной и серной кислот, но в разбавленной соляной кислоте растворяется слабо. С водой металлический теллур начинает реагировать при 100°С, а в виде порошка он окисляется на воздухе даже при комнатной температуре, образуя оксид Te02.
При нагреве на воздухе теллур сгорает, образуя Te02. Это прочное соединение обладает меньшей летучестью, чем сам теллур. Поэтому для очистки теллура от оксидов их восстанавливают проточным водородом при 500-600 °С.
В расплавленном состоянии теллур довольно инертен, поэтому в качестве контейнерных материалов при его плавке применяют графит и кварц.
Полоний
Металлический полоний быстро окисляется на воздухе. Известны диоксид полония (РоО2)x и монооксид полония РоО. С галогенами образует тетрагалогениды. При действии кислот переходит в раствор с образованием катионов Ро2+ розового цвета:
Ро + 2HCl = PoCl2 + Н2
При растворении полония в соляной кислоте в присутствии магния образуется полоноводород:
Ро + Mg + 2HCl = MgCl2 + H2Po
Оксиды:
Важнейшие и наиболее устойчивые оксиды – SO2 и SO3. SO2 - бесцветный газ с резким запахом. Две двойные связи в молекуле и неподеленная электронная пара в окружении атома серы направлены к вершинам треугольника, поэтому молекула имеет угловое строение с углом между связями 119 градусов. Получение: S + O2 = SO2, 3FeS2 + 8O2 = Fe3O4 + 6SO2, 2H2S +3O2 = 2SO2 + 2H2O
Cернистый газ хорошо растворим в воде. Этот раствор называют сернистой кислотой, хотя молекулы H2SO3 в нем не обнаружены.
Средние соли сернистой кислоты – сульфиты довольно устойчивы и их можно выделить в виде кристаллов. Большинство из них, кроме солей щелочных металлов и аммония, плохо растворимы. Кислые соли – гидросульфиты в чистом виде не выделены. Сернистый газ и сульфиты – сильные восстановители, они окисляются до серной кислоты и ее солей кислородом воздуха, галогенами, пероксидом водорода и другими окислителями:
2Na2SO3 + O2 = Na2SO4, SO2 + Cl2 + H2O = H2SO4 + 2HCl, Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl, SO2 + H2O2 = H2SO4
При взаимодействии с сероводородом сернистый газ проявляет окислительные свойства: SO2 + 2H2S = 3S + 2H2O
SO3 в газообразном состоянии состоит из молекул, имеющих форму правильного треугольника.
2SO2 (г.) + O2 (г.) = 2SO3 (г.) Процесс получения серного ангидрида проходит с катализаторами (платина или оксиды некоторых переходных металлов).
При растворении оксида серы в воде образуется серная кислота и выделяется большое количество теплоты SO3 + H2O = H2SO4. Серная кислота – тяжелая, вязкая, бесцветная маслянистая жидкость, замерзающая при температуре +10,4 градуса. Обладает высокой электропроводностью.
Растворяется в воде с большим экзотермическим эффектом в любых пропорциях.
Концентрированная кислота обладает сильными водоотнимающими свойствами. При взаимодействии с металлами проявляет свойства сильного окислителя, восстанавливаясь преимущественно до SO2. Сu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O, 3Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O Разбавленная кислота реагирует с активными металлами с выделением водорода Zn + H2SO4 (разб.) = ZnSO4 + H2
Серная кислота образует два типа солей – сульфаты и гидросульфаты (кислые). Сульфат-ион имеет тетраэдрическую форму.
Существует большое кол-во кислородсодержащих кислот серы. Существуют соединения, содержащие тиосульфат ионы – K2S2O3
Тиосерная кислота сразу же разлагается. Ее соли являются восстановителями.
Оксиды селена и теллура состава ЭО2 и ЭО3 представляют собой твердые в-ва. Кислотные оксиды.
SeO2 образует соли селенистой кислоты H2SeO3, TeO2 – теллуристой H2TeO3.
SeO3 – соли селеновой H2SeO4, а TeO3 – теллуровой H6TeO6 кислот.
В воде с образованием кислот хорошо растворяются только оксиды селена.
PoO2 проявляет амфотерные свойства.
SeO3 менее термодинамически устойчив, чем SeO2 и при нагревании свыше 180 градусов, он разлагается на SeO2 и кислород.
Для оксидов ЭО2 и кислот Н2ЭО3 характерны как восстановительные, так и окислительные свойства с преобладанием последних. SeO2 + 2SO2 = Se + 2SO3 и H2TeO3 + 2SO2 = Te + H2SO4 + SO3. Для того, чтобы окислить кислородные соединения селена и теллура до состояния +6, требуются сильные окислители. Сила кислот в ряду H2SO3 - H2SeO3 - H2TeO3 падает, а наиболее сильные окислительные свойства у селенистой кислоты.
Селеновая кислота очень похожа на серную. Теллурова кислота не может быть полностью нейтрализована и образует только кислые соли.
Селеновая и теллуровая кислоты являются намного более сильными окислителями, чем серная кислота.
6. Гидриды элементов 16 группы. Закономерности изменения физических и химических свойств. Геометрическое строение молекул. Растворимость и свойства водных растворов (кислотные и окислительно-восстановительные).
В водородных соединениях Н2Э элементы имеют степень окисления (-2). Темодинамическая активность уменьшается от Н2S до Н2Те (по эн. Гибса)
В обычных условиях - это ядовитые газы с неприятным запахом. Т. плавления в ряду Н2S - H2Se - H2Te увеличивается, т.к. с увеличением числа электронов и размеров молекул усиливаются ван-дер-ваальсовы силы.
В растворах ведут себя как двухосновные кислоты. Сила кислот в ряду от Н2S до Н2Те возрастает. Восстановительная способность тоже возрастает. Из-за увеличения атома происходит ослабление связей H - Э.
Сероводород – бесцветный газ с неприятным запахом, напоминающим запах тухлых яиц. Ядовит. По сравнению с водой имеет гораздо более низкую температуру плавления и кипения, что указывает на отсутствие водородных связей. Молекула сероводорода подобно молекуле воды должна иметь угловое строение с углом между связями равным 92 градуса, что, вероятно, обусловлено сильным отталкиванием неподеленных электронных пар в окружении атома серы и слабым отталкиванием между атома водорода. В 1 литре при 20 градусах и давлении 1 атм растворяется 2, 56 л сероводорода, что отвечает концентрации 0,1 моль/литр. Раствор в 0,1 моль/литр называют сероводородной кислотой. Сероводород - восстановитель, при его окислении в водных растворах чаще всего образуется свободная сера. 2H2S + O2 = 2S + 2H2O, H2S + I2 = S + 2HI, 5H2S + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5S.Взаимодействие с сильным окислителем: 4H2S + 2PbO3 = 3PbS + SO2 + 4H2O. Может быть окислен в избытке хлорной воды: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Селеноводород и теллуроводород получают, действуя на селениды и теллуриды водой или разбавленной соляной кислотой: Al2Se3 + 6H2O = 3H2Se + 2Al(OH)3 и MgTe + 2HCl = H2Te + MgCl2. В обычных условиях представляют собой ядовитые газы с неприятным запахом. Образуют водородные связи. При поджигании водородные соединения селена и теллура сгорают с образованием оксидов ЭО. В водных растворах селеноводород и теллуроводород являются более сильными восстановителями, чем сероводород и легко окисляются кислородом воздуха и другими окислителями до простых в-в. От H2S к H2Te повышается температура плавления и кипения, падает энергия связи.
7. Кислород и озон. Физические и химические свойства. Энергетическая диаграмма МО молекулы кислорода. Биологическая и экологическая роль кислорода и озона.
Кислород
4K + O2 = 2K2O
2Sr + O2 = 2SrO
2NO + O2 = 2NO2
CH3CH2OH + 3O2 = 2CO2 + 3H2O
2Na + O2 = Na2O2
2BaO + O2 = 2BaO2
H2 + O2 = H2O2
Na2O2 + O2 = 2NaO2
Кислород — самый распространенный на Земле элемент, на его долю приходится около 47,4 % массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8 %, в атмосфере содержание свободного кислорода составляет 20,95 % по объёму. Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 25 %, по массовой доле — около 65 %. Кислород — химически активный неметалл, простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2). Жидкий кислород имеет светло-голубой цвет.

Сильный окислитель, взаимодействует, практически, со всеми элементами, образуя оксиды. Степень окисления -2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры. Пример реакций, протекающих при комнатной температуре:
4K + O2 = 2K2O
Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:
2NO + O2 = 2NO2
Окисляет большинство органических соединений:
CH3CH2OH + 3O2 = 2CO2 + 3H2O
Кислород не окисляет Au и Pt, галогены и инертные газы.
Кислород образует пероксиды со степенью окисления -1.
Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
2Na + O2 = Na2O2
Некоторые окислы поглощают кислород:
2BaO + O2 = 2BaO2
H2 + O2 > H2O2
Na2O2 + O2 > 2NaO2
Озониды содержат ион O3 - со степенью окисления - 1/3. Получают действием озона на гидроксиды щелочных металлов:
КОН(тв.) + О3 = КО3 + КОН + O2
Ион диоксигенил O2+ имеет степень окисления +1/2. Получают по реакции:
PtF6 + O2 = O2PtF6
Фториды кислорода
Дифторид кислорода, OF2 степень окисления +2, получают пропусканием фтора через раствор щелочи:
2F2 + 2NaOH = OF2 + 2NaF + H2O
Монофторид кислорода (Диоксидифторид), O2F2, нестабилен, степень окисления +1. Получают из смеси фтора с кислородом в тлеющем разряде при температуре 196 °C.
Кислород поддерживает процессы дыхания, горения, гниения.
В свободном виде элемент существует в двух аллотропных модификациях: O2 и O3 (озон).
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
Физические свойства озона: относительная плотность газа по кислороду 1,5; температура кипения —111,9 °C. Жидкий озон — тёмно-синего цвета, температура плавления —251,4 °C. В твёрдом состоянии — чёрно-синего цвета. Растворимость в воде в 10 раз выше по сравнению с кислородом. В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен. Запах — резкий, специфический «металлический».
Химич. Св-ва озона.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы.
2 Cu2+ + 2H3O+ + O3 = 2 Cu3+ + 3H2O + O2
Озон повышает степень окисления оксидов:
NO + O3 = NO2 + O2
8. Вода. Фазовая диаграмма. Геометрическое строение молекулы. Пероксид водорода: физические и химические свойства.
Вода(оксид водорода) — прозрачная жидкость, не имеющая цвета (в малом объёме) и запаха. Химическая формула: Н2O. В твёрдом состоянии называется льдом или снегом, а в газообразном — водяным паром. Около 71 % поверхности Земли покрыто водой (океаны, моря, озера, реки, лёд на полюсах).
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода имеет ключевое значение в создании и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды.
Вода обладает рядом необычных особенностей:
При таянии льда его плотность увеличивается, почти у всех остальных веществ при плавлении плотность уменьшается.
При нагревании от 0 °C до 4 °C вода сжимается.
Высокая температура и удельная теплота плавления, температура кипения и удельная теплота парообразования по сравнению с соединениями водорода с похожим молекулярным весом.
Высокая теплоёмкость жидкой воды.
Высокая вязкость.
Высокое поверхностное натяжение.
Отрицательный электрический потенциал поверхности воды.

По состоянию различают:
Твёрдое — лёд
Жидкое — вода
Газообразное — водяной пар
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов, входящих в молекулу, выделяют следующие виды воды: Лёгкая вода (просто вода), Тяжёлая вода (дейтериевая) и Сверхтяжёлая вода(тритиевая).
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки.
Сама по себе вода относительно инертна в обычных условиях, но её сильно полярные молекулы сольватируют ионы и молекулы, образуют гидраты и кристаллогидраты. Сольволиз, и в частности гидролиз, происходит в живой и неживой природе, и широко используется в химической промышленности.
Водородная связь – межмолекулярная связь, образованная за счет частичного акцептирования неподеленной пары электронов атома не связанным с ним химической связью атомом водорода.
Молекула воды имеет структуру равнобедренного треугольника: в вершине этого треугольника расположен атом кислорода, а в основании его — два атома водорода. Угол при вершине составляет 104°27. Молекула воды представляет собой диполь, содержащий положительный и отрицательный заряды на полюсах.
Пероксид водорода:
Пероксид — вещество, содержащее пероксогруппу -О-О-
Чистый пероксид водорода - бесцветная сиропообразная жидкость, под достаточно уменьшенным давлением прогоняющаяся без разложения. Замерзание сопровождается сжатием. Белые кристаллы пероксида водорода плавятся при -0,5 °С, т. е. почти при той же температуре, что и лёд.
Под обычным давлением чистый Н2О2 кипит при 152 °С с сильным разложением.
Пероксид водорода является сильным окислителем. Так, при действии безводной и даже высококонцентрированной Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Практическое применение пероксида водорода основано главным образом на его окисляющем действии.
Характерный для пероксида водорода окислительный распад может быть схематически изображён так:
Н2О2 = Н2О + О
Кислая среда более благоприятствует этому распаду, чем щелочная.
Значительно менее характерен для пероксида водорода восстановительный распад по схеме:
Н2О2 = О2 + 2Н
Щелочная среда более благоприятствует такому распаду, чем кислая.
При взаимодействии с сильными окислителями пероксид водорода выступает в роли восстановителя, окисляясь до атомарного кислорода: 2AgNO3 + H2O2 = 2Ag + 2O +2HNO3

9. Сера. Аллотропные модификации. Физические и химические свойства. Сероводород. Строение молекулы, свойства водного раствора. Сульфиды. Растворимость сульфидов в воде и кислотах.
Хим. св-ва
Сера
S + 3F2 = SF6
S + Cl2 = SCl2
S + 6HNO3(конц.) = H2SO4 + 6NO2 + 2H2O
S + 2H2SO4(конц.) = 3SO2 + 2H2O
S + O2 = SO2
2Na + S = Na2S
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Сера
При стандартных условиях устойчива ромбическая сера, которая состоит из циклических молекул S8. Ромбическая сера представляет собой полупрозрачные кристаллы или порошок светло-желтого цвета. Если ее расплавить и медленно охладить, то при кристаллизации расплава получаются игловидные кристаллы моноклинной формы. Моноклинная сера состоит из таких же молекул, как и ромбическая, однако в кристалле они упакованы иначе. Моноклинная сера ниже 95,6 °С превращается в ромбическую. Если расплавленную и нагретую до температуры кипения серу вылить в холодную воду, то можно получить ее пластическую форму. Она похожа на каучук и имеет темно-янтарный цвет. Она состоит из линейных молекул Sn с длиной цепочки в сотни и тысячи атомов. При комнатной температуре она довольно быстро переходит в ромбическую серу.
Сероводород – бесцветный газ с неприятным запахом, напоминающим запах тухлых яиц. Ядовит. По сравнению с водой имеет гораздо более низкую температуру плавления и кипения, что указывает на отсутствие водородных связей. Молекула сероводорода подобно молекуле воды должна иметь угловое строение с углом между связями равным 92 градуса, что, вероятно, обусловлено сильным отталкиванием неподеленных электронных пар в окружении атома серы и слабым отталкиванием между атома водорода. В 1 литре при 20 градусах и давлении 1 атм растворяется 2, 56 л сероводорода, что отвечает концентрации 0,1 моль/литр. Раствор в 0,1 моль/литр называют сероводородной кислотой. Сероводород - восстановитель, при его окислении в водных растворах чаще всего образуется свободная сера. 2H2S + O2 = 2S + 2H2O, H2S + I2 = S + 2HI, 5H2S + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5S.Взаимодействие с сильным окислителем: 4H2S + 2PbO3 = 3PbS + SO2 + 4H2O. Может быть окислен в избытке хлорной воды: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl.
Сульфиды
Средние соли сероводородной кислоты называют сульфидами. В воде хорошо растворимы сульфиды аммония, щелочных металлов и бария. Катионы большинства других металлов образуют с сульфид-ионами малорастворимые соединения. Получают сульфиды непосредственным взаимодействием серы с металлом. Или восстановлением сульфатов углем: Na2SO4 + 4C = Na2S + 4CO, также при пропускании сероводорода через водный раствор щелочи. Сульфиды марганца, железа, кобальта, никеля и некоторых других металлов с большими значениями произведений растворимости получают взаимодействием солей этих металлов с растворами сульфидов щелочных металлов или аммония.
Сульфиды – восстановители.
Растворимость сульфидов различна: одни из них (например, Na2S, K2S, CaS) растворимы в воде, другие ( FeS, ZnS и др.) - в разбавленных минеральных кислотах. Такие сульфиды, как PbS, CuS, As2S3, растворяются только в концентрированных минеральных кислотах.
10. Оксиды серы. Физические и химические свойства. Геометрическое строение молекул. Взаимодействие оксидов серы с водой. Свойства сернистой и серной кислот. Сульфиты, сульфаты
Важнейшие и наиболее устойчивые оксиды – SO2 и SO3. SO2 - бесцветный газ с резким запахом. Две двойные связи в молекуле и неподеленная электронная пара в окружении атома серы направлены к вершинам треугольника, поэтому молекула имеет угловое строение с углом между связями 119 градусов. Получение: S + O2 = SO2, 3FeS2 + 8O2 = Fe3O4 + 6SO2, 2H2S +3O2 = 2SO2 + 2H2O
Cернистый газ хорошо растворим в воде. Этот раствор называют сернистой кислотой, хотя молекулы H2SO3 в нем не обнаружены.
Средние соли сернистой кислоты – сульфиты довольно устойчивы и их можно выделить в виде кристаллов. Большинство из них, кроме солей щелочных металлов и аммония, плохо растворимы. Кислые соли – гидросульфиты в чистом виде не выделены. Сернистый газ и сульфиты – сильные восстановители, они окисляются до серной кислоты и ее солей кислородом воздуха, галогенами, пероксидом водорода и другими окислителями:
2Na2SO3 + O2 = Na2SO4, SO2 + Cl2 + H2O = H2SO4 + 2HCl, Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl, SO2 + H2O2 = H2SO4
При взаимодействии с сероводородом сернистый газ проявляет окислительные свойства: SO2 + 2H2S = 3S + 2H2O
Взаимодействие с водой: SO2 + H2O = H2SO3
Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
SO3 в газообразном состоянии состоит из молекул, имеющих форму правильного треугольника.
2SO2 (г.) + O2 (г.) = 2SO3 (г.) Процесс получения серного ангидрида проходит с катализаторами (платина или оксиды некоторых переходных металлов.
При растворении оксида серы в воде образуется серная кислота и выделяется большое количество теплоты SO3 + H2O = H2SO4. Серная кислота – тяжелая, вязкая, бесцветная маслянистая жидкость, замерзающая при температуре +10,4 градуса. Обладает высокой электропроводностью.
Растворяется в воде с большим экзотермическим эффектом в любых пропорциях.
Концентрированная кислота обладает сильными водоотнимающими свойствами. При взаимодействии с металлами проявляет свойства сильного окислителя, восстанавливаясь преимущественно до SO2. Сu + 2H2SO4 (конц.) = CuSO4 + SO2 + 2H2O, 3Zn + 4H2SO4 (конц.) = 3ZnSO4 + S + 4H2O Разбавленная кислота реагирует с активными металлами с выделением водорода Zn + H2SO4 (разб.) = ZnSO4 + H2
Серная кислота образует два типа солей – сульфаты и гидросульфаты (кислые). Сульфат-ион имеет тетраэдрическую форму.
Сульфаты - это соли серной кислоты. Большинство из них растворимы в воде. Малорастворимы сульфат кальция, стронция, серебра. Нерастворим - сульфат бария. Качественной реакцией на сульфат - ион является реакция с растворимой солью бария: K2SO4 +Ba(NO3)2 =2KNO3 + BaSO4 (осадок белого цвета) Сульфаты щелочных металлов плавятся без разложения. Сульфат железа (II) разлагается на Fe2O3 + SO2 + SO3, сульфат железа (III) на Fe2O3 и SO3. Сульфат меди на окись меди и серный ангидрид. Сульфат марганца разлагается по типу Fe (II).
Существует большое кол-во кислородсодержащих кислот серы. Существуют соединения, содержащие тиосульфат ионы – K2S2O3
Тиосерная кислота сразу же разлагается. Ее соли являются восстановителями.
16. Оксид фосфора(V). Фосфорные кислоты. Средние и кислые соли ортофос- форной кислоты. Протолитические равновесия в растворах фосфатов, гидрофосфатов и дигидрофосфатов щелочных металлов. Применение фосфатов. Гидролиз АТФ.
Оксид фосфора P4O10 представляет собой белое кристаллическое вещество. Он очень гигроскопичен. Способность оксида отнимать воду у кислот используют для получения оксидов, которые невозможно синтезировать из простых в-в. P4O10 + 4HClO4 = 2Cl2O7 + 4HPO3
При взаимодействии с водой оксид фосфора дает различные кислоты, состав которых зависит от условий протекания реакции. Простейшим представителем фосфорных кислот является ортофосфорная H3PO4. Ортофосфорная кислоты - кристаллическое вещество, хорошо растворимое в воде. В водных растворах она диссоциирует по трем ступеням.
Фосфорная кислота образует средние соли - фосфаты (K3РО4) и два типа кислых солей - гидрофосфаты (K2НРО4)и дигидрофосфаты (KН2РО4). Дигидрофосфаты хорошо растворимы в воде. Из гидрофосфатов и фосфатов растворимы только соли щелочных металлов (кроме солей лития) и аммония. Водные растворы фосфатов и гидрофосфатов вследствие гидролиза имеют щелочную среду.
Среда растворов дигидрофосфатов кислая, т.к. константа диссоциации иона Н2РО4- много больше константы его гидролиза. Фосфат ионы имеют тетраэдрическое строение. При дегидратации ортофосфорной кислоты или при добавлении к ней оксида фосфора (5) тетраэдры [PO4] соединяются своими вершинами, образуя полифосфорные кислоты линейного или циклического значения.
Фосфористая кислота:
восстановительные свойства
H3PO4 + 2H+ + 2e− = H3PO3+H2O E°= –0,28В
NO3−
+ 3H+
+ 2e−
= HNO2
+H2O
E°= 0,934В
2H3PO3 + O2 = 2H3PO4
3H3PO3 + As2O3 = 2As + 3H3PO4 Протолитические равновесия в растворах фосфатов, гидрофосфатов и дигидрофосфатов щелочных металлов.


17 . Углерод. Полиморфные модификации. Оксиды углерода: физические и химические свойства. Энергетическая диаграмма МО молекулы CO. Взаимодействие CO2 с водой. Угольная кислота и ее соли. Карбонатная и гидрокарбонатная буферные системы. «Парниковый» эффект.
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа. Кристаллы с атомной структурой (алмаз, графит и лонсдейлит), цепочечные полимеры (карбин) и молекулярные вещества (фуллерены). Стандартным состоянием элемента углерода является графит. Это наиболее распространенная и устойчивая при обычных условиях модификация. Кристаллическая структура графита состоит из слоев, образованных плоскими шестичленными углеродными циклами.
В древесном угле и саже, которые называют аморфным углеродом, крохотные кусочки графитовых слоев расположены неупорядоченно относительно друг друга. в кристалле алмаза каждый атом образует с четырьмя соседними атомами сигма связи, направленные к вершинам тетраэдра. Алмазы обладают высокой твердостью, хрупкостью и не проводят электрический ток. Не содержащие примесей алмазы бесцветные. При нагревании под атмосферным давлением алмазы превращаются в графит.
Аллотропные модификации: графит, алмаз, карбин, лонсдейлит, фуллерены, углеродные нанотрубки, графен, аморфный углерод, уголь, техуглерод, сажа.
Полиморфизм - способность твердых веществ и жидких кристаллов существовать в двух или нескольких формах с различной кристаллической структурой и свойствами при одном и том же химическом составе
Типичный пример полиморфных форм - модификации углерода (алмаз, лонсдейлит, графит, карбины и фуллерены), которые резко различаются по свойствам. Наиболее стабильной формой существования углерода является графит, однако и другие его модификации при обычных условиях могут сохраняться сколь угодно долго. При высоких температурах они переходят в графит. В случае алмаза это происходит при нагревании выше 1000 oС в отсутствие кислорода. Обратный переход осуществить гораздо труднее. Необходима не только высокая температура (1200-1600 oС), но и гигантское давление - до 100 тысяч атмосфер. Превращение графита в алмаз проходит легче в присутствии расплавленных металлов (железа, кобальта, хрома и других).
Углерод образует два устойчивых оксида - СО и СО2
Молекула CO, так же, как и изоэлектронная ей молекула азота, имеет тройную связь. Так как эти молекулы сходны по строению, то и свойства их также схожи — очень низкие температуры плавления и кипения, близкие значения стандартных энтропий и т. п.
Молекула оксида углерода (II) имеет линейное строение. Между атомами углерода и кислорода образуется тройная связь.
![]()
Две связи получены путем перекрывания неспаренных 2р-электронов углерода и кислорода, а треть – по донорно-акцепторному механизму за счет свободной атомной орбитали 2р углерода и электронной пары 2р кислорода. Молекула СО является донором электронной пары.
Оксид углерода (II) – угарный газ, газ без цвета и запаха, легче воздуха, очень мало растворим в воде (2,32 мл в 100 г воды при 20 °C), растворим в спирте и бензоле. Ткип = -192 °C; Тпл = -205 °C. Ядовит. Необратимо взаимодействует с гемоглобином крови.
В химическом отношении – инертное вещество. Относится к несолеобразующим оксидам, не реагирует с водой, однако при нагревании с расплавленными щелочами образует соли муравьиной кислоты: CO + NaOH = HCOONa,
что позволяет формально рассматривать его как ангидрид муравьиной кислоты.
Взаимодействие с кислородом
При нагревании в кислороде сгорает красивым синим пламенем:
2СО + О2 = 2СО2.
Взаимодействие с водородом
Реагирует с водородом:
СО + Н2 = С + Н2О.
Взаимодействие с другими неметаллами
При облучении и в присутствии катализатора взаимодействует с галогенами:
СО + Cl2 = COCl2 (фосген).
и серой при 350° C:
СО + S = COS (карбонилсульфид).
Восстановительные свойства
СО – энергичный восстановитель. Восстанавливает многие металлы из их оксидов:
C+2O + CuO = Сu + C+4O2.
Взаимодействие с переходными металлами
С переходными металлами образует карбонилы:
Ni + 4CO = Ni(CO)4;
Fe + 5CO = Fe(CO)5.

Молекула СО2 линейная, длина двойной связи С=О равна 0,116 нм.

В рамках теории гибридизации атомных орбиталей две σ-связи образованы sp-гибридными орбиталями атома углерода и 2р-орбиталями атома кислорода. Не участвующие в гибридизации р-орбитали углерода образуют с аналогичными орбиталями кислорода p-связи. Молекула неполярная.
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, не испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химически оксид углерода (IV) инертен.
Окислительные свойства
С сильными восстановителями при высоких температурах проявляет окислительные свойства. Углем восстанавливается до угарного газа:
С + СО2 = 2СО.
Магний, зажженный на воздухе, продолжает гореть и в атмосфере углекислого газа:
2Mg + CO2 = 2MgO + C.
Свойства кислотного оксида
Типичный кислотный оксид. Реагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O + CO2 = Na2CO3,
2NaOH + CO2 = Na2CO3 + H2O,
NaOH + CO2 = NaHCO3.
Качественная реакция
Качественной реакцией для обнаружения углекислого газа является помутнение известковой воды:
Ca(OH)2 + CO2 = CaCO3↓ + H2O.
В начале реакции образуется белый осадок, который исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 = Сa(HCO3)2.
17. Углерод. Полиморфные модификации. Оксиды углерода: физические и химические свойства. Энергетическая диаграмма МО молекулы CO. Взаи- модействие CO2 с водой. Угольная кислота и ее соли. Карбонатная и гид- рокарбонатная буферные системы. «Парниковый» эффект.
Углерод образует несколько аллотропных модификаций: атомная структура ( алмаз, алмаз, лонсдейлит) цепочечные полимеры (карбин) молекулярные вещества (фуллерены)
Стандартное состояние – графит. Кристаллическая структура состоит из слоев, образованными шестичленными углеродными циклами, соединенными ковалентными связями (в одной плоскости и в форме куба) . Между слоями действуют силы Ван-дер-Ваальса. Важнейшим свойством является большая удельная поверхность, которая после специальной обработки еще и увеличивается, образуется активированный уголь, способный поглощать молекулы примесей. *При атмосферном давлении не плавится, а возгорает.
Алмаз. Атомы образуют форму тетраэдера. Высокая твердость и хрупкость, не проводят электрический ток. При нагревании под атмосферным давлении алмазы превращаются в графит.
Лонсдейлит. Форма тетраэдера, но они соеденены между другими тетраэдерами. Найдены в метеоритах.
Карбин состоит из очень длинных прямолинейных цепочек (-СΞС-)
Фуллерен. Молекулы напоминают по форме футбольные мячи, образованные 5 и 6- угольниками.
*При взаимодействии всех форм углерода с избытком кислорода образуется СО2 при недостатке кислорода СО. Алмаз более инертен и требует большей температуры.
**Все простые вещества взаимодействуют с галогенами:
Э + 2Г2 = ЭГ4
При нагревании углерода с серой образуется дисульфид
C + 2S = CS2
При высокой температуре реагирует с металлами и неметаллами (~1200 Co), образуя карбиды:
2С + Са = СаС2
3С+ 4Al = Al4C3
C + Si = SiC
*По типу химической связи Карбиды подобно гидридам и оксидам подразделяются на ионные (солеообразные) – металлы 1, 2 и 13 групп (наименее электроотрицательные), металлоподобные – переходные группы (можно подметить чугун с Fe3C(к), и ковалентные – SiC (карбунд).
Углерод вытесняет из перегретого водяного пара (500-800Со) водород и превращается в оксид:
С + НОН = СО + Н2
С разбавленной серной и соляной кислотами, щелочами не взаимодействует. Однако реагирует с сильными окислителями:
С + 2Н2SO4 (конц.) =(t) CO2 + SO2 + 2НОН
С + 4НNO3 (конц.) =(t) CO2 +4 NO2 + 2НОН
Энергетическая диаграмма:

Оксиды:
В организме человека СО легко связывается с Fe2+, в результате чего гемоглобин утрачивает способность к переносу кислорода
Сгорание угля при недостатке кислорода
*СО2 + С = 2СО
Взаимодействие с водой:
СО2 + НОН H2CO3 *диссоциирует по двум ступеням
Угольная кислота и ее соли:
СаСО3 = СО2 + НОН *получение СО2 в промышленности
СаСО3 +2HCl = CaCl2 + CO2 + HOH *лабораторный способ
Mg + СО2 = 2MgO + CO *взаимодействие с активными металлами
Карбонатная и гид- рокарбонатная буферные системы:

![]()

Парниковый эффект:
Атмосфера, содержащая многоатомные газы (двухатомные газы диатермичны — прозрачны для теплового излучения), поглощающие в этой области спектра (т. н. парниковые газы — H2O, CO2, CH4…), существенно непрозрачна для излучения, направленного от её поверхности в космическое пространство, то есть имеет в ИК-диапазоне большую оптическую толщину. Вследствие такой непрозрачности атмосфера становится хорошим теплоизолятором, что, в свою очередь, приводит к тому, что переизлучение поглощённой солнечной энергии в космическое пространство происходит в верхних холодных слоях атмосферы. В результате эффективная температура Земли как излучателя оказывается более низкой, чем температура её поверхности.
