
Кислородная деполяризация
Процессы коррозии с кислородной деполяризацией могут протекать в том случае, если при данных условиях обратимый потенциал металла отрицательнее обратимого потенциала кислородного электрода
(ЕMe)обр < (ЕO2)обр. (35)
Обратимый потенциал кислородного электрода может быть вычислен по уравнению Нернста:
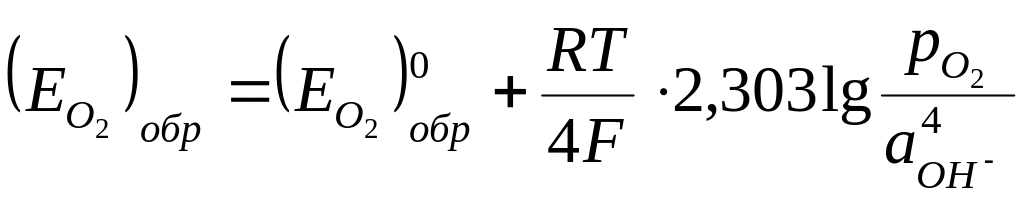 (36)
(36)
где ![]() – стандартный потенциал кислородного
электрода (обратимый потенциал
кислородного электрода при аOH–
= 1 и рО2 = 1 ат);
– стандартный потенциал кислородного
электрода (обратимый потенциал
кислородного электрода при аOH–
= 1 и рО2 = 1 ат);
рО2 – парциальное давление кислорода;
аон– – активность гидроксильных ионов;
Величина обратимого потенциала кислородного электрода при 25oC для различных значений рН и рО2, приведены в табл.6
Таблица 6
ро2 , ат |
рН среды |
||
0 |
7 |
14 |
|
0,21 1 |
+1,218 +1,229 |
+0,805 +0,815 |
+0,391 +0,400 |
Коррозия с кислородной деполяризацией является термодинамически более возможным процессом, чем коррозия с водородной деполяризацией, так как равновесный потенциал восстановления кислорода более положителен, чем равновесный потенциал выделения водорода.
Коррозия металлов с кислородной деполяризацией является самым распространенным коррозионным процессом.
Коррозии с кислородной деполяризацией подвергается металлическая обшивка нефтезаводской аппаратуры и оборудования, детали аппаратов, соприкасающиеся с водой и нейтральными водными растворами солей (например, трубы конденсационно-холодильного оборудования), подземные трубопроводы, днища резервуаров и др.
При коррозии металлов с кислородной деполяризацией катодный процесс определяется перенапряжением катодной реакции и скоростью подвода кислорода к электроду. Замедленность катодной реакции по схеме:
О2 + 2Н2О + 4е 4ОН– (в щелочных или нейтральных растворах),
или по схеме :
О2 + 4Н+ + 4е 2Н2О (в слабо кислых растворах)
называется перенапряжением ионизации кислорода.
При больших плотностях тока (при iк > 10–2 А/м2) и значительной скорости подвода кислорода к катоду перенапряжение ионизации кислорода имеет логарифмическую зависимость от плотности тока
δ1 = а/ + b/ lg i, (37)
где δ1 - перенапряжение ионизации кислорода;
a/ - константа, зависящая от материала катода и состояния его поверхности, температуры и других факторов. Она численно определяется как величина перенапряжения при i = 1;
b/ - константа, не зависящая от материала катода; она определяется из равенства b/ = 2RT/nF ∙ 2,3; при температуре 20о и n = 1 b/ = 0,117.
Механизм катодного восстановления кислорода довольно сложен и протекает в несколько стадий: растворение кислорода в электролите, перенос растворенного кислорода к катодным участкам металла, ионизация кислорода.
В отличие от водородной деполяризации, для которой концентрационная поляризация практически несущественна, при коррозии металлов с кислородной деполяризацией она играет очень большую роль вследствие ограниченности скорости подвода кислорода к катоду. Это объясняется небольшой растворимостью кислорода в растворе электролита и, следовательно, его малой концентрацией, затруднительностью диффузии кислорода через неподвижный слой жидкости, прилегающей к катоду.
При сильном перемешивании раствора, интенсивной циркуляции или в условиях, обеспечивающих значительную аэрацию электролита, коррозионный процесс тормозится перенапряжением ионизации кислорода. Диффузионные процессы сказываются на скорости коррозии при погружении металла в спокойный или в слегка перемешиваемый раствор. Общая кривая катодной поляризации имеет сложный вид (рис. 23) и является суммарной из трех кривых, характеризующих поляризацию при ионизации кислорода (AB), концентрационную поляризацию (DE) и разряд ионов водорода (GFH).

Рис. 23 Катодная
поляризационная кривая для процесса
кислородной деполяризации.
На первом участке скорость катодного процесса, т.е. количество восстанавливаемого кислорода в единицу времени, меньше максимально возможной скорости доставки кислорода к поверхности путем диффузии. В связи с этим, на этом участке скорость процесса ограничивается в основном замедленностью самого процесса восстановления кислорода.
При дальнейшем повышении плотности тока потенциал смещается в отрицательном направлении сначала постепенно, а затем скачкообразно (участок CDE). Резкое смещение потенциала в отрицательном направлении связано с концентрационной поляризацией вследствие уменьшения концентрации кислорода.
При некотором значении потенциала становится возможным новый катодный процесс, обычно связанный с водородной деполяризацией (участок EK).
