
- •1 Сурет – Қаныққан бу қысымының температураға тәуелділігі диаграммасы.
- •2 Сурет – Идеал сұйық үшін «Құрам – ерітінді буының қысымы» диаграммасы.
- •3 Сурет – Нақты сұйық үшін «Құрам – ерітінді буының қысымы» диаграммасы.
- •2.1 Сублимация және дистилляция процестерінің негізгі заңдылықтары
- •4 Сурет – Қорғасынды мырыштан вакуумды тазартуға арналған аппарат сұлбасы.
- •Вакуум сорғыға Al
- •7 Сурет – Алюминий қорытпаларынан магнийді айдауға арналған электропешінің сұлбасы.
- •8 Сурет – Ректификациялық қондырғы.
- •9 Сурет – Титан – кремний тетрахлориді жүйесі үшін бу құрамының ерітінді құрамына тәуелділігінің диаграммасы.
- •10 Сурет – Азеотроптық (а) және
- •11 Сурет Қайтымды эндотермиялық реакция көмегімен металды (Ме1) айдау сұлбасы.
- •12 Сурет – Металдарды иодидті тазартуға арналған реакциялық ыдыс.
- •13 Сурет – металл иодидінің синтезі мен термиялық ыдырауы жолымен айдау сұлбасы.
- •15 Сурет – Қалыпты (а) және бағытты кристалданудың (б) сұлбалық кескіні.
- •16 Сурет – Балқымадан тарту (а), бағытты кристалдану (б) және аймақтық балқу (в) әдістерінің сұлбалары.
- •17 Сурет – Жүйелердің күй диаграммасының бөлігі: тазартылатын зат а – қоспа в.
- •18 Сурет – Қоспа концентрациясының кристалдануға әсері.
- •19 Сурет – Аймақтық балқыту процесінің сұлбасы.
- •20 Сурет – Таралу коэффициентінің шамасына тәуелді аймақтық балқыту кезінде құймакесек ұзындығы бойынша қоспалардың таралуы.
- •21 Сурет – Қоспалардың таралуының аймақтық теңестірілуі.
- •22 Сурет – Таралудың тиімді коэффициентінің шамасын графикалық әдіспен анықтау.
- •23 Сурет – Аймақтық балқытуды жүзеге асыру сұлбасы.
- •7.2 Кристалданудың кейбір заңдалықтары.
- •24 Сурет – Туындының пайда болуы еркін энергиясының оның мөлшеріне тәуелділігі.
- •7.3 Кристалдану әдісімен тұздарды бөлу.
- •25 Сурет – Белгілі температурадағы екі тұздың ерігіштік диаграммасы.
- •26 Сурет – а тұзының ерітіндінің қайтарылуымен қоспалардан тазартылу сұлбасы.
- •Оксидтер қоспасы
- •30 Сурет – k2ZrF6. Бөлшекті кристалдау әдісімен гафнийді цирконийден бөлудің принципиалдық сұлбасы.
- •32 Сурет – Цементация процесінің сұлбасы.
- •33 Сурет – Балқыған тұздарда сұйық анодпен және катодпен металдарды электролиттік тазартуға арналған электролизер сұлбасы.
- •11.3 Ионалмастырушы процестердің негіздері
- •35 Сурет – Иондық алмасудың изотермасы.
- •36 Сурет – Колоннадағы ион алмасу сұлбасы.
- •38 Сурет – Сорбциялық аппарат квс сұлбасы.
- •40 Сурет – Аммоний парамолибдаты өндірісінің ерітінділерінен молибденді
- •42 Сурет – Экстракциялық колонналар сұлбасы.
- •Жеңіл фаза Жеңіл фаза Ауыр фаза Ауыр фаза
- •43 Сурет – Араластырғыш-тұндырғыш типті экстрактор сатысының сұлбасы.
- •44 Сурет – Мысты экстракциялық бөліп алу сұлбасы меди.
- •1 2 3 Снnо3, моль/дм3
- •45 Сурет – Цирконийдің (1), гафнийдің (2) таралу және олардың бөліну
- •46 Сурет – Құрамы бойынша күрделі ерітіндіден индийді экстракциялық бөліп алудың сұлбасы.
30 Сурет – k2ZrF6. Бөлшекті кристалдау әдісімен гафнийді цирконийден бөлудің принципиалдық сұлбасы.
Бұл сұлба бойынша жұмыс істеу кезінде таза кристалдардың K2ZrF6 шығымы, ондағы Hf мөлшері 0,01 % кем болмаған кезде, 80 % құрайды.
Бөлшекті кристалдану әдісінің артықшылығы оның қарапайымдылығында, реагентке шығын шығарудың қажетсіздігінде (процесс үшін тек қана су қажет). Әдістің кемшілігі – операцияны жүргізудің кезеңдігі.
Әдебиет: 2 нег. [27-36], 5 нег. [196-199, 381-387].
Бақылау сұрақтары:
1. Бөлшекті кристалдау әдісінің мәні.
2. Бөлшекті кристалдау әдісінің артықшылықтары мен кемшіліктері.
3. Неліктен бөлшекті кристалдау әдісі цирконий мен гафнийді ажырату үшін ұсынылады?
4. Бөлшекті кристалдану әдісімен тантал мен ниобийдің кешенді фторидтерінің бөліну шарттарын таңдауды негіздеңіз.
5. Тантал тұзын тазарту қандай қоспалардан жүргізіледі?
6. Бөлшекті кристалдану әдісімен гафнийді цирконийден бөлудің сұлбасын келтіріңіз .
№ 9 дәріс: Қиын еритін қосылыстардың бөлінуі
Гидрометаллургияда қиын еритін қосылыстардың әртүрлі сыныптарының бөлінуін қолданады:
1) гидроксидтердің (мысалы, Al(OH)3, Fe(OH)3, Co(OH)3, Be(OH)2 және т.б.) немесе негізгі тұздардың (xMeSO4 · yMe(OH)2 және басқ.);
2) сульфидтердің (CuS, CoS, In2S3, MoS3 және басқ.);
3) органикалық емес тұздардың (AgCl, TlCl, CaWO4, CaMoO4, фторидтердің СЖЭ (РЗЭ), Th және U, фосфаттардың, арсенаттардың, бірқатар металдардың карбонаттарының);
4) органикалық қышқыл тұздарының (оксалаттардың, ксантогенаттардың, купферонаттардың және басқ.).
9.1 Ерігіштік туындысы. Ерігіштік туындысы L – аз еритін қосылыстар мен ерітінділер арасындағы тепе-теңдіктің негізгі сандық термодинамикалық сипаттамасы.
Қиын еритін қосылыстардың пайда болу реакциясын жазайық
m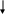 Me
+ nA
= MemAn.
(54)
Me
+ nA
= MemAn.
(54)
Тепе-теңдік жағдайларында қатты тұздың химиялық потенциалы ерітіндідегі иондардың химиялық потенциалдарының қосындысына тең:
![]() ,
(55)
,
(55)
мұндағы
![]() ,
,
![]() және
және
![]() –
қатты тұз MemAn
және ерітіндідегі иондардың стандартты
химиялық потенциалдары;
–
қатты тұз MemAn
және ерітіндідегі иондардың стандартты
химиялық потенциалдары;
![]() – иондар активтілігі (жеңілдету үшін
иондар заряды жіберілген);
R
– газ тұрақтысы;
Т
– абсолюттік температура.
– иондар активтілігі (жеңілдету үшін
иондар заряды жіберілген);
R
– газ тұрақтысы;
Т
– абсолюттік температура.
Теңдеудің
сол бөлігінде (55) логарифмдік мүше жоқ,
өйткені қатты фазаның активтілігі бірге
тең қабылданады. Бұл кезде, сірә
=
∆![]() .
.
Теңдеуден (55) шығады:
![]() .
(56)
.
(56)
Берілген температурада теңдеудің оң бөлігі – тұрақты шама, осыдан
![]() (57)
(57)
немесе
![]() ,
(58)
,
(58)
мұндағы
![]() және
және
![]() – иондардың тепе-теңдік концентрациялары;
– иондардың тепе-теңдік концентрациялары;
![]() – активтілік коэффициенттері.
– активтілік коэффициенттері.
Сұйытылған ерітінділерде (тұз аз ерігіш) активтілік коэффициенті бірге жуықтайды, онда
![]() .
(59)
.
(59)
Егер
ерітіндідегі иондар концентрациясы
СМе
және СА,
онда
![]() < L кезінде қатты тұздың еру өтеді, ал
> L кезінде – оның тепе-теңдік орнағанға
дейінгі шөгуі.
< L кезінде қатты тұздың еру өтеді, ал
> L кезінде – оның тепе-теңдік орнағанға
дейінгі шөгуі.
Ерітінді туындысының шамасы қаншалықты аз болса, түзілетін қосылыстың ерігіштігі соншалықты төмен болады.
Егер
тұздың MemAn
ерігіштігін S
белгілесек,
онда иондардың
![]() және
және
![]() тепе-теңдікті концентрациясы mS
және nS
тең.
Осыдын
тепе-теңдікті концентрациясы mS
және nS
тең.
Осыдын
![]() ;
;
![]() немесе
немесе
![]() .
(60)
.
(60)
Иондардың бірінің артықшылығының тұздың ерігіштігіне әсері ерігіштік туындысының теңдеуінен шығады. Егер ионның артықша концентрациясы оның тұз ерігіштігімен шартталған концентрациясынан біршама басым болса, онда соңғысын ескермеуге болады. Мысалы, мейлі ионның артықша концентрациясы тең СМе, жәнеде СМе >>mS. Онда
![]() және
және
![]() .
(61)
.
(61)
9.2 Қиын еритін қосылыстардың шөгу шарттары. Гидроксидтер мен негізгі тұздардың шөгу жағдайлары. Металдар гидроксидтерінің, мәні металл ионының активтілігі мен заряды L функциясы болып табылатын, белгілі бір рН-та бөлінетінін жеңіл көрсетуге болады:
Ме(ОН)n(ќат) ↔ Меn+ + nОН-, (62)
L
=
![]() ,
(63)
,
(63)
мұндағы КW – судың иондық көбейтіндісі, 10-14тең.
Осыдан
![]() ,
(64)
,
(64)
рН
=
![]() .
(65)
.
(65)
Теңдеуден (65) бойынша тұжырымдасақ: ерітіндідегі металл активтілігінің жоғарылауымен рН гироксидтің бөлінуінің басында төменірек мәндер аймағына ығысады. Берілген металл үшін оның тотығу дәрежесінің жоғарылауымен (катион заряды) гидроксидтің бөліну рН тура солай төменгі мәєндер жағына ығысады.
Мысалы, Со (III) үшін гидроксидтің бліну рН I тең, осы уақыттақы Со (II) үшін гидроксидтің бөліну рН шамасы 6,4 тең болады; Fe (III) үшін гидроксидтің бөліну рН 1,6; Fe (II) – 6,7 және т.б. (7 кесте).
7 кесте – аМе = 1 кезінде металдар гидроксидтерінің бөліну рН
Металл |
L |
Бµліну рН |
Металл |
L |
Бµліну рН |
Ti (IV) |
– |
0,5 |
Cu (II) |
5,6 · 10-20 |
4,5 |
Ti (III) |
1,5 · 10-44 |
– 0,5 |
Zn (II) |
4,5 · 10-17 |
5,9 |
Sn (IV) |
1,0 · 10-56 |
0,1 |
Co (II) |
2,0 · 10-16 |
6,4 |
Co (III) |
3,0 · 10-41 |
1,0 |
Fe (II) |
1,6 · 10-15 |
6,7 |
Sn (II) |
5,0 · 10-25 |
1,4 |
Cd (II) |
1,2 · 10-14 |
7,0 |
Fe (III) |
4,0 · 10-38 |
1,6 |
РЗЭ (III) |
– |
6,8-8,5 |
Ce (IV) |
10-54 |
0,8 |
Ni (II) |
1,0 · 10-15 |
7,1 |
Zn (IV) |
– |
2,3 |
Mg (II) |
5,5 · 10-12 |
8,4 |
Al (III) |
1,9 · 10-33 |
3,1 |
Ti (I) |
7,2 · 10-1 |
13,8 |
Bi (III) |
4,3 · 10-33 |
3,9 |
|
|
|
Металдар гидроксидтерін ерітінділерден шөгілдіру кезінде ең алдымен, гидратының түзілу рН төмен металдың гироксиді шөге бастайды, демек, оның ерігіштігіде төмен.
Теңдеуді қолданып (65), орта рН әртүрлі мәндеріндегі ерітіндідегі Ме қалдықты концентрациясын есептеуге, сонымен қатар металл активтілігінің бастапқы белгілі және аяққы берілген мәндеріндегі, гидроксидтің шөгуінің басталу және аяқталу рН шамасын есептеугеде болады.
Көбінесе, бөліну жағдайларындағы айырманы арттыру үшін металл ионын тотығудың жоғары дәрежесіне дейін тотықтырады. Мысал ретінде өнеркәсіптік тәжірибеде қолданылатын кобальтты никельден бөлу әдісін қарастырайық, бұл Со2+ -ден Со3+ дейін хлормен тотығуына негізделген, Со(ОН)3 гироксиді шөгеді. Процесс әлсіз қышқылды ортада жүргізіледі, түзілетін қышқылды бейтараптандыру үшін сода қосылады:
2CoSO4 + 3Na2CO3 + 3H2O + Cl2 = 2Со(ОН)3 + 2NaCl + 2Na2SO4 + 3CO2. (66)
Қышқылды ортада Со2+/Со3+ жұбының потенциалы +1,84 В, ал Ni2+/Ni3+ жұбының потенциалы + 1,77 В тең болғандықтан, бірінші кезекте Со2+ тотығады. Гидроксид Со(ОН)3 рН 1–2 кезінде шөгеді, ал никель гидроксиді (+2) бұл жағдайларда шөкпейді (Ni(ОН)2 шөгу рН ~ 7). Никель, оның Ni+3 дейін кейбір тотығуларына байланысты, кобальтпен бірге аздап шөгеді.
Гидроксидтердің бөлшекті шөгуімен қасиеттері бойынша өте жақын элементтерді бөлуге болады, мысалы лантанидтер сияқты, өйткені олардың гидроксидтерінің шөгу рН мәндері айырмашылықты болады: гидроксидтердің шөгу рН Lа-дан Lu-геиондар радиустарына симбатты төмендейді. Металл концентрациясының жоғарылауымен гидроксидтердің бөліну рН РЗЭ қышқыл ортаға ығысады. РЗЭ фракцияларға бөлу кезіндегі рН жұқалап реттелуі ерітінді арқылы ауа мен аммиактың қоспасын өткізу арқылы жүргізіледі. рН баяу өзгерісіне азотқышқылды аммонийдің қатысуы әсер етеді, бұл буферлік қоспаның (NH4NO3+NH4OH) түзілуіне әкеледі.
Кейбір металдардың гидролиттік бөлінуі кезінде негізгі тұздардың тұнбалары түзіледі. Алдағы жағдайларға ұқсас, рН үшін жалпы құрамдағы негізгі тұзды тұндыру тәуелділігін хМеА2/n · уМе(ОН)2 (мұндағы Ме – екізарядты катион, А– n зарядты анион), ерітіндідегі иондар концентрациясынан және ерігіштік туындысынан Lнег.тұз шығаруға болады.
Тұнбаның ерітіндімен тепе-теңдігі кезінде:
хМеА2/n · уМе(ОН)2 = (x+y) Ме2+ + (2x/n)An- + 2yOH-, (67)
Lнег.т±з
=
![]() ,
,
![]() ,
,
![]() .
(68)
.
(68)
Теңдеуден (68) рНнег.тұз тек катионның ғана концентрациясына тәуелді емес, анионныңда концентрациясына тәуелді екенін көреміз. Ережеге сай, Негізгі тұздардың бөліну басындағы рН, сәйкес гидроксидтерге қарағанда төмен. Гидроксидтер мен негізгі тұздардың бөліну рН айырмасы металдарды бөлуді жүргізуге мүмкіндік береді.
Металдар сульфидтерінің шөгуі. Металдар сульфидтерінің арасында тек сілтілі металдар сульфидтері ғана суда жақсы ериді, жәнеде олар суда гидролизделеді. Сілтілі жер металдарының сульфидтері аз ерігішті, дегенмен гидролизді ыдырайды. Алюминий мен хром сульфидтеріне қатыстыда осылай айтуға болады (Al2S3 және Cr2S3). Ауыр металдар сульфидтерінің: Cu, Co, Ni, Fe, Sn, Mo, As, Sb, Hg, Ag, Zn, Cd ерігіштігі төмен, дегенмен олардың ерігіштігін бағалау кезінде сульфидтің гидролизінің мүмкіндігін ескеру қажет.
Металдардың қиын еритін сульфидтері, гидроксидтерге ұқсас, ерітіндінің белгілі бір рН бөлінеді, бұл талғамалы шөктіруді жүзеге асыруға мүмкіндік береді. Еківалентті металл сульфидінің мысалында, сульфидтің бөліну рН ерітіндідегі металл концентрациясына және өтетін реакцияның тепе-теңдігін сипаттаушы константалар шамасына тәуелділігін қарастырайық (теңдеуді шығару тәртібі алдыңғыға, металдар гидроксиді мен негізгі тұздардың шөгуі жағдайына ұқсас. 2 нег. нұсқ.қар.).
рН = 1/2(lgL – lgKH2S – lgCMe – lgCS, (69)
мұндағы L – металл сульфидінің ерігіштік туындысы;
KH2S = К1·К2= 10-20; К1 және К2 күкіртсутектің ыдырау реакциясының тепе-теңдік константалары:
Н2S ↔ Н+ + НS-, К1 = [Н+][НS-]/[Н2S] = 10-7,
НS- ↔ Н+ + S2-, К2 = [Н+][S2-]/[НS-] = 10-13.
CS – күкірттің ерітіндідегі жалпы концентрациясы
CS = [S2-] + [НS-] + [Н2S]. (70)
рН
5-тен
кем кезінде ерітіндіде
Н2S
молекулалары
басым қатысады.
Сондықтан
қышқыл ерітінділерде CS
![]() [Н2S]
қабылдауға болады.
[Н2S]
қабылдауға болады.
Теңдеу бойынша (69) ерітіндідегі металл иондарының әртүрлі концентрацияларында және күкіртсутек CS концентрациясы кезінде сульфидтің бөліну рН бағдалы есептеуге болады.
Ерітіндінің рН және қосылатын шөктіргіштердің (Na2S, (NH4)2S немесе H2S) мөлшерін реттей отырып, сульфидтерді селективті бөлуге болады.
Сульфидтерді бөлуді бірқатар технологиялық өндірістерде қолданады. Мысалы, құрамында кобальт және темірдің үлкен мөлшері болатын ерітінділерден, рН 2–3 кезінде сульфидті кобальт концентратын бөледі. рН 3 кезінде Со ерігіштігі (10-2,4 моль/дм3), Fe ерігіштігінен жуық шамамен 25 ретке төмен (10-1 моль/дм3). Бұл кобальтпен байытылған сульфидті тұнбаларды алуға мүмкіндік береді.
Темір кендерінен никель мен кобальтты бөліп алудың өндірістік тәжірибесінде ерітінділерден никель-кобальтты сульфидті концентратты шөктіреді. Шөгуді температура 120–130 оС және күкіртсутек қысымы I мПа кезінде әлсіз қышқыл ерітінділерде жүргізеді. Шөгіндіге 90 % Ni және 98 % Co бөліп алады. Молибден өндірісінде аммоний молибдаты ерітіндісін мыс пен темір қоспаларынан тазарту үшін олардың сульфидтерін шөгілдіреді.
9.3 Қиын еритін қосылыстарды шөктірумен металдарды бөлу. Қоспалардың қоса шөгу заңдалықтары. Металдар қосылыстарындағы ерігіштіктің айырмашылығы, жәнеде ерігіштіктің рН пен ерітіндінің тұзды құрамына тәуелділігі бірқатар жағдайларда серіктес металдарды ерітіндіде қалдырумен негізгі металдың талғамалы шөгуіне немесе элемент-қоспалардың аз еритін қосылыстарын шөктіре отырып ерітіндіні тазартуға мүмкіндік береді. Бұл кезде, барлық уақытта қоспалардың негізгі металмен немесе негізгі металдың қоспалармен қандайда бір дәрежеде шөгуі немесе қоса шөгуі байқалады.
Қоса шөгу терминін қоспалармен қанықпаған ерітіндіден шөгіндінің қоспаларды қамтуы деп түсіндіруге болады. Қоспамен аса қаныққан ерітінділерден қоспаның шөгуі жағдайларында қосылыстардың біріккен шөгуі туралы айтылады.
Қоспалардың шөгіндіге өтуінің келесі жағдайларын бөліп көрсетуге болады: 1) қатты ерітінділердің түзілуінсіз біріктіре шөгіндіге түсіру (изоморфты емес біріккен шөгу); 2) қатты ерітінділердің түзілуі нәтижесіндегі бірге шөгу (изоморфты бірге шөгуі); 3) қоспалардың адсорбциялық бірге шөгуі; 4) ерітіндінің инклюзиясы (кристалдар ішіндегі бос жерді толтыратын ерітіндімен қоспалардың тартылып әкетуі). Бұл жағдай тұздардың кристалдануы кезінде басым байқалады.
Біріккен изоморфтық емес шөгу кезінде қоспа жеке қатты фаза түрінде аса қаныққан ерітіндіден шөгеді. Шөгіндіде, бұл кезде екі қосылыстың механикалық қоспасы болады.
Изоморфтық бірге шөгу. Ме1А және Ме2А арасында қатты ерітінді түзелген жағдайда қатты фазадағы біріге шөккен қоспаның бөлінуінің екі типі мүмкіндікті: гомогенді таралу және гетерогенді (тепе-тең емес) таралу.
Гомогенді таралу. Таралудың бұл типі өте аса қаныққан ерітіндіден майда кристалды шөгіндінің жылдам кристалдануы немесе аз еритін тұнбасының жылдам шөгуінің ары қарай араластыру кезінде ерітінді қабатының астында ұсталуы кезінде байқалады. Бұл жағдайда гомогендіқ ерітінді, және ерітінді болатын, қатты фазаның бүкіл массасы арасында қоспаның нағыз тепе-теңдікті таралуы орынықтырылады. Кристалдану барысында В.Г. Хлопиннің таралу заңы байқалады, оның тұжырымы «қатты ерітіндідгі екі изоморфты шөгетін қосылыстардың активтіліктерінің қатынасы осы заттардың сулы ерітіндідегі активтіліктерінің қатынасына пропорционал»:
 ,
(71)
,
(71)
мұнда дөңгелек жақшамен еріген зат, ал квадрат жақшамен қатты фазаны түзуші зат белгіленген;
а – активтілік;
L1 , L2 – Ме1А және Ме2А тұздарының ерігіштік туындысы;
А– жалпы анион.
Пропорционалдық
коэффициентін
– L1/L2
=
![]() бөліну
коэффициенті
немесе
кристалдану
коэффициенті
деп атайды.
бөліну
коэффициенті
немесе
кристалдану
коэффициенті
деп атайды.
Қаншалықты бірден көп ерекшелінсе, соншалықты изоморфты шөгу кезінде екі тұздың бөлінуі үшін ыңғайлы жағдай туады. Егер, мысалы, = 10, онда бұл жағдайда шөгіндідегі Ме1 мөлшері ерітіндідегіге қарағанда 10 ретке жоғары болады, ал = 0,5 кезінде шөгіндідегі Ме1 мөлшері ерітіндідегіге қарағанда 2 ретке төмен болады. = 1 кезінде Ме1 мен Ме2 арасындағы қатынастар ерітіндідеде, шөгіндідеде бірдей болады, яғни бөліну байқалмайды. Жеке фазалар түрінде шөгу үшін Хлопин заңының тұжырымы теңдеуге айналады:
 ,
(72)
,
(72)
осыған сәйкес ерітіндідегі екі заттың катиондарының активтіліктерінің қатынасы олардың ерігіштігіштіктерінің туындыларының қатынасына пропорционал. Екі теңдеуден шығатыны: кәдімгі тұз немесе гидраттар түріндегі екі металдың бірге шөгуі анионның активтілігіне тәуелді емес. Біртипті негізгі (немесе қосарлы) тұздардың түзілуі кезінде тәуелділік осылай қалады, ал әртипті негізгі (қосарлы) тұздарда изоморфты біріге кристалдану мүмкіндіксіз болады және әртүрлі фазалар түрінде бірге шөгудің заңдалығы күрделенеді.
Ерітіндіден бөлек фазалар түрінде шөгу әдісі бойынша екі металды бөлу кезінде екі принципиалды айырмашылықты жағдайлар мүмкіндікті.
1. Ерітіндіні одан тазарту мақсатында, металдардың бірін шөгіндіге түсіру есебі. Егер біз металл Ме2 ерітіндісін металл қоспасынан Ме1тазартатын болсақ, онда тазартылған ерітіндідегі Ме1 минимал концентрациясы мына теңдікпен анықталады:
![]() .
(73)
.
(73)
Егерде ерітіндіні металл Ме1 активтілігінің (аМе1) қарағанда төмен болуына дейін тазартуға ұмтылсақ, теңдікті (73) сақтау шартынан шыға отырып, тазартылған металда бірге шөге бастайды.
2. Металдардың бірін (Ме2) таза шөгіндіге бөліп, екіншісін (Ме1) ерітіндіде қалдыру есебі. Металдың қоспалардан максимал ажырауы алдыңғы теңдеумен анықталады. Ерітіндідегі шөгуге түсетін металдың концентрациясы аМе2 сәйкес келгенге дейін, қоспалар шөгіндіге түспейді; ерітіндідегі аМе2 тең активтілікке жеткеннен соң қоспалардың бірге шөгуі басталады.
Яғни, L1/L2 қатынасының бірден үлкен немесе кіші болуына тәуелді, бөлудің бірінші немесе екінші жағдайын қолдану мүмкіндікті.
Гетерогендік таралу. Бұл жағдайда қатты фазада бірге шөгетін қоспалардың таралуы біртекті емес; әрбір берілген кезеңде беттік қабаттар ерітіндімен тепе-теңдікте болады, оның құрамы уақыт бойында өзгереді.
Гетерогендік таралу қатты фазадағы диффузияның баяулығымен түсіндіріледі, соның нәтижесінде шөккен кристалдар соңғы ерітіндіге қатынасы бойынша тепе-тең болмайды.
Қоспалардың адсорбциялық бірге шөгуі. Адсорбциялық бірге шөгу адсорбцияның белгілі зањдылықтарына бағынады: адсорбция жағдайында бірге шөгу дәрежесі шөгіндінің меншікті беттігіне тәуелді және тозу мен шөгіндінің қайта кристалдану шамасы бойынша уақыт бойында өзгереді; адсорбция қоспалардың жоқтың қасы қатысуының өзіне өте тәуелді болады, әсіресе беттегі потенциалдың секірмелерін тудыратын көпвалентті иондарға; одан өзге, адсорбция шөгу жағдайларының аздап өзгеруіне сезімтал (араласатын ерітінділер концентрациясына, араластыру тәртібіне, жергілікті қанығудың болуына және басқ.). Мұндай өзгерістерге изоморфты бірге шөгу аз сезімталды.
Шөгінділердің ескіруі (тозуы). Аз еритін қосылыстардың шөгіндісі, әншейінде, құрылымдарының жетілмеуі, оларда ақаулардың болуы салдарынан тұрақсыз болады. Кейде шөніділер рентгеноаморфты. Шөгу жағдайларында алдымен аз еритін қосылыстардың метатұрақты нысанының бөлінуі жағдайлары белгілі. Келтірілген факторлар, құрылымның, ал кейде шөгінді құрамының өзгеруіне келтіретін, шөгінді – ерітінді жүйесінде тозудың қайтымсыз процестерінің өтуін тудырады. Шөгінділердің тозуын физикалық және химиялық деп бөледі.
Физикалық тозудың негізгі процестеріне жататында: 1) шөгіндінің бастапқы бөлшектерінің қайта кристалдануы, нәтижесінде құрылымның ақаулығы төмендейді, ал аморфты шөгінді жағдайында – олардың кристалдыққа түрленуі; 2) майда бөлшектерді еруі есебінен бөлшектерді ірілендіру – «оствальдтық жетілу» (бөлшектер мөлшерлеріне ерігіштіктің тәуелділігі туралы). Одан өзге, физикалық тозу процесінде шөгінді бөлшектерінің агломераттарының пайда болуы байқалады (агрегирлену).
Химиялық тозуға метатұрақты нысандардың тұрақтыларға түрленуі процесін жатқызуға болады. Көбінесе бұл – шөгінділердің дегидратация немесе гидратациялық процестері немесе ерітіндінің шөгіндімен тұрақты қосылыстарды түзей отырып өзара әрекеттесуінің нәтижесінде шөгінді құрамының өзгеруі.
Химиялық
тозу мысалы ретінде алюминий гироксидінің
жаңа шөккен гелінде өтетін түрлену
бола алады. Бастапқы гельдер бемит
құрылымында болады (![]() ).
Тозу процесінде олар
метатұрақты гидрат – байеритке (
).
Тозу процесінде олар
метатұрақты гидрат – байеритке (![]() )
өтеді, ал сонсоң тұрақты гидраргиллитке
(
)
өтеді, ал сонсоң тұрақты гидраргиллитке
(![]() ).
).
Әдебиет: 2 нег. [20-27], 3 нег. [298-328].
Бақылау сұрақтары:
1. Гидрометаллаургияда қолданылатын қиын еритін қосылыстардың сыныптары.
2. Ерігіштік туындысы туралы ұғым және металдар қосылысының ерігіштік туындысының шамалары бойынша қалай ерігіштікті және олардың шөгу қатарын анықтауға болады?
3. Металл гидроксидтерінің шөгу рН ықпал етуші факторлар.
4. Негізгі тұздардың шөгу рН ықпал етуші факторлар.
5. Сульфидтердің шөгуіне ықпал етуші факторлар.
6. Жеке фазалар түрінде ерітінділерден шөктіру әдісі бойынша екі металды бөлу кезінде шешілетін міндеттер.
7. Шөгінділердің физикалық және химиялық тозуы.
№ 10 дәріс: Металдардың электрохимиялық бөлінуі мен тазартылуы
10.1 Электролиздің теориялық негіздері. Электролиз металдарды бөлу мен тазартуда кеңінен қолданылатын және ең тиімді әдістерінің бірі. Бұл әдістің басқалармен салыстырғандағы артықшылығы, оның процесті үздіксіз жоғары өнімділікпен жүргізуге мүмкіндік беруінде. Электролизді сулы ерітінділердеде және балқыған тұдардада, қаттыда, сұйықта электродтарды қолданумен жүргізуге болады. Процесті ерімейтін анодтарды қолданумен (электролиттік шөгу) және еритін анодтарды (электролиттік тазарту (рафинирлеу) қолданумен жүргізеді.
Электролиттік алынған және тазартылған металдар (Cu, Ni, Zn, Sn, In, Ga, Au +Ag, Al) жаңа техниканының қажетсінуіне тікелей қолданыла алады. Тазартудың бұл әдісімен, процесті дұрыс жүргізген кездерде, жеке қоспалардың мөлшерін 10-7 - 10 -9% дейін қамтамасыз ете алады. Дегенмен, көбінесе электролиз тазартудың бірінші сатысы ретінде қолданылады, және мұнда алынған металл тереңдете тазартудың бастапқы материалы қызметін атқарады.
Электродтық процестің термодинамикасының негізінде кернеу қатары жатады (электрохимиялық қатар), яғни тепе-теңдікті жағдайларда алынған (стандартты потенциалдар) қайтымды электродтық потенциалдар шамасы. ц0 шамасы бойынша катодтағы металл катиондарының разрядынң қатары туралы немесе анодтағы металл атомдарының иондалуы туралы айтуға болады.
Катодта бірінші кезекте ең электрлік оң металл шөгеді, ал анодта бірінші кезекте ең электрлік теріс компонент ериді.
Нақты жүйелерде электролиз тепе-теңдіктен айырмашылықты жағдайларда жүргізіледі. Одан өзге, электролиз процесі – бұл жай элементарлық акт емес, бірнеше сатыла арқылы өтетін күрделі, электрохимиялық құбылыс:
– электрод бетіне ерітінді көлемінен ионның келуі (немесе электрод бетінен ерітінді көлеміне кетуі). Бұл саты негізінен, еріген заттың ерітінді көлеміндегі және электрод бетіндегі концентрациясының айырмасы нәтижесінде пайда болатын диффузия есебінен жүреді;
– ион (катодтық процесс) немесе металл атомдарының иондалуы (анодтық процесс) разрядының электрохимиялық реакциясының өзі;
– жаңа заттың пайда болуы – электролиздің түпкілікті өнімі.
Мысалы, катодтық процесс кезінде: еген бұл зат – газ болса (мысалы, сутегі), онда соңғы саты атомдардан молекулалардың түзілуін, содан соң газ көбіктерінің пайда болуын және оларды электрод бетінен аластауды өзіне алады. Егер электролиз өнімі – қатты зат болса (тотықсызданған металл), онда соңғы саты оның кристалдық торының түзілуінен тұрады, ал екі немесе одан көп катиондардың біріккен разряды кезінде – қатты ерітінділердің немесе интерметалдық қосылыстардың түзілуінен тұрады. Ақырында, реакция өнімі болып ерітіндіде қалған ион табылса (мысалы, Fe3+-тің Fe2+ дейін тотықсыздануы кезінде), онда соңғы саты осы өнімді электрод бетінен ерітінді тереңіне аластаумен қорытындыланады.
Бірінші екі сатының ең баяуы, яғни лимиттеуші саты, жалпы электродтық процестің жылдамдығын анықтайды. Қандай сатының ең баяу болуына байланысты, электродтық процестің кинетикасын электрохимиялық және диффузиялық деп бөледі. Бірінші жағдайда ең баяу саты – бұл электрохимиялық реакция, ал екіншісінде – диффузиялық процесс.
Электрохимиялық реакцияның жылдамдығы экспоненциалдық заңға бағынады және катодтық реакция үшін
КZ+
+
Z![]() → K,
(74)
→ K,
(74)
өрнек алынады:
![]() (75)
(75)
Анодтық реакция үшін:
АZ–
– Z![]() → А
немесе
К
– Z
→ K
Z+,
(76)
→ А
немесе
К
– Z
→ K
Z+,
(76)
электрохимиялық реакциялар жылдамдығы тең:
![]() (77)
(77)
мұндағы Dk және Da – ток тығыздығы арқылы көрсетілетін электрохимиялық реакциялар жылдамдығы, А/см2 (ток тығыздығы – жылдамдық шамасы);
К1 және К2 – химиялық реакциялар жылдамдығының константалары;
ак және аа – реакцияға түсетін заттардың активтілігі (катионның және анионның);
б және в – 0 мен 1 аралығында жатқан кинетикалық коэффициенттер, олар өзара теңдікпен б + в = 1 байланысқан;
Z – ионның валенттігі (заряд);
F –Фарадей саны;
ц – потенциал.
Катодтағы диффузиялық процестің жылдамдығы:
Dk = KD (a – as), (78)
мұндағы Dk –конвективті диффузия жылдамдығы;
KD –конвективті диффузияның жылдамдығының константасы;
а – ерітінді қабатындағы диффузияланушы бөлшектердің активтілігі;
as – бұлда сол, тек катод бетінде.
Тура осында өрнек (78), анод үшінде жазыла алады.
Диффузияның жылдамдығы температураға, еріген заттың және еріткіштің табиғатына, электродты жуып өтетін ерітіндінің қозғалысының қарқындылығына тәуелді болады.
10.2 Катиондардың қалпына келуінің поляризациялық қисықтары. Поляризациялық қисық потенциалға –ц тәуелді катионның қалпына келу жылдамдығын Dк сипаттайды (31, а сурет). Біз, катодтық процесті қарастыратын болғандықтан, катодтық токтың тығыздығы Dк координата бастауынан жоғары салынды. Абсцисса осі бойынша оңға қарай, потенциал өзгерісінің тепе-теңдіктен теріс жаққа жарай өзгеруі салынды.
Токтың
төменгі тығыздығында тәуелділік
экспоненциалдық
(дәрежелік)
заңға
сүйенеді,
ол
заңнан алысырақ ауытқиды, және ток
тығыздығы Dк
(катионның
қалпына келу жылдамдығы)
электрод
бетіне иондардың келу жылдамдығымен,
яғни диффузия жылдамдығымен, негізделетін
кейбір максимал мәндерге ие болады.
Бұл
токтың максимал
тығыздығы
шекті ток немесе токтің шекті тығыздығы
Dp1
атауын
алады.
А
сызығы
жуық шамамен электрохимиялық
кинетика
аймағын шектейді,
бұл
жерде Dк
и
–![]() ц
арасындағы
кәдімгі
экспоненциалдық
тәуелділік
дұрыс.
Катодтық
поляризацияның
жоғарылау шамасы бойынша,
реакция
жылдамдығы артады
және
диффузия,
уақыт бірлігінде электрод бетіне
жеткілікті иондар санын бермеумен,
оны
тежей бастайды.
ц
арасындағы
кәдімгі
экспоненциалдық
тәуелділік
дұрыс.
Катодтық
поляризацияның
жоғарылау шамасы бойынша,
реакция
жылдамдығы артады
және
диффузия,
уақыт бірлігінде электрод бетіне
жеткілікті иондар санын бермеумен,
оны
тежей бастайды.
Dк
а
0 φтеп.(I) φтеп.(II) - φ
Катодтық потенциал
а – екі катионның қалпына келуі; б – негізгі металл мен қоспалардың бөлінуі: 1 – ең электрон қоспалардың бөлінуінің тепе-теңдікті потенциалы; 2 – бұлда сол, тек ең электртеріс қоспанікі; 3 – ал бұл негізгі металдікі
31 сурет – Поляризациялық қисықтар.
|
|
Электрохимиялық
кинетиканы
көрсететін
заң (пунктирлі
қисық
I),
және
бақыланатын
поляризациялық
қисық
(тұтас
сызық)
ажырайды.
В
сызығы
аралас кинетика аймағын шектейді, мұнда
электродтық реакция жылдамдығы мен
диффузия салыстырмалы шамаларда болады.
Катодтық поляризацияның жоғарылау
шамасы бойынша электродтық реакция
жылдамдығы диффузиямен көбірек шектеле
бастайды. Ақырында, диффузия жылдамдығы
ең мүмкіндікті мәнге жеткенде, шекті
ток жағдайы келеді. Бұл кезде қисық
абсцисса осіне параллель жүреді және,
бұл поляризацияны жоғарылатумен
реакция жылдамдығын өзгерту мүмкін
еместігін көрсетеді. Бұл жағдайларда
![]() .
.
С қисығы диффузиялық кинетика аймағын шектейді.
Егер
ерітіндіде, катодта қалпына келуге
қабілетті катионның тек бір түрі болатын
болса, поляризацияның ары қарай
жоғарылауы, су молекулаларының ыдырауы
есебінен сутегінің бөлінуі басталатын
кездегі өріс кернеуінің жоғарылығына
дейін, басқа ешқандай электрохимиялық
процесті тудыра алмайды. Дегенмен тұз
ерітінділерінде екінші металдың
қатысуымен поляризациялық қисық келесі
түрде өзгереді. 27 сутетте көргеніміздей,
МеII
қарағанда
МеI
барынша оң (терістігі өте төмен)
тепе-теңдікті потенциалда болады.
Сондықтан қалпына келу реакциясында
![]() иондары
цравн(I)
қарағанда
терісірек, ал цравн(II)
салыстырғанда
оңырақ потенциалдарда қатыспайды.
Электрод потенциалы
иондары
үшін тепе-теңдіктен терісірек болғанда,
олар қалпына келе бастайды.
Мұндай
потенциалда
электродта
катиондардың
екі түріде қалпына келеді:
Dp1
шамасымен өлшенетін,
иондары
цравн(I)
қарағанда
терісірек, ал цравн(II)
салыстырғанда
оңырақ потенциалдарда қатыспайды.
Электрод потенциалы
иондары
үшін тепе-теңдіктен терісірек болғанда,
олар қалпына келе бастайды.
Мұндай
потенциалда
электродта
катиондардың
екі түріде қалпына келеді:
Dp1
шамасымен өлшенетін,
![]() иондары
шекті
жылдамдықпен,
және
МеII
иондары
–
электрохимиялық
кинетика заңына сүйенетін, жылдамдықпен.
Поляризацияны
ары қарай жоғарылату жоғарыда
үшін
сипатталғандай,
қалпына
келу жылдамдығының өзгерістеріне
әкеледі.
Ақырында
МеII
иондары үшінде шекті ток жағдайы
басталады.
Бұл
кездегі катодтағы ток тығыздығы
иондары
шекті
жылдамдықпен,
және
МеII
иондары
–
электрохимиялық
кинетика заңына сүйенетін, жылдамдықпен.
Поляризацияны
ары қарай жоғарылату жоғарыда
үшін
сипатталғандай,
қалпына
келу жылдамдығының өзгерістеріне
әкеледі.
Ақырында
МеII
иондары үшінде шекті ток жағдайы
басталады.
Бұл
кездегі катодтағы ток тығыздығы
Dр(к) = Dр(I) + Dp(II). (79)
Екі немесе бірнеше катиондардың біріккен разряды мүмкіндікті, егер катод потенциалы, берілген нақты жағдайларда осы процестердің қайтымды потенциалдарынан терісірек болса.
Бұл жағдайларда катодтағы реакция жылдамдығын өлшеуші ток тығыздығы, барлық паралель катодты реакцияларға баратын токтар тығыздығының қосындысына тең болады.
Электролиз жағдайларында таза металды алу кезінде, қоспа концентрациясы катодтық шөгіндіде аз шамада болғанда, тәжірибе жүзінде барлық металдар не қатты ерітінділер түзейді, не болмаса металл-қоспаның негізгі металмен, оның артықшылығы болғанда, интерметалдық қосылыстардың қатты ерітінділерін түзейді. Қоспаның негізгі металмен қатты ерітінді түзеу мүмкіндігі оның бөлінуін жеңілдетеді және қоспалар иондары тіпті олардың электрохимиялық потенциалдары негізгі металдың потенциалдарына қарағанда электртерісірек болған кездеде катодта разрядталу мүмкіндігін алады. Мысал ретінде никельдің, кобальттың және темірдің электролизі кезіндегі мырыш қоспасының беталысын көрсетуге болады.
Егер мырыштың тепе-теңдікті электродтық потенциалдары шамасынан (–0,763 В) және темір тобының металдарынан (φСо/Co2+ = –0,277 B; φFe/Fe3+ = –0,036 B) шығатын болсақ мырыш бұл металдармен катодта шөкпеуі керек. Дегенмен, деполяризацияның нәтижесінде (қатты ерітіндінің түзілуіне қарай) катодтық қисық электрон потенциалдар жағына күрт ығысады, бұл кезде мырыш пен темір тобының металдарының біріккен разряды мүмкіндікті болады.
Қоспаның иондарының разряды оның ерітіндідегі төменгі концентрацияларында өтеді. Осыны ескере отырып, сонымен қатар қолданылатын токтың катодтық тығыздығының үлкендігін ескеріп, көптеген қоспалардың иондары шекті токта (ток тығыздығынды) техникалық электролиз жағдайларында разрядталатынын күтуге болады. Шынындада, сулы ерітінділер электролизі 500 а/м2 шамасында ток тығыздығында жүреді, ал шекті токтар, мысалы, мыс пен қалайының сульфаттық ерітінділері үшін қоспалардың тәжірибелік концентрацияларында ерітіндіде бір квадрат метрге бірнеше ампер келеді.
Осы
сұрақты поляризациялық қисықтар
көмегімен жан-жақты қарастырайық (31,
б
сурет).
Мұндағы
φp1
– бірінші
қоспаның қайтымды (тепе-теңдікті)
потенциалы,
ал
φp2
осы
жағдайлардағы екінші қоспаның
қайтымды потенциалы.
Берілген
кезеңдегі катод потенциалын,
ток тығыздығы Dк
кезінде,
φk
арқылы белгілейміз.
Ерітіндіде
бірінші қоспаның иондарының концентрациясы
жеткілікті және катодтық потенциалдың
тұрақты жоғарылауы болған кезде 1 қисыққа
сәйкес келетін осы қоспаның иондарының
разряды ғана өтер еді.
Бірақ,
ерітіндідегі
қоспа иондарының концентрациясы
аз болатындықтан, токтың аз тығыздығының
өзінде-ақ шекті ток түседі және
поляризациялық
қисықта
көлденең бөлімше пайда болады.
Катод
потенциалы
негізгі
металдың бөлінуі басталғанға дейін ток
тығыздығының жоғарылауынсыз артады.
Катодтық
потенциалды ары қарай жоғарылату
негізгі
металл мен бірінші қоспаның біріккен
разрядына әкеледі.
Жиынтық
поляризациялық
қисық,
жалпы айтқанда, 3 қисықпен дәл түспеуі
қажет,
ал
3
қисыққа паралель жоғары қарай бірінші
қоспаның шекті тогі шамасына
ығыстырылуы керек.
Бірақ
токтің тығыздығы аз болғандықтан,
біз ешқандай қателіксіз негізгі металдың
және қоспаның жиынтық қисығын 3 қисықпен
теңестіре аламыз.
Екінші
қоспа негізгі металмен және қоспамен,
тек ток тығыздығы
![]() жеткенде ғана бірге разрядталуды
бастайды, ал
ары қарай оны жоғарылатқанда екінші
қоспаның разряды
токтың
шекті тығыздығында өтеді.
Сонымен,
шекті
токта, негізгі металға қарағанда,
электроңдыда, терістіде қоспалар
разрядтала алады.
Соңғы
жағдай үшін, жұмыс істеуші катодтың
потенциалына жауап беруші нүктеден
қалпына келтірілген перпендикулярдан
сол жақта жататын потенциалдар
кезінде шекті токтың түсуі қажет.
жеткенде ғана бірге разрядталуды
бастайды, ал
ары қарай оны жоғарылатқанда екінші
қоспаның разряды
токтың
шекті тығыздығында өтеді.
Сонымен,
шекті
токта, негізгі металға қарағанда,
электроңдыда, терістіде қоспалар
разрядтала алады.
Соңғы
жағдай үшін, жұмыс істеуші катодтың
потенциалына жауап беруші нүктеден
қалпына келтірілген перпендикулярдан
сол жақта жататын потенциалдар
кезінде шекті токтың түсуі қажет.
Егер қоспа шекті токта разрядталса (яғни диффузиялық аймақта), онда қоспамен ластаны дәрежесі анықталады:
![]() ,
(80)
,
(80)
мұндағы
![]() –
қоспа
иондарының конвективті
диффузиясының
жылдамдық константасы;
–
қоспа
иондарының конвективті
диффузиясының
жылдамдық константасы;
![]() – ерітіндідегі
қоспаның концентрациясы;
– ерітіндідегі
қоспаның концентрациясы;
![]() =
DМ
+ Di
–
токтың
қосынды
катодтық тығыздығы (D
=
=
DМ
+ Di
–
токтың
қосынды
катодтық тығыздығы (D
=
![]() DМ
+
DМ
+
![]() Di
);
Di
);
DМ және Di – негізгі металл мен қоспаның разрядталуы үшін қажетті сәйкес ток тығыздықтары;
және – негізгі металл мен қоспаның сәйкес ток бойынша шығыстары.
Байқағанымыздай, шекті токте разрядталатын, металдың қоспамен ластану дәрежесі, оның ерітіндідегі концентрациясына тура пропорционал және катодтағы ток тығыздығы мен негізгі металл тогі бойынша шығысына кері пропорционал. Температураның әсері, осы фактордың мен ток бойынша металл шығысына ықпалымен есептеледі.
Шекті токтағы қоспаның разряды, қаншалықты негізгі металл электртерісті және ол үлкен поляризациямен разрядталса, соншалықты ықтималды болады. Мысалы, никель электролизі кезінде электрохимиялық қасиеттері бойынша әртүрлі мыс, қорғасын, кадмий, мырыш және кобальт сияқты қоспалар, шекті токте разрядталады.
Теңдеуден (80) келесі маңызды қорытындыларды жасауға болады. Біріншіден, белгілі, конвективті диффузия жылдамдығының константасы барлық дерлік еківалентті металдарда тәжірибе жүзінде бірдей. Ал теңдеуде қоспаның өзіндік ерекшелігін сипаттаушы басқа шамалар жоқ, демек, металдың шекті токта разрядталған еківалетті металмен ластану дәрежесі, барлық басқа жағдайлардың теңдей кезінде, осы қоспалардың барлығы үшін бірдей. Екіншіден, негізгі металдың қасиеттерімен анықталатын шамалар теңдеуге кірмейді. Демек, негізгі металдың табиғаты мен оның концентрациясы катодтық шөгіндінің қоспалармен ластану дәрежесіне әсер етпеуі керек.
10.3 Қоспалардың электролиз кезінде аласталуы. Қоспалар мен негізгі металдың бөліну жылдамдықтарын анықтаушы сатыларға тәуелді, олардың иондарының бірігіп разрядталуы заңдылықтарының төрт әртүрлі типін көрсетуге болады.
Заңдылықтардың бірінші типі. Егер қоспа мен негізгі металл өте аз поляризациямен разрядталса, онда олардың бөлінуі конвективті диффузия жылдамдығымен анықталады. Егер екі металда бірдей валенттікте болса (мысалы, еківалетті), онда екіуі үшінде конвективті диффузия константасы бірдей болады. Диффузиямен шектелетін процестің жылдамдығы мына теңдеумен анықталатынын ескере отырып:
![]() .
(81)
.
(81)
Келесідей қорытындыға келуге болады, шөгіндідегі қоспалардың салыстырмалы мөлшері оның ерітіндідегі концентрациясына тура пропорционал болуы керек.
Заңдылықтардың екінші типі. Егер негізгі металдың разряды қандайда байқалатын поляризациямен жүретін болса, онда қоспалардың мәнді мөлшері шекті токта разрядталады. Бұл – барынша кең тараған жағдай.
Негізгі металдың бөліну жылдамдығы разряд сатысымен анықталатын болса, онда қоспа мен негізгі металдың бірдей валенттігі кезінде, қоспа негізгі металдан жылдамырақ бөлінеді, демек, шөгінді ерітіндіге қарағанда қоспалармен көбірек ласталған болады. Осы жағдайда катодтық шөгіндідегі қоспа мөлшері (80) теңдеумен анықталады. Токтың төменгі тығыздығы кезінде алдын-ала электролиз жүргізе отырып, және электролитті негізгі металмен кедейлендірмей қоспаның негізгі массасын бөлуге, яғни электролитті тазартуға болады.
Заңдылықтардың үшінші типі. Қоспа мен негізгі металдың бөліну жылдамдығы разряд сатысының жылдамдығымен анықталған жағдайда, негізгі металл разрядының жылдамдық константасы қоспа разрядының жылдамдық константасынан жоғары болуы керек. Шынындада, егер қоспа разрядының жылдамдық константасы негізгі металл разрядының жылдамдық константасынан үлкен болса, қоспа ерітіндідегі оның концентрациясының мәнсіздігінен, шекті токта ғана разрядталады, бұл катодты шөгіндінің қоспамен ласталуына әкеледі. Ал негізгі металл иондарының разрядталу жылдамдығының константасы қоспанікінен жоғары болса, онда бұл шөгіндінің ерітіндіден тазарақ болуына келтіреді.
Заңдылықтардың төртінші типі. Бұл жағдай таза металл алу үшін барынша қолайлы. Соңғыны, процесті токтың өте аз тығыздығында жүргізе отырып, жәнеде қоспа негізгі металға қарақанда оң электрлі болған кезде ғана жүзеге асыруға болады. Ток тығыздығын жоғарылату негізгі металдың қоспамен ластануына әкеледі.
Тазалығы жоғары дәрежедегі металды электролитті алу кезінде, электролитті бөтен катиондар қоспаларынан терең тазарту өте маңызды. Бұл жалпы жағдайда электрохимиялық әдіспен жүргізіледі – электролиттің «алдын ала электролиздеу» атаулы жолымен. Қолдағы бар теориялық және эксперименттік мәліметтер металдардың электрохимиялық тазартылуы туралы бірқатар қорытындылар жасауға мүмкіндік береді:
– ерітіндінің төменгі жылдамдықта ағуы кезінде тазартудың максимал тереңдігіне жетуге болады;
– катодтық беттің ұлғаюымен тазарту тереңдігі артады;
– электролитті араластыру қарқындылығының жоғарылауымен конвективті диффузия жылдамдығының константасы көбейеді, демек, тазарту тереңдігіде;
– электролизде температураны жоғарылату тазару көрсеткішін жақсартады;
– бірізді қосылыстырылған ұялар санының өсуімен тазарту тереңдігі артады;
– электрохимиялық тазартуды, электролит негізгі металл иондарымен кедейленбейтіндей, төменгі ток тығыздығында өткізген жөн, бұл екі жағдаймен жүре алады:
а) токтың төменгі тығыздығы кезінде, шекті токта оң электрлі қоспалар катиондарының разряды және оларды осындай жолмен, кейін негізгі электролизге түсетін, электролиттен аласталуы өткенде, алдын ала электролиз жүргізумен;
б) зарядталған диафрагмамен (мысалы, тесілген графит) жабдықталған электролизерда электролиз процесін жүргізумен, ол катодты қоршайды және онда катодтан ток желіленеді, оның күші токтың шағын тығыздығын жасауға жетеді. Ол оң электрлі қоспалар катиондарының диафрагмадағы разряды үшін және токтың жоғары тығыздығында таза металдың катодта бөлінуін қамтамасыз етуге жеткілікті болуы керек.
Әдебиет: 1нег. [140-175], 2 нег. [108-124]
Бақылау сұрақтары:
1. Металл қандай тәртіппен катодта шөгеді және анодта ериді?
2. Электролиздің өту сатылары.
3. Екі катионның қалпына келуінің поляризациялық қисықтары және олардың разрядталу тәртібі.
4. Металдар иондарының біріккен разрядына деполяризацияның әсері.
5. Шекті токта разрядталатын қоспамен ластану дәрежесі.
6. Металдар иондарының біріккен разрядының заңдылықтары.
№ 11 дәріс: 11.1 Электролитті қоспалардан цементациямен тазарту. Электролитті оң электрлі иондар қоспасынан тазарту үшін цементация немесе ішкі электролиз қолданыла алады – ерітіндіден бір металдың иондарын екіншісімен ығыстырып шығару, бұл кезде оның бірі иондық күйден металдыққа өтеді, ал екіншісі – металдықтан иондыққа. Цементация негізі келесі реакцияға сүйенеді:
Z1Me![]() +
Z2Me2
—> Z2Me1
+
Z1Me
+
Z2Me2
—> Z2Me1
+
Z1Me![]() ,
(82)
,
(82)
мұндағы Ме1 және Ме2 – металдар;
Z1 және Z2 – олардың валенттігі.
Жалпы алғанда, цементация ерітінділерден бағалы металдарды бөліп алу үшінде, сонсоң электролизге түсетін, электролиттерді қоспалардан тазарту үшінде қолданыла алады. Бірінші жағдайда бағалы металл бағалылығы төмен металдармен ығыстырылып шығарылады (мысалы, мыстың темірмен немесе алтынның мырышпен бөлініп алынуы). Таза металды алу үшін мүдделі болатын, екінші жағдайда, цементациямен электролиттің негізгі компонентіне қарағанда, барынша электрлік металдарды аластайды. Электролиттің ығыстырылатын металл иондарымен ластануын болдырмау үшін бұл рольді электролиттен бөлініп алынатын металл атқарады (мысалы, мырыштық электролиттен мыс пен кадмийдің мырышпен шығарылуы немесе индий электролитінен қорғасынның, қалайының, мыстың және никельдің индиймен шығарылуы).
Цементация реакциясы ол изобаралық потенциалдың төмендеуімен жүрген кезде ғана өтеді. Бұл шығарылатын металға Ме1 қарағанда, ығыстыратын металдың Ме2 барынша теріс электрлі электродтық потенциалға ие болуымен жүреді. Сондықтан, кернеу қатарының кез-келген теріс электрлі металдар ерітіндіден кез-келген оң электрлі металдың ионын ығыстыруы керек. Ығыстырушы металл артығша болғанда процесс, берілген ерітіндідегі екі металдыңда электрохимиялық потенциалдарының тепе-теңдігімен анықталатын тепе-теңдік басталғанға дейін жалғасады. Демек, егер цементация балқыманың немесе интерметалдық қосылыстың түзілуімен жүрмейтін болса, онда цементация кезіндегі тепе-теңдік шартын немесе екі металдыңда электрохимиялық потенциалдарының теңдігін келесідей жазуға болады:
![]() ,
(83)
,
(83)
мұндағы
![]() және
және
![]() –
ығыстырылатын және ығыстырушы металдардың
стандартты
потенциалдары;
–
ығыстырылатын және ығыстырушы металдардың
стандартты
потенциалдары;
![]() және
және
![]() – олардың иондарының ерітіндідегі
активтілігі.
– олардың иондарының ерітіндідегі
активтілігі.
Бұл теңдік ерітіндідегі Мех иондардың өте аз мөлшерінде (активтілігінде) жиі орын алады және осы кезде цементациямен электролиттен оң электрлі металдар иондарын толығымен аластауға болады.
Цементация процесінің механизмі электрохимиялық болып табылады. Электродтық реакциялар кинетикасының қазіргі теориясына сәйкес, электролитпен түйісуде болатын кез – келген металдың бетінде кездесетін катодтық және анодтық электрохимиялық реакциялар өтеді. Бұл кезде олар металдың толығымен біртекті бетіне жүреді. Егер электролитте Ме2 қарағанда, оңэлектрлі металдар иондары болса, онда металл мен ерітінді арасындағы алмасу бірден басталады және бетте ығыстырылушы металмен жабылған бөлімшелер пайда болады. Электрондар металл бойынша ығыстырушыдан ығыстырылатын металдың катодтық бөлімшелеріне ағып өтеді. Анодтық бөлімшелерде кері процесс жүреді – ығыстырушы металл атомдарының, оның ығыстырылатын металдың мөлшеріне эквивалентті мөлшерде электролитке өтуімен иондалуы (32 сурет).



