
1.5.2. Теория электролитической диссоциации.
План.
1. Механизм процесса электролитической диссоциации
2. Степень диссоциации. Зависимость степени диссоциации от природы вещества и концентрации.
3. Уравнения процесса диссоциации и константа этого обратимого процесса.
4. Понятие водно-солевого баланса.
5. Свойства кислот, оснований и солей в свете ТЭД. Реакции ионного обмена.
6. Протонная теория кислот и оснований Диссоциация воды. Ионное произведение воды. Водородный показатель.
7*. Значение рН для различных биологических сред организма.
8. Типы протеолитических реакций: ионизация, нейтрализация, гидролиз.
Гидролиз солей.
9*. Образование кислот в процессе метаболизма. Буферные растворы.
10*. Буферные системы организма.
1. Но есть вещества, свойства растворов которых сильно отклоняются от изученных нами закономерностей. К таким веществам относятся соли, кислоты и щелочи. Для них осмотическое давление, изменение температуры кипения раствора и т.д. всегда больше, чем это следует из концентрации раствора. В 1887 году Аррениус высказал предположение, что в растворах молекулы этих веществ распадаются на более мелкие частицы, и число частиц в растворе возрастает. Этот процесс он назвал диссоциацией. К числу самых непримиримых противников Аррениуса принадлежал Д. И. Менделеев, сформировавший "химическую" теорию растворов - в отличие от "физической" теории Аррениуса. Менделеев считал, что в растворах происходят, по сути, химические взаимодействия между растворённым веществом и растворителем. Спор между сторонниками и противниками Аррениуса длился не один год. И, как это часто бывает в науке, в ожесточённом споре между приверженцами физической и химической теории правы оказались обе стороны. Очень сильное химическое взаимодействие между ионами и молекулами растворителя даёт ту энергию, которая нужна для разрушения кристаллической решётки веществ-электролитов, например поваренной соли. В случае водных растворов эта энергия называется энергией гидратации, и эта энергия может иметь колоссальные значения. Так, энергия гидратации ионов Cl- равна 352 кДж/моль, ионов Na+ - 423 кДж/моль, ионов Н+ - 1109 кДж/моль, ионов Ca2+ - 1615 кДж/моль. Для сравнения: чтобы разорвать связь между атомами в молекуле хлора, требуется всего 242 кДж/моль. Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решётки) - 788 кДж/моль для NaCl, 1044 кДж/моль для LiF, 2240 кДж/моль для CaCl2 и т. д. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решётки, то растворение будет сопровождаться нагреванием, а если меньше - охлаждением раствора. Именно поэтому при растворении в воде таких веществ, как LiCl, безводный CaCl2, и некоторых других раствор нагревается, а при растворении NH4NO3, KNO3, KCl, и некоторых других - охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, снаружи покрывается росой или даже примерзает к мокрому столу. Большая часть электролитов - соли, т. е. кристаллические вещества. В узлах этих кристаллических решеток располагаются положительные и отрицательные ионы (значит, молекула уже диссоциирована), и эти ионы совершают колебательные движения около положения равновесия. Примером такого соединения является хлорид натрия NaCl. Процесс растворения начинается при соприкосновении молекул воды с поверхностью кристалла, т. е. на границе раздела твердого тела (NaCl) и жидкости (H2O). Молекулы H2O приближаются к ионам Na+ и Cl-, расположенным в узлах поверхностного слоя кристаллической решетки, при этом они ориентируются атомом кислорода к иону натрия, а одним из атомов водорода к ионам хлора, происходит взаимодействие ионов Na+ и Cl- с молекулами воды, ионы отрываются от кристалла (решетка разрушается), переходят в жидкость (в воду); с этого момента жидкость состоит уже не только из молекул H2O, но и ионов Na+ и Cl- - так образуется водный раствор хлорида натрия. Процесс растворения закончится, когда молекулы воды полностью разрушат решетку кристалла. Когда ион отрывается от поверхности кристалла, его немедленно окружают молекулы воды, ион гидратируется, причем молекулы воды, которые ближе всех к иону, ведут себя иначе, чем те, что находятся в отдалении. Ведь ионы обладают электрическим зарядом, и молекулы воды, попадая в электрическое поле заряженного иона, испытывают воздействие с его стороны. Для разных ионов число таких молекул воды будет разным, оно зависит от размера иона и его заряда. Эти молекулы воды образуют гидратную оболочку иона в растворе.
Вещества с полярной связью тоже подвергаются диссоциации, но сначала молекулы воды поляризуют ковалентную связь, а уже потом молекула распадается на ионы. Т.к. этот процесс более сложен, среди веществ с полярной связью не все молекулы распадаются на ионы.
2. Степень
распада электролита на ионы называется
степенью
электролитической диссоциации
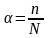 ,
где n
– число распавшихся на ионы частиц, а
N
– общее число частиц введенных в раствор.
Если числитель равен знаменателю –
степень диссоциации равна 1,
электролит называется сильным, он
хорошо проводит ток, в растворе много
ионов. Если только небольшая часть
частиц распалась на ионы, степень будет
много меньше 1, э
,
где n
– число распавшихся на ионы частиц, а
N
– общее число частиц введенных в раствор.
Если числитель равен знаменателю –
степень диссоциации равна 1,
электролит называется сильным, он
хорошо проводит ток, в растворе много
ионов. Если только небольшая часть
частиц распалась на ионы, степень будет
много меньше 1, э лектролит
будет называться слабым и
его раствор будет плохо проводить
электрический ток, т.к. концентрация
ионов в растворе мала. К сильным
электролитам относятся растворимые
соли и основания (ионная связь) и некоторые
кислоты (соляная, азотная, серная и др.
– ковалентная сильнополярная связь).
К слабым электролитам относится
большинство органических кислот и
оснований и некоторые неорганические
вещества (угольная, сероводородная,
цианистая и др. кислоты, раствор аммиака).
Т.е. степень
диссоциации зависит, прежде всего, от
природы вещества, а для слабых электролитов
она зависит очень сильно и от концентрации.
лектролит
будет называться слабым и
его раствор будет плохо проводить
электрический ток, т.к. концентрация
ионов в растворе мала. К сильным
электролитам относятся растворимые
соли и основания (ионная связь) и некоторые
кислоты (соляная, азотная, серная и др.
– ковалентная сильнополярная связь).
К слабым электролитам относится
большинство органических кислот и
оснований и некоторые неорганические
вещества (угольная, сероводородная,
цианистая и др. кислоты, раствор аммиака).
Т.е. степень
диссоциации зависит, прежде всего, от
природы вещества, а для слабых электролитов
она зависит очень сильно и от концентрации.
Если обозначить
концентрацию электролита через С, а
степень диссоциации через ,
то концентрация каждого из ионов будет
С·
,
а концентрация нераспавшихся молекул
будет С· (1-
).
И уравнение для константы диссоциации
примет вид:
,
то концентрация каждого из ионов будет
С·
,
а концентрация нераспавшихся молекул
будет С· (1-
).
И уравнение для константы диссоциации
примет вид:
 ,
это уравнение выражает закон
разбавления Оствальда
и дает возможность вычислять степень
диссоциации при различных концентрациях,
если известна степень диссоциации
электролита. Для растворов очень слабых
электролитов
<<1,
поэтому, пренебрегая этой величиной в
знаменателе, мы получим
,
это уравнение выражает закон
разбавления Оствальда
и дает возможность вычислять степень
диссоциации при различных концентрациях,
если известна степень диссоциации
электролита. Для растворов очень слабых
электролитов
<<1,
поэтому, пренебрегая этой величиной в
знаменателе, мы получим
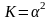 ·C
·C
И это уравнение наглядно показывает, что степень диссоциации возрастает при разбавлении растворов. Чем меньше концентрация слабого электролита, тем больше степень диссоциации. Сильные электролиты в водных растворах обычно полностью диссоциированы. В разбавленных растворах образовавшиеся ионы будут двигаться независимо друг от друга. И если это концентрированные растворы, то расстояние между ионами небольшое, а значит и взаимодействие велико. Например, в насыщенном растворе хлорида натрия расстояние между ионами всего в 2 раза больше, чем в кристаллической решетке. Перемещение ионов в концентрированных растворах происходит очень трудно: при своем движении они встречают большое сопротивление со стороны ионов с зарядом противоположного знака. При столкновениях часть ионов соединяется в молекулы, которые через некоторое время опять распадаются, т. е. реальная (ее называют активной) концентрация электролита будет меньше начальной концентрации соли в воде. Таким образом, число ионов, способных переносить электричество, всегда меньше числа ионов присутствующих в растворе и соответствующих данной концентрации электролита. Поэтому для концентрированных растворов принято говорить не о концентрации ионов электролита в воде, а об активности ионов. Благодаря взаимодействию между ионами, они не могут совершенно свободно двигаться, и свойства сильного электролита, зависящие от концентрации, проявляются так, словно степень диссоциации меньше 1. Для оценки состояния сильного электролита в растворе пользуются величиной называемой активностью или эффективной концентрацией: а = f· c где f – коэффициент активности. Чем более разбавлен раствор, тем ближе значение f к 1. В разбавленных растворах на коэффициент активности влияет в основном заряд иона и ионная сила раствора, которая определяется концентрацией и зарядами всех ионов, находящихся в растворе.
 ,
где I
– ионная сила раствора, z
– заряд иона и с – его концентрация.
,
где I
– ионная сила раствора, z
– заряд иона и с – его концентрация.
Активную роль в процессе диссоциации играет вода. Что определяет свойства воды как растворителя электролитов? Прежде всего, это полярный характер молекул воды. Кроме того, у воды большая диэлектрическая постоянная ε. ε - это характерная для данной среды величина, которая показывает, во сколько раз сила взаимодействия двух единичных зарядов на расстоянии, равном единице, в данной среде меньше такой же силы в вакууме. Эта величина фигурирует в законе Кулона. Другими словами, чем больше значение ε, тем слабее взаимодействие между двумя разноименными зарядами, попавшими в данную среду. Но ведь в кристаллических решетках ионы соединяются между собой именно под действием электростатических сил.
3. Процесс диссоциации записывается с помощь уравнений. Здесь незаменимая шпаргалка – таблица растворимости. Например:
1) Al2(SO4)3 Al3+ + 3SO42-
2) MgCl2 Mg2+ + 2Cl-
3) Na3PO4 Na+ + PO43-
4) HCl H+ + Cl-
5) H2SO4 2H+ + SO42-
6) NaOH Na+ + OH-
7) Ba(OH)2 Ba2+ + 2OH-
На какие ионы диссоциируют в растворах кислоты? Щелочи? Соли?
Как всякое химическое равновесие, оно является динамическим и зависит от природы вещества и температуры. Для многоосновных кислот и оснований многовалентных металлов диссоциация происходит ступенчато. В растворах таких веществ устанавливаются несколько равновесий, в которых участвуют ионы с различными зарядами. Например:
H2CO3 = H+ + HCO3-
HCO3- = H+ + CO32-
К равновесию, которое устанавливается в растворах электролитов, можно применить законы химического равновесия. Константа, которая отвечает этому процессу, называется константой диссоциации. Выражение для константы диссоциации всегда можно записать по закону действующих масс. Например, для угольной кислоты первое равновесие характеризуется К1, а второе – К2. Причем всегда К1> К2.
Итак: Электролиты – это вещества, растворы которых проводят электрический ток. К ним относятся кислоты, основания и соли. Электролитическая диссоциация – процесс распада электролита на ионы. Ионы – заряженные частицы, на которые распадаются электролиты. Степень диссоциации – отношение числа распавшихся частиц к общему числу частиц, введенных в раствор. Слабые электролиты – это электролиты, которые распадаются в незначительной степени. Сильные – распадаются практически полностью. Степень диссоциации зависит от природы вещества и концентрации электролита. Константа диссоциации зависит только от природы электролита и характеризует равновесие, которое устанавливается в растворе электролита.
4. Знание свойств сильных и слабых электролитов, умение определять концентрацию ионов в растворах необходимы медику и фармацевту. Жидкие среды организма содержат большое количество различных ионов: водорода, натрия, калия, хлора, кальция и т.д. От концентрации ионов зависит величина осмотического давления плазмы крови и др. биологических жидкостей. Природа возникающих в организме биопотенциалов имеет ионный характер. Клеточных мембраны имеют избирательную проницаемость, она определяется природой и состоянием ионов в растворах. От концентрации ионов зависит величина электродных потенциалов ионов; эти потенциалы определяют возможность и направление окислительно-восстановительных процессов в клетках. Особой биологической активностью обладают ионы водорода и гидроксид-ионы, которые определяют кислотность внутренних сред организма, влияют на активность ферментов и других БАВ. Постоянство концентраций различных ионов в биологических средах принято называть водно-солевым балансом. Нарушение водно-солевого баланса свидетельствует о различных патологиях. В нормальном состоянии водно-солевой баланс поддерживается на одном уровне в результате деятельности различных систем организма.
5. Свойства солей, кислот и оснований можно и нужно рассматривать как свойства ионов, которые находятся в их растворах. Т.е. во всех растворах кислот есть один общий ион – ион водорода. Все общие свойства кислот – это свойства именно этого иона. В растворах щелочей всегда есть гидроксид-ион. Значит все общие свойства щелочей - это свойства гидроксид-ионов. У солей нет общих ионов, и свойств общих у них нет. Для всех электролитов есть фактически одно общее химическое свойство, один тип реакций, в которые они все вступают, это реакции ионного обмена. Эти процессы обмена между электролитами в принципе обратимы. Но если в результате обмена ионы связываются и вновь не распадаются (потому что образовался слабый электролит, т.е. газ, вода, слабая кислота или щелочь, малорастворимое соединение), то реакция становится практически необратимой. Суть происходящего процесса показывают ионные уравнения:
1) Сa(NO3)2 + K2CO3 =>CaCO3 + 2KNO3
Ca2+ + 2NO3- + 2K+ + CO32- => CaCO3 +2K+ + 2NO32-
Ca2+ + CO32- => CaCO3
2)NaCl + AgNO3 = AgCl + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl + Na+ + NO3--
Ag+ + Cl- = AgCl
3)K2CO3 + 2HNO3 = 2KNO3 + H2O + CO2
2K+ + CO32- + 2H+ + 2NO3- = 2KNO3 + H2O + CO2
2H+ + CO32- = H2O + CO2
4)Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2H+ +2Cl- = Cu2+ + 2Cl- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Реакции ионного обмена широко используются для получения различных солей, кислот, оснований и для их анализа. Умение записывать общие и сокращенные ионные уравнения для реакций между электролитами - обязательное требование школьной программы.
Алгоритм составления ионных уравнений:
Составьте формулы электролитов, вступивших в реакцию ионного обмена и формулы продуктов реакции.
Расставьте коэффициенты в уравнении.
Отметьте вещества, которые не распадаются на ионы (т.е. малорастворимые вещества, газы, слабые электролиты: вода или некоторые кислоты). Пользуйтесь таблицей растворимости.
Перепишите уравнения, записывая вместо формулы сильного электролита ионы, на которые он распадается, с учетом числа этих ионов в молекуле (индекса) и числа молекул этого вещества (коэффициента в уравнении).
Зачеркните справа и слева в уравнении ионы, которые повторяются.
Перепишите то, что осталось отдельной строкой.
6. Первое научное определение кислот и оснований дала теория Аррениуса – ТЭД. Исследования диссоциации веществ в неводных растворителях расширило представления о веществах, проявляющих кислотные и основные свойства. В 1923 году Бренстед и Лоури предложили протонную теорию кислот и оснований. Согласно этой теории, кислотами следует называть вещества, которые могут быть донорами протонов, а основаниями – вещества, способные присоединять протон (акцепторы протонов).
А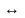 В
+ Н+,
где А- кислота, В- основание, сопряженное
этой кислоте. По этой теории кислотами
и основаниями могут быть не только
нейтральные частицы, но и ионы.
В
+ Н+,
где А- кислота, В- основание, сопряженное
этой кислоте. По этой теории кислотами
и основаниями могут быть не только
нейтральные частицы, но и ионы.
НСl H+ + Cl-
NH4+ H+ + NH3
HCO3- H+ + CO32-
Протоны, которые отдает кислота, должны присоединяться к молекуле растворителя. Если растворитель не способен ни присоединять, ни отдавать протоны, то в нем вещество не может проявлять ни кислотных, ни основных свойств. Т.е. растворенное вещество и растворитель должны образовывать пару:
А1 + В2 В1 + А2
Таким растворителем, который может и присоединять и отдавать протон, является вода. И диссоциацию кислоты и основания в воде, согласно этой теории, надо записывать так:
НCl + H2O H3O+ + Cl-
NH3 +H2O NH4+ + OH-
Если электролит проявляет свойства и кислот, и оснований их называют амфотерными или амфолитами. Вода является очень слабым амфотерным электролитом, у кислот она принимает протон, а основаниям отдает его. Как известно, ее диссоциация идет по схеме:
H 2O
H++
OH-
2O
H++
OH-
Константа диссоциации воды очень малая величина
 ,
при 2980К
,
при 2980К
Подставив в это уравнение равновесную концентрацию недиссоциированных молекул воды (число моль воды в 1 л [H2O] = 55,6 моль/л), получаем новую постоянную, которую в теории растворов называют ионным произведением воды:
 КВ=К·[H2O]
= [H+]·
[OH-]
КВ=К·[H2O]
= [H+]·
[OH-]
 10-14моль/л
10-14моль/л
В чистой воде концентрации ионов водорода и гидроксила одинаковы, т.е. [H+] = [OH-]= 10-7 моль/л, эти величины сопряженные, увеличение одной вызывает уменьшение другой. Следовательно, характер среды можно определять по содержанию одного из этих ионов, поэтому обычно говорят о концентрации только ионов водорода [H+].
При [H+] =10-7 моль/л – среда нейтральная, [H+] = [OH-]
при [H+] >10-7 моль/л – среда кислая, [H+] > [OH-]
при [H+] <10-7 моль/л – среда щелочная, [H+] < [OH-].
Поскольку работать с такими малыми величинами неудобно, с 1909 года пользуются шкалой рН – водородным показателем, где рН = -lg [H+]. Водородный показатель – это еще один способ выражения концентрации ионов водорода.
Прологарифмировав предыдущие выражения, получим:
При рН = 7 – среда нейтральная, при рH > 7 – среда щелочная, при рH <7 – среда кислая.
Величина рН – мера активной кислотности среды, т.е. показывает реальную концентрацию ионов водорода. Она м.б. меньше общей кислотности, которая определяется начальной молярной концентрацией кислоты. Для сильных кислот активная кислотность и общая кислотность совпадают, потому что все молекулы кислоты распались на ионы, т.е. концентрация ионов водорода равна начальной концентрации кислоты. Для слабых кислот – надо учитывать степень диссоциации или константу диссоциации.
 7*.
Внутренние среды организма являются
водными растворами. рН этих растворов
оказывает влияние на жизнедеятельность
клеток и организма в целом, потому что
концентрация ионов водорода влияет на
диссоциацию всех слабых электролитов
в клетках и межклеточной жидкости, а
значит и на концентрацию тех или других
ионов. Ионы водорода участвуют в процессах
окисления-восстановления, катализируют
процессы этерификации и гидролиза, от
них зависит процесс денатурации белков.
Значение рН
внутренних сред организма характеризуются
значительным постоянством и устойчивостью,
и это постоянство является основой
гомеостаза.
Например: рН слюны 6,35-6,85. Если кислотность
слюны повышена – разрушается зубная
эмаль, снижается активность пищеварительных
ферментов. Для нормального пищеварения
в желудке рН желудочного сока должна
быть в норме 1,53-1,67. Повышенная кислотность
(1,48 и меньше) провоцирует гастрит и
язвенную болезнь, пониженная – ухудшает
переваривание пищи, способствует
процессам гниения в желудке и общей
интоксикации организма. Секрет
поджелудочной железы имеет слегка
щелочную среду рН 7,5-8,0. А в тонком
кишечнике она опять падает до 4,0. рН
плазмы крови одна из самых жестких
констант организма, в норме он составляет
7,36. При сдвиге
рН плазмы всего на 0,1 в организме начинают
протекать патологические процессы, а
при сдвиге рН на 0, 2 может развиться
коматозное состояние. Изменение рН
крови меняет свойства белков, является
причиной потери ими биологической
активности. К белкам относятся многие
жизненно важные БАВ, например, ферменты
и гормоны.
7*.
Внутренние среды организма являются
водными растворами. рН этих растворов
оказывает влияние на жизнедеятельность
клеток и организма в целом, потому что
концентрация ионов водорода влияет на
диссоциацию всех слабых электролитов
в клетках и межклеточной жидкости, а
значит и на концентрацию тех или других
ионов. Ионы водорода участвуют в процессах
окисления-восстановления, катализируют
процессы этерификации и гидролиза, от
них зависит процесс денатурации белков.
Значение рН
внутренних сред организма характеризуются
значительным постоянством и устойчивостью,
и это постоянство является основой
гомеостаза.
Например: рН слюны 6,35-6,85. Если кислотность
слюны повышена – разрушается зубная
эмаль, снижается активность пищеварительных
ферментов. Для нормального пищеварения
в желудке рН желудочного сока должна
быть в норме 1,53-1,67. Повышенная кислотность
(1,48 и меньше) провоцирует гастрит и
язвенную болезнь, пониженная – ухудшает
переваривание пищи, способствует
процессам гниения в желудке и общей
интоксикации организма. Секрет
поджелудочной железы имеет слегка
щелочную среду рН 7,5-8,0. А в тонком
кишечнике она опять падает до 4,0. рН
плазмы крови одна из самых жестких
констант организма, в норме он составляет
7,36. При сдвиге
рН плазмы всего на 0,1 в организме начинают
протекать патологические процессы, а
при сдвиге рН на 0, 2 может развиться
коматозное состояние. Изменение рН
крови меняет свойства белков, является
причиной потери ими биологической
активности. К белкам относятся многие
жизненно важные БАВ, например, ферменты
и гормоны.
8. Ясно, что в растворах кислот, где преобладают ионы водорода, среда кислая, а в растворах щелочей ионов гидроксида больше, чем ионов водорода, поэтому там среда щелочная. А какая среда в растворах солей? Вспомните: растворитель взаимодействует с растворенным веществом, между электролитами происходит реакция ионного обмена. Мы знаем, что реакции ионного обмена протекают между любыми электролитами, причем реакции направлены в сторону образования более слабого электролита. Если электролиты обмениваются между собой ионами водорода, то такие реакции называют протолитическими. К ним относятся реакции диссоциации кислот и оснований, реакции нейтрализации между кислотами и основаниями и реакции гидролиза. В общем случае, гидролиз – это реакция вещества с водой, при которой исходное вещество распадается на два новых вещества. Многие биоорганические вещества (белки, полисахариды, жиры, нуклеиновые кислоты) подвергаются гидролизу под действием ферментов. Например, процессы которые протекают при пищеварении. Очень важной для организма является реакция гидролиза АТФ, при которой освобождается энергия, необходимая для различных физиологических процессов.
Гидролиз солей – реакция взаимодействия соли (сильного электролита) с водой (слабым электролитом), это обычная реакция ионного обмена, в результате которого образуются соответствующие кислота и основание (реакция обратная реакции нейтрализации). Среди образовавшихся кислот и оснований могут быть очень слабые электролиты, и тогда реакция гидролиза из возможной становится вполне реальной, реакция среды изменяется.
Рассмотрим все возможные варианты такого взаимодействия:
1) если соль образована сильным основанием и сильной кислотой
NaCl + H2O NaOH + HCl,
Na+ + Cl- + H2O Na+ + OH- + H+ + Cl-,
H2O OH- + H+
гидролиз не проходит, т.к. образуются два сильных электролита, которые опять распадаются на ионы и реакция среды не изменяется, [H+] = [OH-], среда нейтральная.
2) если соль образована сильным основанием и слабой кислотой
Na2CO3 + H2O NaOH + HCO3-
2Na+ + CO32- + H2O 2Na+ + OH + HCO3-
CO32- + H2O OH- + HCO3-,
ион водорода связывается анионом слабой кислоты, образуется слабый электролит и в растворе остается сильное основание, а значит и избыток ОН-, среда щелочная
3) соль образована слабым основанием и сильной кислотой
FeCl3+ H2O FeOH2+ + HCl,
Fe3++ H2O FeOH2+ + H+
ион ОН- связывается катионов слабого основания, в растворе образуется слабый электролит, в остается избыток Н+, среда кислая.
4) соль образована слабым основанием и слабой кислотой
Al2S3 + H2O AlOH2+ + HS- , Гидролиз протекает и по катиону и по аниону, т.к. в растворе не накапливаются ионы H+ или ОН-, среда в них зависит от константы диссоциации слабой кислоты и слабого основания. Если рН раствора при гидролизе практически не изменяется, гидролиз идет до конца и соль разлагается. Т.е. растворы таких солей хранить нельзя.
