
- •Федеральное агентство по образованию
- •Химия неорганическая
- •Содержание
- •Введение
- •План лекции
- •Атомные ядра. Их состав. Изотопы.
- •Планетарная модель строения атома Резерфорда (1911 г).
- •1.3 Двойственная природа электрона.
- •1.4 Квантовые числа.
- •1.5 Многоэлектронные атомы. Квантово-механические законы.
- •1.6 Последовательность заполнения уровней и подуровней.
- •Периоды, группы и подгруппы.
- •Основные типы химической связи.
- •Объяснение ковалентной химической связи в рамках метода валентных связей.
- •Свойства ковалентной связи. Насыщаемость, направленность, поляризуемость.
- •Межмолекулярное взаимодействие.
- •Водородная связь.
- •1. Строение, типы комплексных соединений, номенклатура комплексных соединений.
- •2. Поведение комплексных соединений в растворе.
- •4 Олигомеры и полимеры
- •Цель и задачи термохимии. Тепловые эффекты химических реакций.
- •6.3 Внутренняя энергия, энтальпия, энтропия, потенциал Гиббса.
- •8.2 Способы выражения концентрации растворов.
- •8.4 Закон Рауля. Следствия из закона Рауля.
- •10.1 Классификация коллоидов:
- •10.3 Строение мицеллы гидрофобного коллоида.
- •11.1 Электрохимические процессы
- •11.2 Понятие об электродном потенциале
- •11.3 Стандартный водородный электрод
- •11.4 Гальванический элемент
- •11.5 Ряд стандартных потенциалов металлических электродов (ряд напряжений)
- •Стандартные потенциалы металлических
- •11.6 Уравнение Нернста
- •11.7 Электролиз
- •11. 8 Электролиз расплавов солей
- •11.9 Электролиз водных растворов солей с инертными электродами
- •11.10 Законы Фарадея
- •11.11 Применение электролиза
- •План лекции
- •13.1 Положение p-элементов в пс
- •План лекции
- •План лекции
- •16.1 Предмет аналитической химии. Качественный и количественный анализ. Аналитическая химия- это наука о методах и приемах определения качественного и количественного состава веществ и их смесей.
- •16.2 Аналитический сигнал. Методы анализа в аналитической химии (химические, физические и физико-химические)
- •16.3 Химические методы анализа
- •16.4 Физические методы анализа
- •16.5 Физико-химические методы анализа.
- •Заключение
- •Библиографический список
- •Приложение а
4 Олигомеры и полимеры
Полимерные материалы
Полимеры представляют собой такую разновидность высокомолекулярных соединений (ВМС), при которой молекулы состоят из одинаковых повторяющихся групп атомов – мономерных звеньев, названных структурными единицами. Вот два примера полимеров:
[-CH2−CH-]n [-СH2−CH=C−CH2-]n
| |
CH3 CH3
полипропилен изопреновый каучук
В этих полимерах повторяющееся звено взято в квадратные скобки, количество звеньев обозначено буквой n. На концевых связях макромолекулы полимера находятся OH- и NH2-группы, атомы галогенов, водорода, метильные группы.
Число звеньев n может достигать 30000 и более. Полимеры с числом повторяющихся звеньев от десятков до нескольких сотен называются олигомерами.
Полимерные материалы широко распространены в современном хозяйстве. В числе них есть природные полимеры: шерсть, натуральный шелк, полисахариды. Однако большинство используемых человеком полимерных материалов имеют искусственное происхождение: полиэтилен, каучуки, резина, капрон, фенолформальдегидные смолы и многие другие.
Полимеры подразделяются на линейные, разветвленные и сетчатые. Линейные полимеры представляют собой химически не связанные одиночные цепи мономерных звеньев:
−Х−Х−Х−Х−Х
−Х−Х−Х−
К таким полимерам относятся целлюлоза, найлон. Разветвленные полимеры состоят из линейных молекул, связанных между собой межмолекулярными химическими связями:
|
−X−X−X−X−X− −X−X−X−X−X−
| или | | | | |
−X−X−X−X−X− −X−X−X−X−X−
|
Примером разветвленных полимеров может быть бутадиеновый каучук. Сетчатые полимеры – это трехмерные полимеры, звенья которых образуют единую химически связанную пространственную сетку. В качестве примера сетчатых полимеров можно привести полисахарид гликоген, который является запасающей структурой глюкозы в организме. Другим примером является резина, получающаяся вулканизацией каучука (см. ниже).
В зависимости от элементного состава цепи различают гомоцепные и гетероцепные полимеры. Пример гомоцепных полимеров – полиэтилен
[-CH2−CH2-]n, гетероцепных – полиамиды [-NH−CO−(CH2)x-]n.
Полимеры, содержащие в одной макромолекуле различные типы мономерных звеньев −X1−X2−X3−, называются сополимерами, примером может служить дивинилстирольный каучук.
Получение полимеров
Полимеры получают двумя путями: полимеризацией и поликонденсацией. Полимеризация – это процесс образования молекулы полимера, при котором мономеры взаимодействуют друг с другом с образованием новых химических связей. Такой реакцией, например, является образование полиэтилена:

Для того, чтобы процесс полимеризации начался, чтобы «активировать» молекулы мономеров, на реакционную массу оказывают внешнее воздействие, генерирующее свободные радикалы, которые и запускают процесс. Этим воздействием может быть электромагнитное (световое, лазерное, высокочастотное) излучение или введение специальных веществ – генераторов свободных радикалов, например, перекисных соединений R-O-O-R. Точками . на схеме полимеризации показаны неспаренные электроны.
Поликонденсация – это такой процесс образования молекулы полимера, при котором в ходе реакции выделяются низкомолекулярные продукты (H2O, NH3, HCl и т.п.). Примером такой реакции может служить получение капрона:
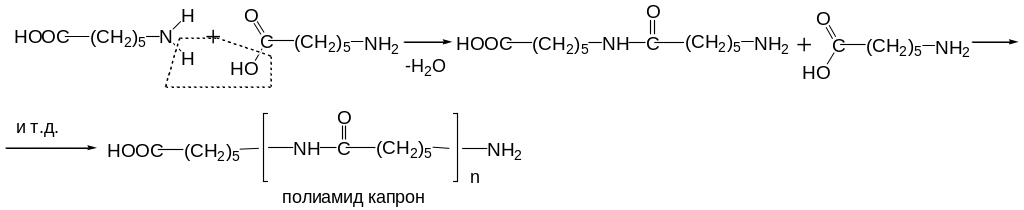 В
отличие от полимеризации, поликонденсация
обычно не является радикальным процессом,
поэтому в реакционную смесь доноры
радикалов не вводятся.
В
отличие от полимеризации, поликонденсация
обычно не является радикальным процессом,
поэтому в реакционную смесь доноры
радикалов не вводятся.
Несмотря на повышенную по сравнению с мономерами химическую стойкость, полимеры могут постепенно разрушаться (деградировать) под действием окислительной среды, термического воздействия и светового излучения. Чтобы предотвратить или замедлить процесс разрушения полимеров, к ним добавляют специальные вещества – стабилизаторы, которые захватывают (реагируют) активные частицы, образовавшиеся в результате внешнего воздействия. В результате химическая структура полимера остается незатронутой, что сохраняет его эксплуатационные характеристики.
Лекция 6. Энергетика и направленность химических процессов (2часа).
План лекции
Цель и задачи термохимии. Тепловые эффекты химических реакций.
Термохимическая система. Независимые параметры системы. Функция состояния системы.
Внутренняя энергия, энтальпия, энтропия, потенциал Гиббса.
Законы термохимии. Термохимические расчеты.
Направление протекания химической реакции.
