
- •Вариант 4
- •Тема 1:Растворы и их роль в жизнедеятельности
- •Тема 2:Буферные системы и их роль в организме человека
- •Тема 3:Химическая термодинамика и её применение к биосистемам
- •Тема 4:Химическая кинетика и её значение для изучения скоростей и механизмов биохимических процессов
- •Тема 5: Химические свойства и биологическая роль биогенных элементов
- •Тема 6: Классификация, номенклатура органических соединений. Общие закономерности реакционной способности органических соединений
- •Тема 7: Карбоновые кислоты и их функциональные производные.
- •Тема 8: Аминокислоты, пептиды, белки
- •Задача №1
- •Тема 9: Углеводы: моносахариды, ди- и полисахариды
- •Задача №2
- •Тема 10: Биологически активные гетероциклы. Нуклеиновые кислоты.
- •Задача №2
- •Тема 11:Растворы вмс. Свойства биополимеров
Тема 4:Химическая кинетика и её значение для изучения скоростей и механизмов биохимических процессов
Дайте краткий ответ на теоретические вопросы:
1. Принцип Ле-Шателье.
Направление смещения равновесия определяется правилом Ле-Шателье, согласно которому если на систему, находящуюся в равновесии, оказать внешнее воздействие, то в системе возникнет противодействие. Это значит, что до установления нового равновесия получает большую скорость та реакция, которая уменьшает внешнее воздействие и, таким образом, равновесие смещается в сторону образования продуктов этой реакции.
2. Зависимость энергии Гиббса и константы равновесия от температуры.
Уравнение изотермы связывает энергию Гиббса и константу равновесия (при T = const):
 ,
,
Уравнение изотермы позволяет прогнозировать изменение константы скорости реакции и соответственно смещение равновесия при изменении концентрации какого-либо вещества или температуры. Из уравнения изотермы можно сделать вывод: если К>1 (ΔG<0) идет прямая реакция, K<1 (ΔG>0) идет обратная реакция, в случае K=1 (ΔG=0) имеет место равновесие
Решите задачи:
Задача 1:
При
синтезе аммиака
 равновесие установилось при следующих
концентрациях реагирующих веществ:
равновесие установилось при следующих
концентрациях реагирующих веществ:
 =4
моль/л,
=4
моль/л,
 =2
моль/л,
=2
моль/л,
 =6
моль/л. Рассчитайте константу равновесия
этой реакции и исходные концентрации
азота и водорода.
=6
моль/л. Рассчитайте константу равновесия
этой реакции и исходные концентрации
азота и водорода.
Решение:
Константа равновесия этой реакции равна:

Исходные
концентрации азота и водорода находим
на основе уравнения реакции. На образование
двух молей NH3
расходуется один моль N2,
а на образование шести молей аммиака
потребовалось: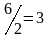 моль азота. Учитывая равновесную
концентрацию азота, находим его
первоначальную концентрацию:
моль азота. Учитывая равновесную
концентрацию азота, находим его
первоначальную концентрацию:
 моль/л
моль/л
На
образование двух молей NH3
необходимо израсходовать 3 моль водорода,
а для получения шести молей NH3
требуется водорода:
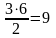 моль:
моль:
 моль/л
моль/л
Таким образом, реакция начиналась при =7 моль/л; = 11 моль/л
Ответ: К=1,1; =7 моль/л; = 11 моль/л
Задача №2
В лаборатории имеются растворы: 3% раствор H2O2 и концентрированный раствор Fe2(SO4)3, а также MnO2. Используя эти реактивы осуществить гомогенный и гетерогенный катализ реакции разложения H2O2.
Вопросы:
1.Что такое катализатор?
Это вещество, которое, не смещая равновесия химической реакции, увеличивает ее скорость, оставаясь в конце реакции химически неизменным
2. Почему в присутствии катализаторов изменяется скорость реакции?
Катализаторы снижают энергию активации, поэтому в их присутствии реакции протекают быстрее.
3. В чем заключается отличие гомогенного катализа от гетерогенного?
Гомогенный катализ наблюдается тогда, когда катализатор и реагирующие вещества находятся в одном и том том же агрегатном состоянии –жидком или газообразном.Гомогенные реакции характеризуются отсутствиемповерхности раздела между реагентами, поэтому ихвзаимодействие протекает по всему объему системы.Гетерогенные реакции характеризуются наличиемповерхности раздела между реагентами, где и протекает ихвзаимодействие.Гетерогеный катализ наблюдается тогда когда реагирующие вещества находятся в одном , а катализатор в другом агрегатном состоянии. Чаще катализатор бывает твердым, а реагирующие вещества жидкими или газообразными.
4.Какой катализатор Вы выберете для гомогенного катализа разложения H2O2?
Так как 3% раствор H2O2 – жидкость, то для гомогенного катализа следует выбрать концентрированный раствор FeCl3.
5.Какой катализатор Вы выберете для гетерогенного катализа разложения H2O2?
MnO2т.к он в твердом состоянии
.
Ответьте на тесты:
1. Повышение температуры смещает равновесие и сторону реакции
прямой
обратной
экзотермической
эндотермической
с меньшей константой скорости
Ответ: 4
2. Понижение температуры смещает равновесие и сторону реакции
прямой
обратной
экзотермической
экзотермической
с меньшей константой скорости
Ответ:4
3. Повышение давления смещает равновесие в сторону реакции
прямой
обратной
экзотермической
с образованием большего количества газообразных продуктов
с образованием меньшего количества газообразных продуктов
Ответ: 5
4. Понижение давления смещает равновесие и сторону реакции
прямой
обратной
эндотермической
с образованием большего количества газообразных продуктов
с образованием меньшего количества газообразных продуктов
Ответ:4
Занятие №5
