
- •Вариант 4
- •Тема 1:Растворы и их роль в жизнедеятельности
- •Тема 2:Буферные системы и их роль в организме человека
- •Тема 3:Химическая термодинамика и её применение к биосистемам
- •Тема 4:Химическая кинетика и её значение для изучения скоростей и механизмов биохимических процессов
- •Тема 5: Химические свойства и биологическая роль биогенных элементов
- •Тема 6: Классификация, номенклатура органических соединений. Общие закономерности реакционной способности органических соединений
- •Тема 7: Карбоновые кислоты и их функциональные производные.
- •Тема 8: Аминокислоты, пептиды, белки
- •Задача №1
- •Тема 9: Углеводы: моносахариды, ди- и полисахариды
- •Задача №2
- •Тема 10: Биологически активные гетероциклы. Нуклеиновые кислоты.
- •Задача №2
- •Тема 11:Растворы вмс. Свойства биополимеров
Тема 3:Химическая термодинамика и её применение к биосистемам
Дайте краткий ответ на теоретические вопросы:
1.Закон Гесса. Расчеты изменения стандартных энтальпий химических реакций и физико-химических превращений на основе закона Гесса
Закон Гесса:Тепловой эффект химической реакции определяется лишь начальным и конечным состояниями системы реагирующих веществ и не зависит от пути ее протекания .Изменениеэнтальпии в процессе химической реакции при образовании вещества, при его сгорании обозначается соответственно: ∆Hр ; ∆Hобр; ∆Hсгор; символ ∆H2980 означает изменение энтальпии одного моля вещества в стандартных условиях Т=298К, р= 101.325 кПа – этот показатель называется стандартной энтальпией .
2.Основные понятия химической термодинамики.
Химическая термодинамика-наука, изучающая превращение различных видов энергии в химических реакциях, проц. растворения, испарения и кристаллизации, свойственных, с переходом энергии в форме теплоты и работы(А).Термодинамическая система – любой реальный объект, выделяемый для изучения процессов обмена веществом и энергией между составляющей его частями, а также между ним и окружающей средой с помощью термодинамических методов. Например - человек.Окружающая среда – остальная часть пространства с его материальными соединениями, находящихся в прямом или косвенном контакте с термодинамической системой.
Решите задачи:
Задача 1
Рассчитаете
ΔGреакции
 ,
если
,
если
 ,
а
,
а
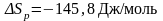 .
Возможна ли эта реакция в стандартных
условиях?
.
Возможна ли эта реакция в стандартных
условиях?
Решение:
Используем уравнение Гиббса:
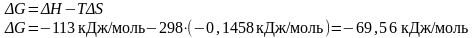
Ответ: ΔG<0, реакция идет в прямом направлении
Инспектор ГИБДД остановил водителя и по его внешнему виду заподозрил, что тот находится в состоянии алкогольного опьянения. Анализ, проведенный в токсикологической клинике, показал, что содержание этилового спирта в крови водителя превышает допустимую норму. Однако водитель утверждает, что алкогольных напитков не употреблял в течение нескольких дней. Установлено, что при выполнении профессиональных обязанностей ему приходится много времени проводить в условиях повышенной концентрации выхлопных газов и в его организме спирт мог образоваться из CO2 и H2O.
Вопросы:
1. Как выглядит уравнение образования C2H5OH из CO2 и H2O?
2CO2+ 3H2O = C2H5OH + 3O2.
2.Что является критерием направления самопроизвольного протекания процесса?
Критериемнаправленияпротекания реакции является энергия Гиббса (при постоянной температуре и давлении).
3.Что называется стандартной энергией Гиббса образования вещества?
Стандартной энергией Гиббса образования вещества называется энергия Гиббса образования 1 моля вещества при стандартных условиях из простых веществ.
4.По какой формуле можно рассчитать G0реакции, если:
G0обр(C2H5OH) = 175 кДж/моль;
G0обр(H2O) = 237 кДж/моль;
G0обр(CO2) = 394 кДж/моль.
G0реакции=G0обр.(C2H5OH) - 2G0обр. (CO2) - 3G0обр. (H2O) =
= 175 – 2( -394) – 3( - 237)= + 1674 кДж.
5.Может ли происходить в организме человека самопроизвольное образование C2H5OH из CO2 и H2O?
Так как G0реакции> 0, то по этой реакции спирт в организме самопроизвольно образовываться не может.
Ответьте на тесты:
1. В реакциях разложения энтропия термодинамической системы
уменьшается
не изменяется
увеличивается
ускоряется
флуктуирует
Ответ: 3
2. Реакции, при протекании которых происходит увеличение энергии Гиббса системы, называются
эндэргоническими
экзэргоническими
гомогенными
гетерогенными
окислительно-восстановительными
Ответ: 2
3. Если при протекании химической реакции поглощается теплота, то это реакция
обмена
окислительно-восстановительная
замещения
эндотермическая
экзотермическая
Ответ: 4
4. Человека, с точки зрения термодинамики, можно отнести к системе
Изолированной
Открытой
Закрытой
Проницаемой
Приоткрытой
Ответ: 2
Занятие №4
