
FTF 4 semestr / 22
.docxХимические свойства спиртов
Химические свойства спиртов определяются наличием в них гидроксильной группы. Поскольку гидроксильная группа является полярной, она может гетеролитически диссоциировать, особенно, под действием сильных оснований. Таким образом, спирты проявляют свойства слабых кислот. Кроме того, высокая электроотрицательность кислорода обуславливает наличиеэлектрофильного атома углерода и, соответственно, способность спиртов подвергаться реакциям нуклеофильного замещения под действием ряда нуклеофилов. Наконец, атом кислорода гидроксильной группы имеет нуклеофильный характер, поэтому спирты могут выступать нуклеофилами в реакциях замещения и присоединения. Также для спиртов характерны реакцииокисления.
Диссоциация и кислотно-основные свойства спиртов
Кислотные свойства спиртов
Спирты способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты диссоциируют по связи O–H с образованием алкоксид-иона. Кислотные характеристики спиртов оценивают по константе кислотности Ka.
![]()
![]()
![]() В
водном растворе кислотность спиртов
снижается с увеличением молекулярной
массы и разветвлённости углеводородной
цепи. Это связывают с увеличением
положительного индуктивного
эффекта алкильных
заместителей в данном ряду и уменьшением
устойчивости образующегося алкоксид-иона
за счёт локализации отрицательного
заряда на атоме кислорода[88].
В целом, электроноакцепторные заместители
(–NO2,
–CN, –F, –Cl, –Br, –I, –OR и др.) увеличивают
кислотность спиртов (уменьшают pKa).
Напротив, электронодонорные заместители
(например, алкильные заместители)
уменьшают кислотность спиртов
(увеличивают pKa).
Так, pKa 2,2,2-трифторэтанола имеет
значение 12,43 (против 15,9 у этанола), а
полностью фторированного трет-бутанола —
5,4 (против 17,7 у трет-бутанола)[89].
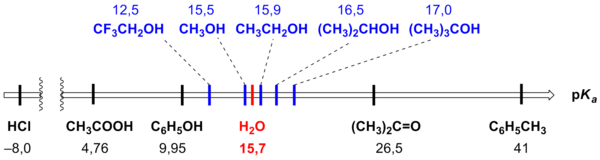
Сравнительная кислотность спиртов и
соединений других классов схематически
представлена на рисунке[90].
В
водном растворе кислотность спиртов
снижается с увеличением молекулярной
массы и разветвлённости углеводородной
цепи. Это связывают с увеличением
положительного индуктивного
эффекта алкильных
заместителей в данном ряду и уменьшением
устойчивости образующегося алкоксид-иона
за счёт локализации отрицательного
заряда на атоме кислорода[88].
В целом, электроноакцепторные заместители
(–NO2,
–CN, –F, –Cl, –Br, –I, –OR и др.) увеличивают
кислотность спиртов (уменьшают pKa).
Напротив, электронодонорные заместители
(например, алкильные заместители)
уменьшают кислотность спиртов
(увеличивают pKa).
Так, pKa 2,2,2-трифторэтанола имеет
значение 12,43 (против 15,9 у этанола), а
полностью фторированного трет-бутанола —
5,4 (против 17,7 у трет-бутанола)[89].
Сравнительная кислотность спиртов и
соединений других классов схематически
представлена на рисунке[90].
Как слабые кислоты, спирты вступают в реакции с щелочными, щелочноземельными и некоторыми другими металлами, и с сильными основаниями, например, гидридами или амидамиметаллов, реактивами Гриньяра[91].

Осно́вные свойства спиртов
Спирты могут также вести себя как слабые основания Льюиса, образовывая с сильными минеральными кислотами соли алкоксония, а также давая донорно-акцепторные комплексы скислотами Льюиса. Обычно подобные реакции не останавливаются на указанной стадии и ведут к нуклеофильному замещению гидроксильной группы или отщеплению воды.
![]()
![]() Количественно
основность спиртов оценивают по константе
основности pKb или
связанной с ней константе
кислотности сопряжённой
кислоты pKaH+:
Количественно
основность спиртов оценивают по константе
основности pKb или
связанной с ней константе
кислотности сопряжённой
кислоты pKaH+:
![]()
![]()
![]() Спирты
являются слабыми основаниями, и их
основность возрастает с увеличением
длины или разветвлённости углеводородного
радикала при гидроксильной группе.
Данный эффект наблюдается из-за роста
положительного индуктивного эффекта
радикала в данном ряду, за счёт которого
увеличивается отрицательный заряд на
атоме кислорода гидроксильной группы[92].
Спирты
являются слабыми основаниями, и их
основность возрастает с увеличением
длины или разветвлённости углеводородного
радикала при гидроксильной группе.
Данный эффект наблюдается из-за роста
положительного индуктивного эффекта
радикала в данном ряду, за счёт которого
увеличивается отрицательный заряд на
атоме кислорода гидроксильной группы[92].
Нуклеофильное замещение
Основная статья: Реакции нуклеофильного замещения
Атом углерода, непосредственно соединённый с гидроксильной группой, имеет частичный положительный заряд, что делает возможной атаку нуклеофильной частицы (галогенид-иона,аммиака, спирта и др.) по этому атому углерода с замещением гидроксильной группы на эту частицу. Гидроксильная группа является плохой уходящей группой, поэтому обычно необходима её дополнительная активация.
-
Реакции нуклеофильного замещения в спиртах легче протекают в кислой среде, поскольку гидроксильная группа спирта протонируется, и фактической уходящей частицей является негидроксид-ион OH−, а молекула воды H2O. Кислотными свойствами может обладать сам реагент (часто используют галогеноводородные кислоты), так и специально добавленная неорганическая кислота, например, серная кислота[93].

-
Замещение гидроксильной группы также протекает под действием галогенидов серы и фосфора (SOCl2, PBr3, PBr5, POCl3 и др.). В данном случае ключевую роль выполняет соединение серы или фосфора, образующее активированный интермедиат с молекулой спирта[94].

-
Гидроксильную группу также превращают в сульфонатную группу, которая является хорошей уходящей группой. Для этих целей спирт сначала превращают в сульфонат, который затем подвергают реакции нуклеофильного замещения. В качестве реагентов для модификации гидроксильной группы обычно используют метансульфонилхлорид или п-толуолсульфонилхлорид (англ.)русск.[95].

Дегидратация
В присутствии кислотных катализаторов (оксид алюминия, серная кислота, фосфорная кислота и др.) спирты могут подвергаться дегидратации с образованием алкенов. Например, дегидратация этилового спирта приводит к образованию этилена. Реакция протекает в соответствии с правилом Зайцева, согласно которому при дегидратации образуется более устойчивый, более замещённый при двойной связи алкен[96].

Окисление
См. также: Реакции окисления спиртов
-
Под действием различных окислителей первичные спирты окисляются до альдегидов и далее — до карбоновых кислот, причём остановить реакцию на стадии образования альдегидов, предотвратив их дальнейшее окисление удаётся только за счёт использования специальных реагентов (хлорхромата пиридиния PCC и дихромата пиридиния PDC).
-
Вторичные спирты окисляются до кетонов. Реакцию обычно проводят под действием реагента Джонса (CrO3—серная кислота). Дальнейшее окисление кетонов протекает только в жёстких условиях с разрушением углеродного скелета.
-
Третичные спирты окисляются только в весьма жёстких условиях с разрушением углеродного скелета[97].
