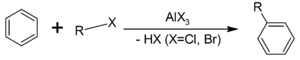FTF 4 semestr / 19
.docxДля ароматических систем фактически существует один механизм электрофильного замещения — SEAr. Механизм SE1 (по аналогии с механизмом SN1) — встречается крайне редко, а SE2(соответствующий по аналогии SN2) — не встречается вовсе[1].
Реакции SEAr[править | править исходный текст]
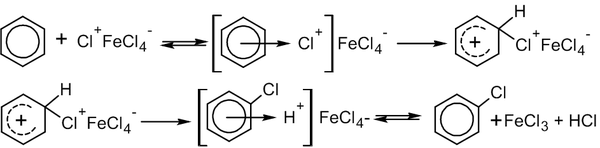
Механизм реакции SEAr или реакции ароматического электрофильного замещения (англ. Electrophilic aromatic substitution) является самым распространенным и наиболее важным среди реакций замещения ароматических соединений и состоит из двух стадий. На первом этапе происходит присоединение электрофила, на втором — отщепление электрофуга:

В ходе реакции образуется промежуточный положительно заряженный интермедиат (на рисунке — 2b). Он носит название интермедиат Уэланда, арониевый ион или σ-комплекс. Этот комплекс, как правило, очень реакционноспособен и легко стабилизируется, быстро отщепляя катион.
Лимитирующей стадией в подавляющем большинстве реакций SEAr является первый этап.
Скорость реакции SEAr обычно представляется в следующем виде[2]:
|
Скорость реакции = k*[ArX]*[E+] |
В качестве атакующей частицы обычно выступают относительно слабые электрофилы, поэтому в большинстве случаев реакция SEAr протекает под действием катализатора — кислоты Льюиса. Чаще других используются AlCl3, FeCl3, FeBr3, ZnCl2.
В этом случае механизм реакции выглядит следующим образом (на примере хлорирования бензола, катализатор FeCl3)[3]:
1.На первом этапе катализатор взаимодействует с атакующей частицей с образованием активного электрофильного агента:
![]()
2. На втором этапе, собственно, и реализуется механизм SEAr:
Типовые реакции ароматического электрофильного замещения[править | править исходный текст]
1. Нитрование ароматических систем азотной кислотой в присутствии серной кислоты с получением нитросоединений:
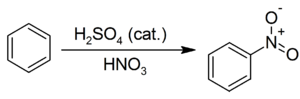
Образование активной частицы[2]:
![]()
|
Скорость реакции = k*[ArH]*[NO2+] |
2. Сульфирование бензола с получением сульфокислоты:
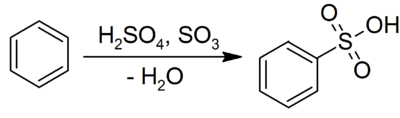
Активной частицей в реакции является SO3.
3. Галогенирование бензола бромом, хлором или йодом приводит к образованию арилгалогенидов. Катализатором реакции выступает галогенид железа (III):
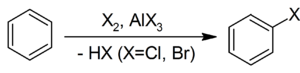
Образование активной частицы[2]:
![]()
|
Скорость реакции = k*[ArH]*[X2]*[FeX3] |
4. Реакция Фриделя-Крафтса — ацилирование или алкилирование с использованием ацил- или алкилгалогенидов. Типичным катализатором реакции служит хлорид алюминия, но может использоваться любая другая сильная кислота Льюиса.