FTF 4 semestr / 3
.docxЭлектронная природа химических связей в органических соединениях.
|
Электронная природа химических связей в органических соединениях 1. Все органические вещества содержат углерод. В молекулах органических веществ углерод переходит в возбуждённое состояние:
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия, чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь. Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии выделяемой при образовании: σ(s – s) < σ(s – p) < σ (p – p)
б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10-9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше: (С – С) < (C = C) < (C ≡ C)
в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона: 1 электрон на s – орбитали сферической формы 3 электрона на трёх p – орбиталях, орбитали имеют форму гантели и расположены под углом 90˚.
рис. Атом углерода в возбуждённом состоянии (s1px1py1pz1)
Таким образом можно предположить, что в молекуле метана CH4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`. В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp3, sp2, sp.
sp3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи. Объяснение
рис. Строение молекулы метана СН4 (тетраэдрическое) sp2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи. Объяснение
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании П - связи.
рис. Строение молекулы этилена С2Н4 (плоское тригональное)
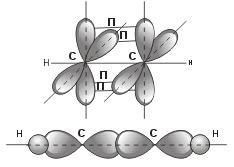
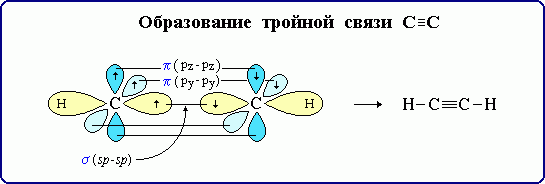
sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи. Объяснение
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две П - связи.
рис. Строение молекулы ацетилена С2Н2 (линейное)
Направленность гибридных орбиталей в пространстве, а следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
СТЕПЕНЬ ОКИСЛЕНИЯ АТОМА УГЛЕРОДА
Для атома углерода в органических соединениях характерны степени окисления от -4 до +4.
Пример №1. С-4H4
C-3H3 – C-3H3
C-2H2=C-2H2
C-1H ≡ C –1H
Пример №2. Укажите степени окисления всех элементов в CH3CH2OH
Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН3 –) . Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3. Атом С в составе группы -СН2ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С-3H+13C-1H+12O-2H+1.
Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления и лёгкость гибридизации позволяет атому углерода образовывать одинарные, и кратные (двойные и тройные связи) не только с другими атомами углерода, но и с атомами других элементов-органогенов: СН3 – СН3 (1 σ – сигма связь С-С) CH2=CH2 (1 σ – сигма связь С-С и 1 П – пи связь С-С) CH ≡ CH (1 σ – сигма связь С-С и 2 П – пи связи С-С) |