
FTF 4 semestr / 3 - типы химических связей
.pdf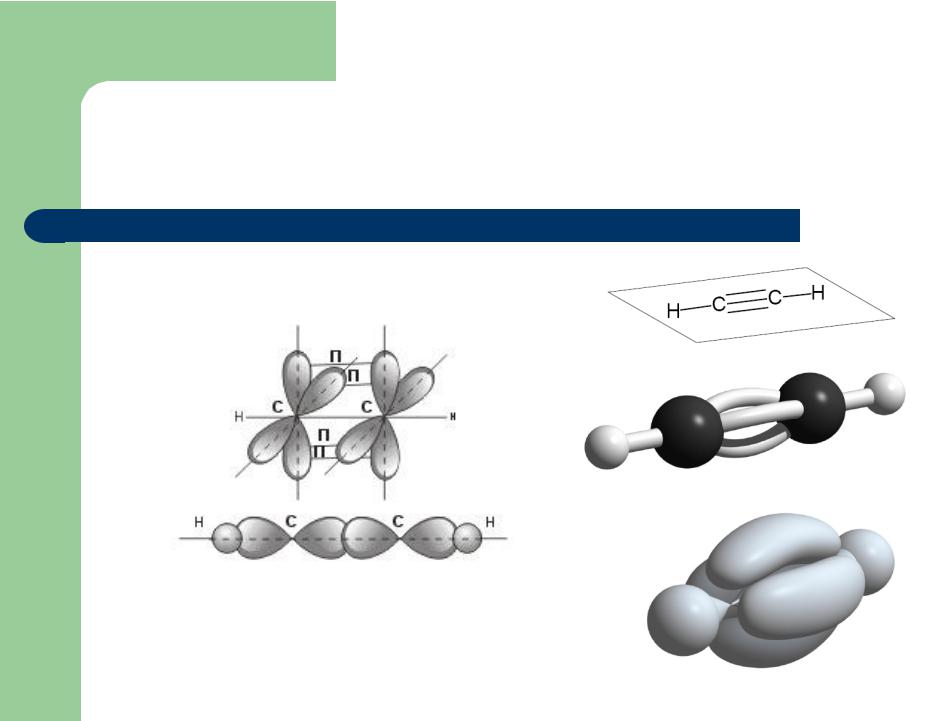
T Vasilieva
Строение молекулы ацетилена С2Н2
http://rsmu.ru

T Vasilieva
Характеристики некоторых ковалентных связей
http://rsmu.ru

T Vasilieva
Выводы
1)Длина связи с участием атома углерода зависит от его гибридизации: при увеличении кратности связи ее длина уменьшается
2)Энергия связи уменьшается с увеличением вклада s-орбиталей в гибридизованное состояние:
sp3 (25% s-АО) > sp2 (33,3% s-АО) > sp (50% s-АО)
3)Чем длиннее связь, тем меньше ее энергия (т.е. связь слабее)

T Vasilieva
Методы описания химической связи
1) Метод молекулярных орбиталей (МО)
Вариант: МО ЛКАО (молекулярная орбиталь-
линейная комбинация атомных орбиталей)
Р. Малликен (1966)
Ψ = С1ψ1 + С2ψ2 + … + Сnψn
zМетод резонансных структур (метод
резонанса, РС) К. Ингольд (1922), Л. Полинг (1928)

T Vasilieva
Применение методов МО и РС
•Описание делокализованных связей
•Определение относительной стабильности промежуточных частиц
•Прогнозирование реакционной способности органических соединений

T Vasilieva
Метод молекулярных орбиталей

T Vasilieva
Молекулярные орбитали
Е |
_ |
|
|
|
|
|
|
|
|
|
|
|
|ψ+|2 = | ψA + ψB |2 = ψA2 + 2ψAψB + ψB2 |
||||||||||||||
|
|
|
ψ |
= ψA - ψB |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
_ 2 |
|
- ψ |
|
| |
2 |
= ψ |
2 |
- 2ψ ψ |
+ ψ |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|ψ | = | ψ |
A |
B |
|
A |
B |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A B |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ψB |
|
|
|
|
|
|
|
|
|
|
|
ψA |
|
|
|
|
|
|
|
|
|
|
|
SAB = ∫ψAψBdV интеграл перекрывания |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
βAB = C∫AB(IA + IB) |
резонансный интеграл |
||||||||||||
|
|
|
ψ+ = ψA + ψB |
|
|
|
|||||||||||||||||||||
T Vasilieva
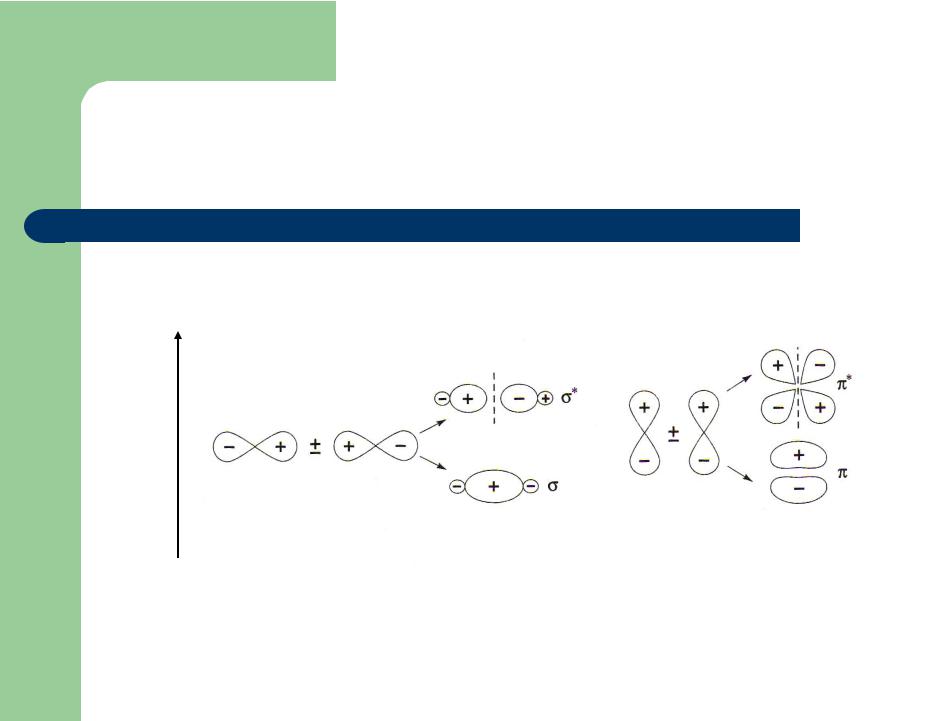
Образование МО при перекрывании р-АО
Е
Образование σ-МО |
Образование π-МО |

T Vasilieva
Энергетическая диаграмма образования молекулярных орбиталей метана

T Vasilieva
Электронные
эффекты
