
FTF 4 semestr / 3 - типы химических связей
.pdf
T Vasilieva
Химическая связь в органических соединениях
Лекция 2

T Vasilieva
Определение
Химическая связь – совокупность
взаимодействий между электронами и ядрами, приводящих к соединению атомов в молекулу
Уравнение Шредингера
2ψ +8π2 m / h2 (E − Ep )ψ = 0
2 - оператор Лапласа
Ψ- волновая функция электрона
h - постоянная Планка
Е- полная энергия системы
Ер - потенциальная энергия
T Vasilieva
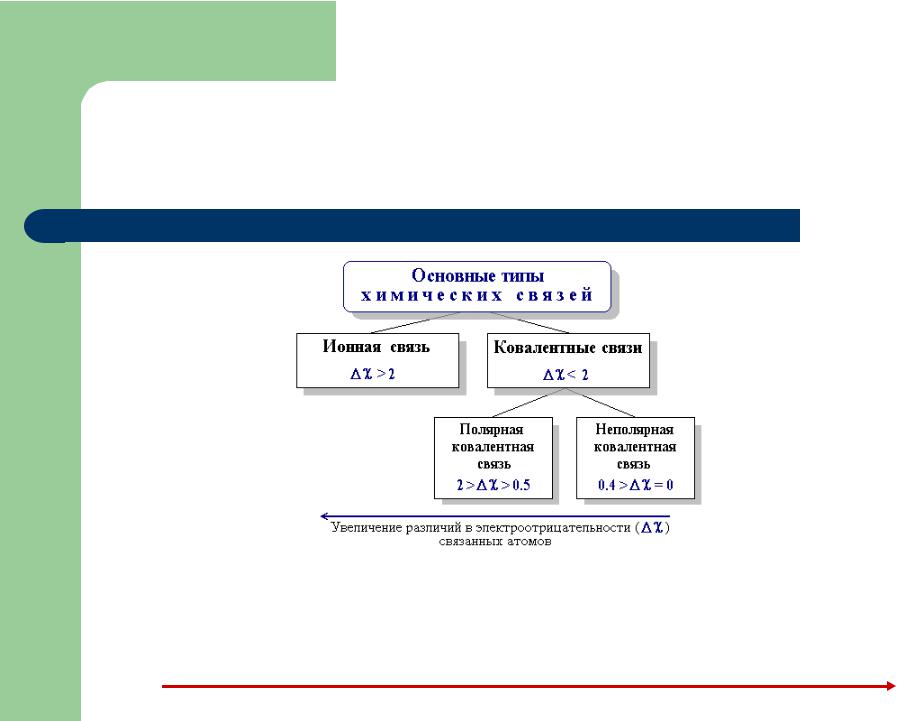
Основные типы химических связей
Относительная электроотрицательность элементов по Л. Полингу
Элемент |
K |
Li |
Na |
Mg |
H |
Se |
C |
S |
Br |
N |
Cl |
O |
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ОЭО |
0,8 |
0,95 |
1,0 |
1,2 |
2,1 |
2,4 |
2,5 |
2,58 |
2,8 |
3,05 |
3,16 |
3,5 |
3,98 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рост электроотрицательности |
http:// www.chemistry.ssu.samara.ru |
T Vasilieva
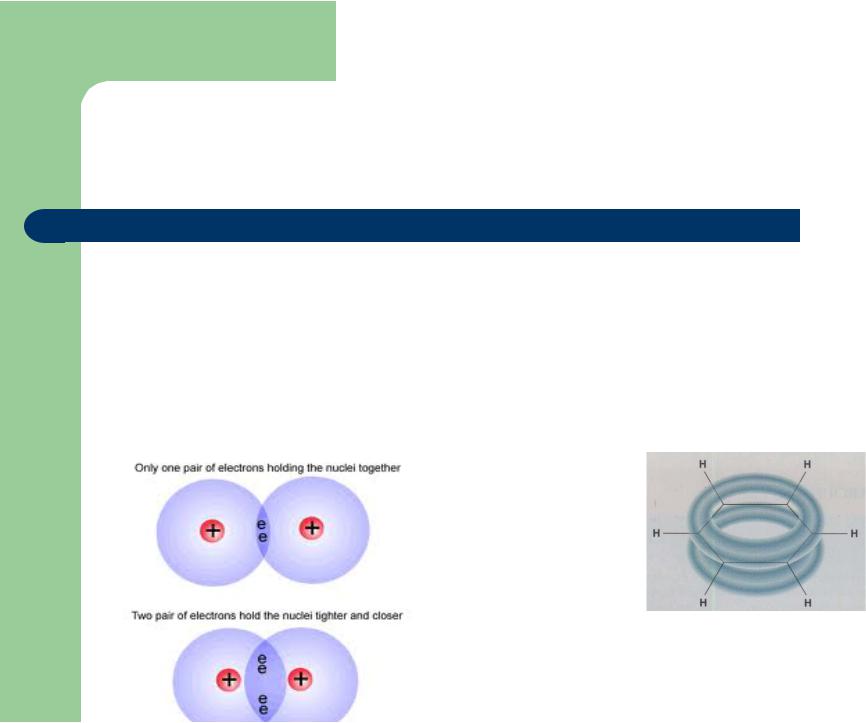
Для органических соединений характерны ковалентные связи
|
Ковалентная |
|
Ковалентная |
|
локализованная связь |
|
делокализованная связь |
||
|
|
|
|
|
|
|
|
|
|
электроны поделены между |
молекулярные орбитали, |
ядрами двух атомов |
охватывают более двух атомов |
|
|

T Vasilieva
Ковалентная
локализованная
связь
T Vasilieva
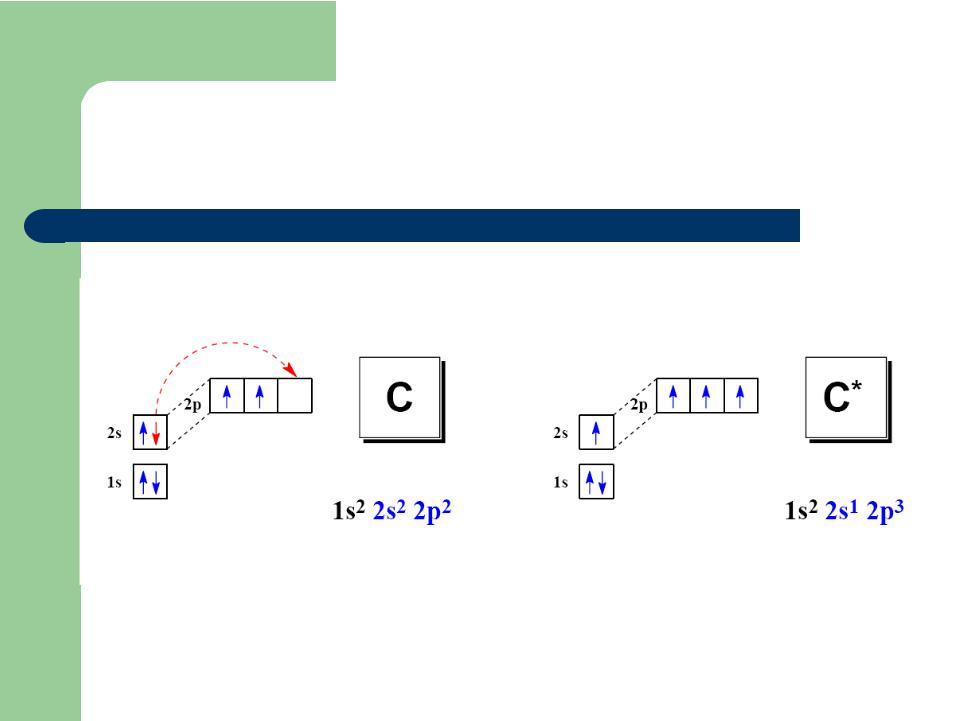
Электронная структура углерода
http://rsmu.ru

T Vasilieva
Характеристики ковалентной связи
1)Длина связи – расстояние между центрами связанных атомов
2)Валентный угол – угол между двумя связями, имеющими общий атом
3)Ковалентный радиус – половина длины ковалентной связи между атомами
4)Энергия связи – энергия, выделяющаяся при образовании химической связи и характеризующая ее прочность
(200-1000 кДж/моль)
5) Энергия диссоциации – энергия, необходимая для гомолитического расщепления отдельной связи в молекуле (для двухатомных молекул равна энергии связи)
Гомолитическое расщепление: |
А В |
Разъединение пары электронов, |
осуществляющих ковалентную связь |
T Vasilieva
Свойства ковалентной связи
1) Направленность: связь атомов осуществляется в том
направлении, в котором обеспечивается максимальное перекрывание орбиталей
2) Насыщаемость: способность атомов образовывать ограниченное число ковалентных связей
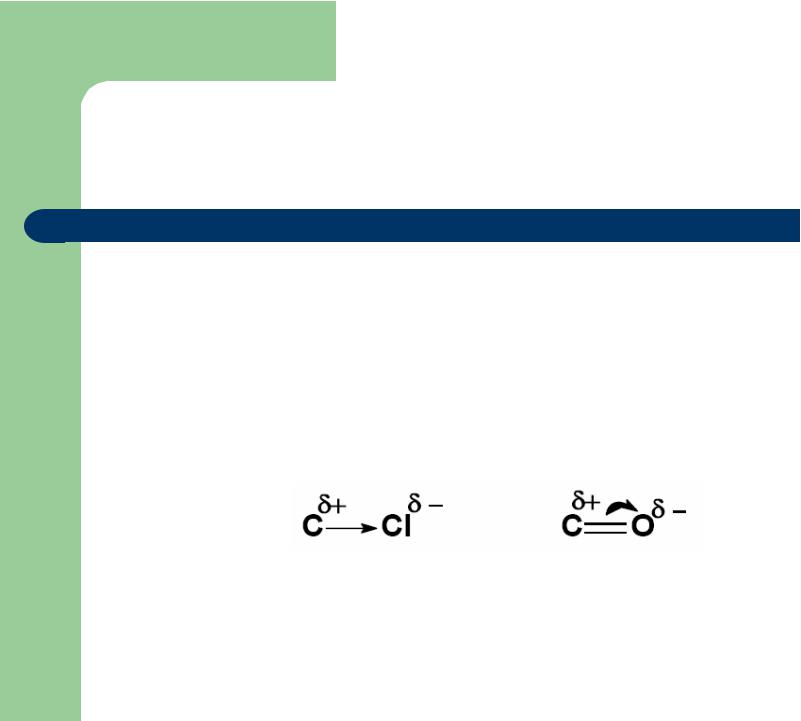
3) Полярность: результат неравномерного распределения электронной плотности
4) Дипольный момент связи (μ): векторная величина,
характеризующая полярность связи
μ [D, Кл·м]
1D = 3,4·10-30 Кл·м
T Vasilieva
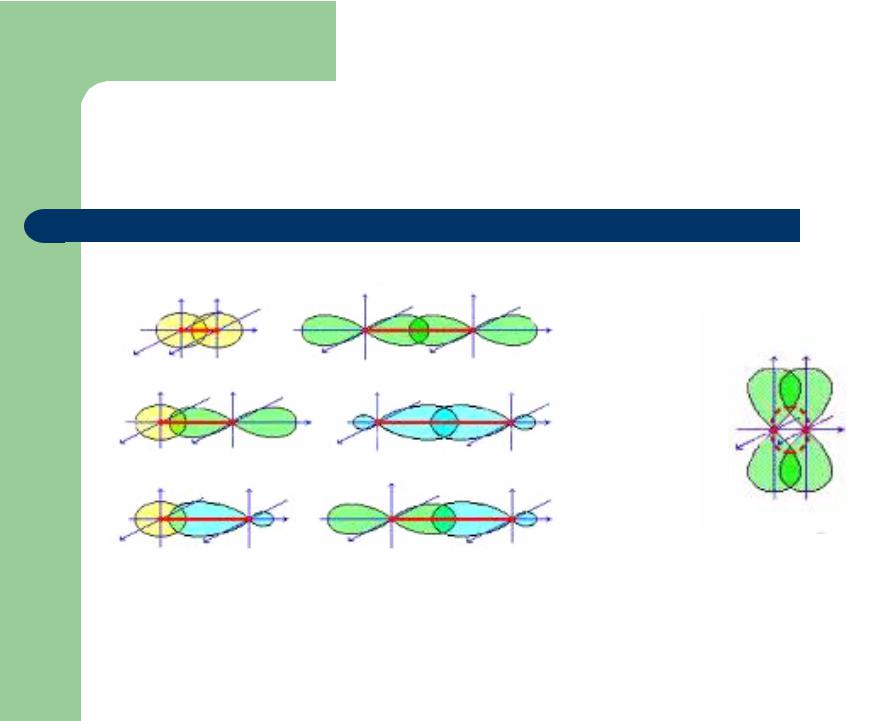
Направленность ковалентной связи: σ- и π-связи
σ-связь |
π-связь |
Одинарная ковалентная связь, образованная при перекрывании АО по прямой, соединяющей ядра двух связываемых атомов с максимальным перекрыванием на этой прямой
Связь, образованная при боковом перекрывании негибридизованных р-АО с максимальным перекрытием над и под плоскостью σ-связей
http:// www.chemistry.ssu.samara.ru

T Vasilieva
Характерные особенности σ- и π- связей
zσ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при
образовании σ-МО и нахождением σ-электронов между ядрами.
zПо σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое
вращение без разрыва связи. Вращение по двойной (σ + π) связи невозможно без разрыва π-связи!
zЭлектроны на π-МО, находясь вне межъядерного
пространства, обладают большей подвижностью по
сравнению с σ-электронами. Поэтому
поляризуемость π-связи значительно выше, чем σ-
связи.
