
FTF 4 semestr / дополнение к 13 вопросу на 14й странице (см концевые тройные связи)
.pdf
АЛКИНЫ (Ацетиленовыми углеводородами)
Алки́ны (иначе ацетиленовые углеводороды) —
углеводороды, содержащие тройную связь между атомами углерода. Атомы углерода при тройной связи находятся в
состоянии sp-гибридизации. Общая формула CnHn-2

Строение
Угол С-С равен 180 °С. Структура линейная.
Энергия тройной связи 814 кДж/моль

По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
Гомологический ряд |
Структурные изомеры |
|
Ацетилен (Этин) HC≡CH
Метилацетилен (Пропин) CH3–C ≡ CH
Этилацетилен (Бутин-1) C2H5–C ≡ CH
Бутин-2 CH3–C ≡ C–CH3
Пентин-1 CH3–CH2–CH2–C ≡ CH
Пентин-2 CH3–CH2–C ≡ C–CH3
4-метилгексин-2
4-метилгексин-1
гептин-2
Межклассовая изомерия с алкадиенами и циклоалкенами, начиная с С4Н6:

Физические свойства
По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины C2—C4 представляют собой газы, С5—C16 — жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
Чистый ацетилен при охлаждении сжижается при – 83,8°С, а при дальнейшем понижении температуры быстро затвердевает.
Он умеренно растворим в воде (1150 мл в 1 л воды при 15° С и атмосферном давлении) и хорошо в органических растворителях, особенно в ацетоне (25 л в 1 л ацетона при тех же условиях и 300 л под давлением
12 атм).
Термодинамически ацетилен неустойчив; он взрывается при нагревании до 500° С, а при обычной температуре – при повышении давления до 2 атм.
Взрыв ацетилена сопровождается резким повышением давления и температуры и может вызвать тяжелые несчастные случаи

Методы получения
Промышленные методы получения
1. Карбидный способ: разложение карбида кальция водой
CaC2 + 2H2O → HC≡CH + Ca(OH)2
2. Высокотемпературный пиролиз метана
1500ºС
2CH4 → HC≡CH + 3H2
3. Дегидрирование алканов
Ni °t
CH3 – CH3 → HC≡CH + 3H2
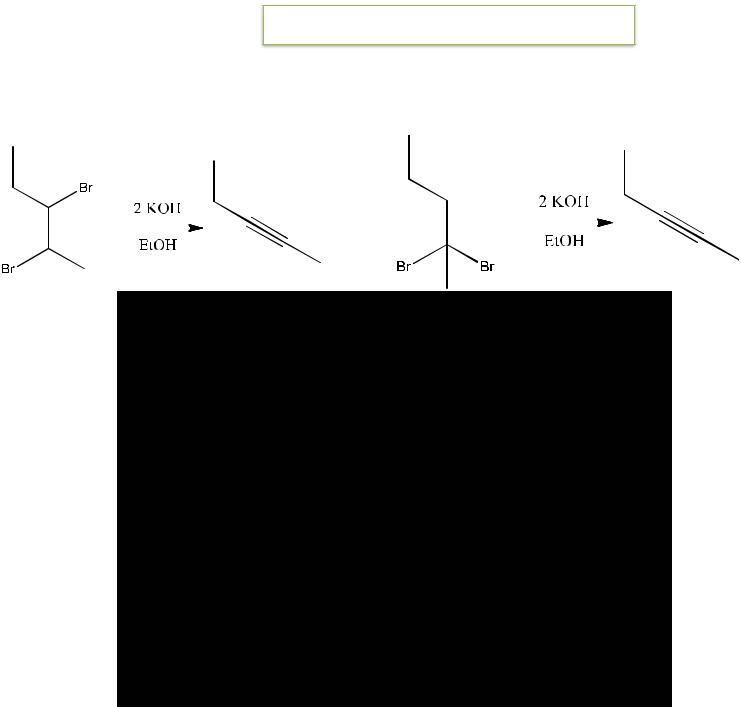
Лабораторные методы получения
1. Дегидрогалогенирование дигалогенопроизводных (вицинальных или геминальных) парафинов

Химические свойства
Алкины способны вступать в реакции Ad, S, полимеризации и окисления
Ad
С С
С

Углеродные атомы в молекулах алкинов расположены ближе друг к другу, чем в алкенах, и обладают большей электроотрицательностью. Это связано с тем, что электроотрицательность атома углерода зависит от его валентного состояния. Поэтому p-электроны, находясь ближе к ядрам углерода, проявляют несколько меньшую активность в реакциях электрофильного присоединения. Кроме того, сказывается, близость положительно заряженных ядер атомов, способных отталкивать приближающиеся электрофильные реагенты
CH2=CH2 > CH≡CH
Уменьшение активности в реакции AdE
1. Гидрирование
CH≡CH + H2 |
CH2=CH2 + H2 |
CH3-CH3 |
2. Галогенирование
3. Гидрогалогенирование

4. Присоединение воды (реакция М. Г. Кучерова,. 1881). Катализатор — соль ртути
образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена)
|
М. Г. Кучеров |
|
|
1850–1911 гг. |
|
или в кетон (в случае других алкинов) |
||
|
||
|
|

В 1949 немецкий химик В.Ю.Реппе открыл важную реакцию карбонилирования (присоединения СО) ацетилена в присутствии никелевого Катализатора:
СН≡СН + СО + Н2О  СН2=СН–СООН.
СН2=СН–СООН.
Акриловая кислота
В. Ю. Реппе
СН≡СН + HCN  CH2=CH–CN
CH2=CH–CN
Нитрил акриловой кислоты
Полиакрилонитрильные полимеры, волокна
