
- •2.Энергия және оның түрлері.Жүйенің ішкі энергиясы.Энтальпия.
- •3. Жұмыс және жылу.Термодинамиканың бірінші заңы.
- •13. Биологиялық реакциялар жылдамдығына температураның әсері. Ферменттер биологиялық катализаторлар ретінде
- •14. Химиялық тепе-теңдік. Тепе-теңдік константасы. Ле-Шателье принципі
- •15. Катализ және катализаторлар. Гомогенді катализ. Қышқылдық- негіздік катализ. Гетерогенді катализ.
- •49)Беттік құбылыстар. Беттік керіліс және беттік энергия.
- •50)Беттік құбылыстар.Беттік-активті және беттік-бейактивті заттар.
- •51)Сорбциялық құбылыстардың жалпы сипаттамасы.
- •53. Қатты беттердегі адсорбция.
- •54.Қатты денелерде ерітіндіден жүретін адсорбция. Молекулалық адсотбция. Электролиттер адсорбциясы.
- •55. Хроматография. Биологияда және медицинада қолданылуы.
- •56. Дисперсті жүйелердің жіктелуі
- •61. Коагуляция теориясы. Пептизация және каллоидты қорғаныш.
- •62. Ірі дисперсті жүйелер. Эмульсиялар.Аэрозольдер.Суспезилядар.
- •64. Полимерлердің ісінуі және еруі. Жмқ ертінділерінің тұтқырлығы. Жмқ ерітінділері тұрақтылығының бұзылуы. Гельдер әне сірнелер.
15. Катализ және катализаторлар. Гомогенді катализ. Қышқылдық- негіздік катализ. Гетерогенді катализ.
Химиялық реакция жылдамдығын катализатор көмегімен реттеуге болады. Катализатор деп, реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын заттарды айтады.
Егер катализатор реакция жылдамдығын арттыратын болса, оны оң, ал баяулататын болса теріс катализатор деп атайды.
Егер катализатор реакция барысында түзілсе, оны автокатализ деп атайды. Кейбір заттар катализатордың әсер етуіне кедергі жасайды, ондай заттарды ингибиторлар немесе катализатор улары деп атайды.
Ал кейбір заттар өздері катализатор болмаса, катализатордың активтілігін арттырады, ондай заттарды активаторлар деп атайды. Реакцияға қатысатын заттардың және катализатордың агрегаттық күйіне байланысты каталитикалық реакциялар гомогендік және гетерогендік деп атайды. Реакцияға қатысатын заттар мен катализатор бірдей агрегаттық күйде болса, гомогендік катализ, ал әртүрлі агрегаттық күйде болса, гетерогендік катализ деп атайды.
Қышқылдық- негіздік катализ - қышқылдың реакцияға қатысатын заттың біріне өзінің протонын беруі арқылы жүретін катализдің түрі. Қышқылдық-негіздік Катализге каталитикалық крекинг, гидраттану, дегидраттану, органикалық заттардың конденсациялануы, изомерлену реакциялары, тағы басқа жатады. Мұндай Катализдің катализаторлары – реагенттерге протон беретін немесе олардан протон алатын реагенттер мен гетеролиттік әрекеттесетін заттар. Мысалы, протондық (H2SO4, HCl, CH3COOH) және апротондық қышқылдар (BF3, AlCl3, тағы басқа), алюмосиликаттар Al2O3, фосфаттар, сульфаттар, тағы басқа Кейде негіздік сипаттағы катализаторлар да қолданылады (еріген негіздер, қатты CaO, MgO, тағы басқа). Реагенттерді активтендірудің әр түрлі жаңа әдістері табылуына қарамастан қазіргі кезде хим. өндірістің 80 – 90%-і каталитикалық процестердің үлесіне тиеді. Өндірістік каталитикалық процестерге майларды гидрогенизациялау, бензолды циклогексанға түрлендіру, нитробензолды анилинге айналдыру; мұнай өңдеу процесінде мұнай көмірсутектерін крекингілеу, жоғары сапалы бензиндер, дизельдік және реактивтік отындар алу үшін каталитикалық риформинг, алкилдеу, гидрокрекингілеу және су арқылы тазалау жатады.
17. газдардың сұйықтықта ерігіштік қасиеті:
1) сұйықтықпен салыстырғанда газдардың ретсіздігі жоғары болғандықтан этпропияның төмендеуі байқалады.
2) температураны төмендеткен сайын газдардың ертігіштігі артады.
Газдардың сұйықтықта ерігіштігі:
Барлық газдар сүйықтықта жақсы ериді
Жақсы еритін газдар: HCL, NH3, CO2
Нашар еритін заттар: И2, О2
Газдардың ерігіштігіне әсер ететін факторлар:
Газдардың табиғаты
Температура
Қысым
Еріткіш табиғаты
Генри заңы:
Тұрақты температурада газдың сұйықтықта еру қабілеті сол газдың сұйықтық бетіндегі қысымына тура пропорционал.
С=K*P
C- қаныққан ерітіндідегі газдың концентрациясы
Р- газдың ерітінді ұстіндегі қысымы
К- еріткіштің, газдың табиғатына , температураға тәуелді болатын және газдардың ерігішітігн сипаттайтын генри тұрақтысы
И.М.Сеченов заңы
Суға электролит қосқанда ертіндіде еріген заттың концентрациясы көбейген сайын газдың ерігіштігі төмендейді.
S=S0* e- kc
S- электролит ерітіндісіндегі газдың ерігіштігі
S0 – таза ертікіштегі газдың ертігіштігі
e-натурал логарифм негізі
K- сеченов тұрақтысы
C- электролит концентрациясы
18. диффузия- еріген зат концентрациясының градиенті барысында жүзеге асатын және заттың концентрациясының ерітіндінің бүкіл көлеміне біркелкі таралуына әкеп соғатын еріген заттың немесе еріткіштің бөлшектерінің өздігінен тасымалдану процесі.
Диффузия жылдамдығы- уақыт бірлігінде беттік аудан бірілігі арқылы зат мөлшерінің мөлшерінің диффузиялық тасымалдануы.
Диффузия жылдамдығына әсер ететін факторлар:
Концентрация градиенті;
Температура
Орта тұтқырлығы
Бөлшектердің мөлшері
Осмос- еріткіш молекулаларының өздігінен жарлытай өткіщгіш мембрана арқылы сұйытылған ерітіндіден концентрлі ертінідіге қарай бағытталған түрде өтуі.
Осмостық қысым- осмосты тоқтату үшін ертінідіге қажет қысым, яғни осмос құбылысын туғызатын күш.
19.Бейэлектролит ерітінділер- ерітіндісі өз бойынан электр тогын өткізбейтін және еріген зат молекула түрінде болатын заттар.
Коллигативті қасиеттері дегеніміз салыстырмалы сипаттамалыр еріген заттың табиғатына тәуелсіз, тек бөлшектердің санына тәуелді қасиеттері:
Ерітіндінің бетіндегі еріткіштің қаныққан бу қысымының таза еріткіштің бетіндегі қаныққан бу қысымына қарағанда салыстырмалы төмендеуі;
Ұшпайтын заттардың ерітінділерінің ұайнау температурасының таза еріткіштің ұайнау температурасына қарағанда салыстырмалы жоғарылауы;
Ерітіндінің қату температурасының таза еріткіштің қату температурасына қарағанда салыстырмалы төмендеуі.
Осмос және осмостық қысым.
Электролиттер – ерітіндісі ток өткізетін заттар. Ерітіндінің коллигативтік қасиеттері – ерітінділердің еріген затына тәуелсіз, тек оның мольдік концентрациясына байланысты қасиеттер. Оларға: осмос қысымы, ерітіндінің қату температурасының төмендеуі, қайнау температурасыныың жоғарылауы, ерітінді үстіндегі қаныққан бу қысымының төмендеуі жатады. Изотондық коэффицент(Вант-Гофф коэффиценті) – 1 моль еріген заттан түзілетін иондар мен молекула бөлшектерінің нақты санын көрсететін коэффицент(i). Изотонды ерітінділер – осмостық қысымы қан плазмасының осмостық қысымына тең сулы ерітінділер.
Электролиттік диссоциация – электролиттің еріген кезіндегі иондарға ыдырауы. Теорияны ұсынған Сванте Аррениус(1887 ж.). Күшті электролиттер – ерітіндіде молкулалары толығымен иондарға ыдырайтын химиялық қосылыстар. Олардың диссоциациялану дәрежелері 1-ге жақын.
Жасушаның барлық бейорганиқалық заттарының ішінде су бірінші орын алады. Су кейбір ферменттер әрекетінен гидролиз реакциясына түседі. Судың жылу сыйымдылығы және жылу өткізгіштігі жоғары. Адам ағзасындағы негізгі электролиттер: темір, калий, кальций, магний, натрий, фосфор, хлор.
25)Судың иондық көбейтіндісі. Сутектік көрсеткіш.Кез келген сұйық ерітінділерде , температура тұрақты болғанда сутек және гидроксил иондарының концентрациясының көбейтіндісі тұрақты шама болады да, сутек иондарының көбейтіндісі деп аталады.
Су иондарының көбейтідісі температураның өзгеруіне тәуелді, температура өскен сайын ыдырау константасы да өседі.
Мысалы : 0 градус = Кс = 0,13 * 10 -14
18 градус = 0,74 * 10 -14
22 градус = 1 * 10 -14
Таза суда сутек иондары мен гидроксил иондарының концентрациясы өзара тең :
[H+] = [OH-] = 10 -7 г-ион/л
Егер суға қышқыл қосылса , сутек иондарының концентрациясы артады да , гидроксил иондарының концентрациясы төмендейді.Себебі сутек және гидроксил иондары концентрациясының көбейтіндісі әрдайым тұрақты 10-14 тең шама болады.
Ерітіндінің қышқылдығын не сілтілігін теріс мәнді сандармен көрсету жұмыс кезінде ыңғайсыз, сондықтан сутек иондарының нақты концентрациясының орнына , сутектік көрсеткіш деп аталатын мән қолданылады, ор pH деп белгіленеді.
Сутектік көрсеткіш- сутек иондарының теріс таңбамен алынған логарифмін көрсетеді.Оны 1909 жылы Зеренсон ұсынды. Сутектік көрсеткішті былай анықтауға болады : pH=-lgaH+
Ал сұйытылған ерітінділер үшін : pH=-lg[H+]
26) Қышқылдардың үш түрі бар :
1. Жалпы қышқылдық
2. Потенциалды қышқылдық
3. Активті қышқылдық
Жалпы қышқылдық сутек иондарының бос, не байланысқан күйінде болатын жалпы санымен анықталады.
Жалпы қышқылдық = потенциалды қышқылдық + активті қышқылдық
Потенциалды қышқылдық ыдырамаған молекулалар санымен анықталады, яғни сутек ионы байланысқан күйде кездеседі.
Активті қышқылдық ерітіндідегі бос күйінде болатын сутек иондарымен анықталады.
Сутектік көрсеткішті анықтағанда тек қана активті қышқылдық есепке алынады.
28. Қышқылдық-негіздік титрлеу. Титрлеу қисықтары
Қышқылдық-негіздік титрлеу әдісі сутек немесе гидроксоний иондарының гидроксил тобымен әрекеттесуіне негізделген: Н+ +ОН- ↔ Н2О немесе Н3О+ + ОН- ↔ 2Н2О (су ерітінділерінде), В + Н3О+ ↔ ВН++ Н2О (органикалық ерітінділерде). Бұл әдіспен күшті қышқылдар мен негіздердің, әлсіз қышқылдар мен негіздердің, суда гидролизденетін тұздардың, органикалық қосылыстардың концентрацияларын анықтайды. Титрлеуде пайдаланылатын титранттың табиғатына байланысты қышқылдық-негіздік титрлеу әдісі екіге бөлінеді.
Ацидиметрлеу–негіздерді сандық анықтау тәсілі. Титрант ретінде қышқылдар пайдаланады: HCl, H2SO4 т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде Na2CO3, Na2B4O7·Н2О т.б. пайдаланады. Бұл тәсілмен күшті және әлсіз негіздерді, негіздік тұздарды, әлсіз қышқылдардың тұздарын, тұз қоспаларынжәне органикалық аминдерді анықтайды. Алкалиметрлеу-қышқылдарды сандық анықтау тәсілі. Титрант ретінде сілтілер пайдаланады: NaOH, KOH т.б. Титранттарын стандарттау үшін бастапқы заттар ретінде янтарь қышқылы, бензой қышқылы, калийдің гидротартратыт.б. пайдаланылады. Бұл тәсілмен әлсіз және күшті қышқылдарды, қышқыл тұздарды, әлсіз негіздердің тұздарын, органикалық қышқылдарды, фенолды т.б анықтайды. Қышқылдық-негіздік титрлеуді су және су емес (органикалық) ерітінділерде орындауға болады. Қышқылдық-негіздік титрлеуде тепе-теңдік константасының мәні К ≥ 108 тең болу тиіс. Бұл жағдайда титрленбей қалған қышқылдың немесе негіздердің массалық үлесі 0,01 %-ға тең болады. Бейтараптау тәсілінде индикаторларды Іnd дұрыс таңдау үшін сапалық көрсеткіштерімен қатар, сандақ сипаттамаларды (титрлеу қисықтарын, индикаторлық қателерді) есептей білу қажет.
Титрлеу қисығы- қышқыл мен негіздің нейтралдану мөлшері бойынша ерітіндінің рН-ының өзгеруін карсететін сызба.
Титрлеу қисықтарының 4 түрі болады:
1. Интегралдық қисық: Е – V координатасында салынады.
2. Дифференциалдық қисық: ΔE/ΔV - V.
3. ІІ туынды бойынша дифференциалдық қисық: Δ2 E/ΔV2 - V.
4. Гран қисығы: ΔV/ ΔE – V.
29. Буферлік жүйелер және буферлік ерітінділер
Буферлік жүйелердің адам ағзасы үшін маңызы жоғары. Адам қаны буферлік жүйелерге жатады. Адам ағзасында әсіресе, бүйректің бөліп шығару және өкпенің тыныс алу қызметтері үшін буферлік жүйелердің маңызы жоғары. Адам ағзасындағы сұйықтықтар (қан, ұлпа сұйықтығы, лимфа т.б.) қасиетінің бірі - олардағы сутегі иондарының тұрақты кон-центрациясын көрсетуі. Ағза сұйықтығының қышқылдылығының тұрақты болуының маңызы зор. Буферлі жүйелер деп қышқылдың немесе сілтінің аз мөлшерін қосқанда, сонымен қатар сұйылтқанда, сутек иондарының концентрациясы, яғни рН өзгермейтін ерітінділерді айтады. Адам ағзасындағы рН деңгейін сақтап туру буферлі жүйелердің көмегімен жүзеге асырылады.
Буферлік ерітінділер — сутек иондарының концентрациясын белгілі бір дәрежеде ұстайтын ерітінділер. Олар негізінен әлсіз қышқылдар немесе негіздер және олардың тұздарының қоспасынан тұрады, сұйылтқанда, концентрлегенде, күшті қышқыл немесе негіздің аз мөлшерін қосқанда өзінің сутектік көрсеткішінің (рН) мәнін болымсыз өзгертеді. Буферлік ерітінділер аналитикалық химияда, биохимиялық және физиологиялық зерттеулерде кеңінен қолданылады. Буферлік ерітінділер тірі организмдерде үлкен рөл атқарады (мысалы, қанның, лимфалардың, клеткааралық сұйықтардың pH тұрақтылығы). Олардың бикарбонаттық, фосфаттық, белоктық (белоктар әлсіз қышқылдық әрі негіздік қасиет көрсетеді) табиғаты бар.
30. Буферлік ерітінділердің әсер ету механизмі. Гендерсон-Гассельбах теңдеуі
Буферлі ерітіндіге қышқыл не сілті косқанда, не болмаса оларды сұйылтқанда рН өзгермей түрақты болуын буферлік әсер деп атайды. Әлсіз қышқыл мен оның сілтілік тұзынаң тұратын буферлі ерітіндіге (CH3COOH+CH3COONa) күшті қышқыл қосқандағы оның буферлік әсерін былай түсіндіреді: Күшті кышқыддың Н+ иондары тұздың аниондарымен байланысып, әлсіз қышқылдың диссоциацияланбайтын молекулаларын түзеді.
Буферлі ерітінділердің белгілі шамада рН-ты ұстау қасиеті де міне осында жатыр. Буферлік әсерді су, ондағы еріген қышқыл (негіз) және тұз арасындағы тендікті сақталуымен түсіндіреді. Ерітіндіге әлсіз қышқылдың тұзын қоссақ, ол қышқылдың диссоциациясын тежейді, ал егер әлсіз қышқыл (ерітіндіде) қоссақ, тұздың гидролизденуін тежейді. Мысал ретінде әлсіз қышкыл мен оның тұзынан тұратын буферлі қоспаны қарастырайық. Әлсіз қышқыл ерітіндіде былай диссоциацияланады: НАп ↔ Н+ + Ап-
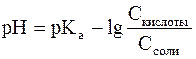
Бұл Гендерсон-Гассельбах теңдеуі деп аталады. Бұл теңдеуді кез келген буферлік жүйенің рН ын есептеуге қолданады. Мысалы, фосфатты буфер үшін мынадай түрде жазылады:
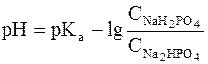
Буферлік жүйелердің ортасы қышқылдық немесе сілтітік болуы мүмкін. Сондықтан олардың рН-ын басқа ерітінділер тәрізді формула бойынша есептеп шығаруға болады. Сілтілік буферлік жүйенің рН –ын Гендерсон-Гассельбах бойынша есептеу теңдеуі: + pH= 14-pK+lgcн/cт
33.қышқылдар мен негіздер теориясы.Аррениус теориясында қышқылдар мен негіздер
Швед ғалымы С.Аррениус 1887 ж.гипотеза ретінде электролиттік диссоциациялау теориясын ұсынған.Бұл ең алғашқы қышқыл,негіз ж/е тұз ерітінділерінде,олардың молекулаларының оң ж/е теріс зарядты иондарға ыдырайтындығын көрсететін теория болды.
Қышқыл-суға ерігенде сутек иондарына(Н+)ыдырайтын заттар,ал дәлірек айтсақ қышқылдық дәм,индикаторға әсерін,химиялық қасиеттерін сипаттайтын гидроксоний ионын(H3O)түзетін заттар.
Негіз-суда ыдырағанда гидроксил ионын түзетін заттар.
Сутек ыдырағанда әрі сутек ионын (Н+) ,әрі (ОН-) гидроксил ионын түзетін заттарды амфотерлік заттар не амфолиттер д.а.:
Н2О=H++OH-
Аррениус теориясының көптеген кемшілітерібар:
1.еріткіш тек су болғанда ғана бұл теория орынды болады,ал басқа еріткіш алынса ,қандай затты қышқыл не негіз деп алуға болатыны түсінікті;
2.Көптеген заттар ОН- -ионын түзбей ақ негіздік қасиет көрсетеді.
Аррениустың электролиттік диссоциация теориясы теориясы түсіндіре алмаған мәселелері дания ғалымы Дж.Бренстед пен ағылшынхимигі Т.Лоури ұсынған қышқылдар мен негіздердің протолиттік теориясы түсіндіре алады.
34.Бренстедтің қышқылдар мен негіздер теориясы
Қышқыл және негіз туралы теорияларға тоқталсақ олардың қасиеттерін сипаттайтын негізгі 3 теория бар,олар: Аррениус теориясы,Бренстед-Лоури тео-сы,Льюистің тео-сы.
Осының ішінде Бренстед-Лоури теориясына тоқталсақ.Дания ғалымы Дж.Бренстед пен ағылшын ғалымы Т.Лоури қышқылдар мен негіздердің протолиттік теориясын ұсынды.Бұл теория Аррениустың электролиттік диссоциация теориясы түсіндіре алмаған мәселелерді ашып берді.Теория бойынша қышқылдар мен негіздерді-протолиттер деп,ал олардың әрекеттесуін –протолиттік тепе-теңдік дейміз.Бренстед-Лоури тео-сы бой-ша қышқылдар дегеніміз сутек ионын беретін молекулалар немесе иондар оларды басқаша донор дейміз.Ал негіздер дегеніміз сутек ионын қосып алатын молекулалар немесе иондар оларды басқаша акцептор дейміз.
Тек молекулалар емес иондарда қышқыл бола алады.Бренстед-Лоури теориясының Аррениус-ң электролиттік теориясынан негізгі ерекшелігі қышқылдар мен негіздер бір бірімен өте тығыз байланысты заттар.Қышқылдан протонның бөлінуі негіздің түзілуіне әкеп соқтырады.Әрбір қышқыл протонды бөліп шығару арқылы тиісті негіз түзсе,әрбір негіз протон қосып алып,өзіне тиісті қышқыл түзеді.Қышқыл неғұрлым күшті болса,онымен қосақталған негіз соғұрлым әлсіз болады.Керісінше қышқыл әлсіз болса.негіз күшті болдаы.Бренстед-Лоури теориясын қорыта келгенде қышқылдарға мыналарды жатқызамыз:H2S,HCl,HNO3,H2SO4,H3PO4 т.б және әлсіз негіз бен күшті қышқыл тұздарын мысалы NH4Cl бұл жерде хлор әлсіз негіз анау күшті қышқыл,сосын қышқыл тұздарды жатқызамыз оларға мысал NaHCO3,NaHSO4,сосын органикалық заттардан құрамында сутек ионы бар барлық заттарды мысалы карбон қышқылдарын-R-COOH,фенолды-C6H5OH,спирттерді-R-OH ,амин қышқылдарын жатқызамыз.
Негіздерге-бейорганикалық заттардың қатарынан NaOH,KOH,NH3,H2O,негіздік тұздарды,протонды қосып алу қабілеті бар көптеген органикалық заттар жатады.
35.Молекула құрылысы
Молекула – жай немесе күрделі заттың негізгі химиялық қасиеттерін сақтайтын және өздігінен өмір сүретін ең кіші бөлшек
Молекулалары бір атомнан тұратын заттар үшін (мысалы, инертті газдар) молекула ұғымы мен атом ұғымы сәйкес келеді.
Молекула құрамы брутто-формула (Н2O, CH4, HNO3) арқылы көрсетіледі. Органикалық қосылыстардың классикалық құрылыс теориясы молекуланың құрылысын атомдар арасындағы тізбекті және байланыс тәртібін көрсететін құрылымдық формуламен өрнектеуге мүмкіндік берді. Эмпирикалық формулалары бірдей молекулалардың құрылысы әр түрлі және түрлі қасиеттерге ие болуы мүмкін. Молекуланың көптеген қасиеттері оның симметриясына тікелей байланысты болады. Молекула энергиясы ондаған және жүздеген кДж/мольмен есептелетін квантталған құраушылардан – электрон қозғалысының энергиясынан, атом ядроларының тербелмелі қозғалысының, сондай-ақ бүтіндей молекуланың кеңістікте ілгерілемелі және айналмалы қозғалысының энергияларынан құралады. Қандай да бір электрондық күйдегі молекуланың орнықтылығы ядролардың тербелмелі қозғалысының потенциалдық энергиясы минимумының болуына байланысты анықталады.
36.Ковалентті байланыс.
Берілген атомның түзе алатын коваленттік байланыстардың саны шексіз болмайды,ол оның электрондық конфигурациясымен анықталады.бір атомдық орбиталь тек бір ғанаковаленттік байланыс түзуге қатыса алады.Олай болса,атомдарының сыртқы энергетикалық деңгейінде тек 4 орбиталі бар.
Атомдың жақындаған кезде электрон бұлттары өзара бір-біріне кірігеді.Ядроаралық кеңістікте электрондық тығыздықтың өсуі ядролардың бір-біріне тартылуын күшейтеді.
Бір-бірімен байланысатын екі атомның оптималды ядроаралық қашықтығын байланыс ұзындығы деп атайды.
Ядролар бір-біріне жақын келген сайын ,яғни байланыс ұзындығы аз болған сайын,байланыс түзілгенде энергия көп бөленеді,сондықтан ол берік болады.Байланыс энергиясы-1 моль затқа шаққандағы байланыс түзілгенде бөленетін н/е оны үзуге қажетті энергия мөлшері.
Валенттілік байлныстар әдісінде молекудағы атомдар өздерінің жеке сипаттарын сақтайды,ал ортақ электрон жұбы алма-кезек бір атомның атомдық орбиталінде орналасады деп қабылданады.
Екі сутек атомнан тұратын жүйе энергиясының тәуелділік қисығы спинсаны бірдей электрондары бар екі сутек атомдарыбір-біріне жақындағанда ядроаралық қашықтық азайған сайын,жүйе энергиясның өсуі байқалады.Спин сандары әр түрлі электрондары бар екі сутек атомдары бір-біріне жақындағандажүйенің энергиясы әуелі төмендейді,байланыс ұзындығының саны тең қашықтықтағы миниумға жетеді,ол байланыс энергиясына тең болады.
Коваленттілік байланыста түзілу механизмі қарастырылады.Алмасу механизмі б-ша ортақ электрон жұбыбайланысқа дейін екі әр түрлі атомдарға тиесілі жұптаспаған электрондардыңортақтасуы нәт.түзіледі.
Екінші механизм бос орбиталін береді.Байланыс түзілумеханизмін донорлық-акцепторлық деп атайды.
37.Полюсті және полюссіз ковалентті байланыс.Орбитальдардың гибредтенуі π- және сигма байланыс түрлері.
Полюссіз ковалентті байланыс бір элемент атомдарынан тұратын молекулаларда түзіледі:H2,Cl2,N2 т.б
Полюсті молекулаларда бүркесу зонасы электртерістігі үлкен атомға ығысады: HCl,HF,HI т.б
Гибридтену-пішіндері әртүрлі,энергиялары шамалас орбитальдардың араласып,пішіні,энергиясы,байланыс бұрышы тағыда басқа сипаттамалары бірдей гибридтенген жаңа орбитальдар түзілуі.Атомдық орбитальдардың гибридтенуі атомдар арасында коваленттік байланыс түзілген кезде жүреді.Гибридтенуге жұмсалған энергияның орны химиялық берік байланыс түзілгенде бөлінетін энергиямен толтырылады.Гибридтенуге қанша орбиталь қатысса,гибридтенген орбитальдардың сандары да сонша болады.Химиялық байланыс түзілгенде гибридтенген орбитальдардың байланыс түзетін басқа атомдардың орбитальдарымен бүркесу аймағы жеке s-немес p-орбитальдарымен салыстырғанда үлкенірек болады.Сондықтан гибридтенген орбитальдар түзетін хими-қ байланыстар гибридтенбеген орбитальдар түзетін байланыстардан берік болады.
Химиялық байланыс түзу кезінде осы байланыс түзуші атомдардың электрондық құрылыстарының ерекшеліктеріне сәйкес,түзілген химиялық коваленттік байланыстардың бағыттары әртүрлі болады.Кеңістікте атомдар электрон бұлттарының бір бірімен әрекеттесіп молеклалық электрон бұлтын түзу тәсілдеріне қарай химиялық байланыстар сигма және пи байланыстар болып бөлінеді.Атомдардың электрон орбитальдарының бір бірімен әрекеттесуі нәтижесінде түзілген молекулалық орбиталь сол атомдардың арасын байланыстыратын белдеу сызығының бойында жатса,ондай балансты сигма байланыс деп атайды.Сигма байланыс ең мықты байланыс.Сигма байланыс екі сигма немесе екі р орбитальдар және s пен p,d мен s.d мен p-орбитальдар әрекеттескенде түзілуі мүмкін.Пи байланыс түзілгенде әрекеттесуші атомдардың электрон бұлттарының қабаттасуы арқылы түзілген молекулалық орбиталь ядроларды қосатын белдеу сызығының екі жағында жатады да оған перпендикуляр бағытта орналасады.Пи байланысуда электрон бұлттарының ортақ қабаттасқан көлемі сигма байланысқа қарағанда кемдеу болады да пи байланыс сигма байланысқа қарағанда әлсіз болады.
39.


40.
.
41.





46.Дифузды және мембраналық потенциалдар
Дифузиялық потенциял – иондардың әртүрлі қозғалғыштығына байланысты , әртүрлі концентрациялы немесеәртүрлі құрамды электролиттердің екі ерітіндісінің жанасу шекарасында туындайтын потенциалдар айырымы
Мембраналық
потенциал
– мембранамен бөлінген ерітіділер
арасында потенциалдардың электрохимиялық
айырымы пайда болады , оны мембраналық
потенциал
 деп атайды.
деп атайды.
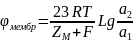
47.Тотығу – тотықыздану жүйелері
Әрекеттесуші заттардың құрамына кіретін атомдардың тотығу дәрежелері өзгере жүретін реакцияларды тотығу – тотықсыздану реакциялары деп атайды.
Тотықтырғыш – бұл құрамында элктрон қосып алып , тотығу дәрежесін төмендететін элементі бар зат. Мысалы
2Fe+3
Cl3
+ 2K+
J
 J 00+2Fe
+2Cl
-
2
+
2K + Cl-
J 00+2Fe
+2Cl
-
2
+
2K + Cl-
Тотықсыздандырғыш – Бұл құрамында электрон беріп ,тотығу дәрежесін ар ттыратын элементі бар зат.
Мысалы:
2I-
– 2 e-
 I2
0
I2
0
Тотығу – тотықсыздану реакциясын 3ке бөледі:
Молекулааралық
Молекулаішілік
Диспропорциялық
Тотығу процесі өтетін электронды – анод , ал тотықсыздану процесі жүретін электронды – катоддеп атайды
48. Потенциометрия . Шыны электроны көмегімен pH анықтау:
Потенциометрия – деп зерттеудің физ-химиялық әдістерін айтады. Бұл әдістің негізінде индикаторлық электрод пен салыстыру электрондарынан құрастырылған тізбектің электрқозғаушы күшін өшлеу жатыр.
Потенциометрия әдісі тура және жанама болып бөлінеді
Пот-ялық анализ әдістері гальваникалық элементтің электрондық потенциалын , электроқозғаушы күшінөлшеуге негізделген электролиттер мен химиялық реакциялардың физ-химиялық мінездемелерін анықтайды.
Потенциаметрлік өлшеуу әдісін pH анықтауда кеңінен қолданады. Бұл үшін индикаторлық электрод пен салыстырмалы электродтан құралған электрохимиялық тізбек қолданылады.
Шыны электрод. Бұл электрод рН ерітінділерін өлшеу кезінде ерітіндідегі кез келген рН өзгеруіне өте тез және дәл әсерлеседі, нәтижесінде сутек ионының концентрациясын ІМ мен 10−14М (рН=14) аралығьтнда өлшеуге мүмкіндік береді. рН электродтар күшті қышқылды ерітінділерді өлшегенде, қышқылдық қателік деп аталатын оң, ал сілтілікте рН=9 сілтілік қателік делінетін теріс ауытқушылық береді. Соңғысы шыны электродтың натрий мен калий және басқа да иондардың өзгеруіне сезімталдығымен байланысты.
Жалпы бұл электродтарды әуелі арнайы әзірленген стандартты буферлі ерітінді көмегімен реттеп алады. Электродтардың сипаттамасы шыны табиғатына тәуелді анықталады. Шыны электродының жарғағы сұйық және қатты болып келетін екі түрлі электродтың арасында болады. Ондағы шыны түрлі силикаттардың кеңістікте аса салқындатылған сұйық ерітінді түріндегі сілтілік металдар молекуласының тізбегі сияқты құрылым. Мұнда оның кеңістіктегі үш өлшемді қаңқасында сілтілік металл катионы болады. Олар көршілес оттек иондарының эластростатикалық өрісінде тұтылып тұрады және тор құрылымын өзгертпей-ақ қайтымды орын баса алады. Бұл кезде сілтілік металл иондары ішінара сутек катионымен алмасады.
Шыны электродты рН өлшеу үшін жарты ғасырдан артық мерзім бойына қолдануда, әйтсе де соңғы кезде ондағы шыны құрамын өзгерту арқылы басқа иондарды таңдап, талғап өлшейтін электрод жасау мүмкіндігі пайда болды. Мысалы, шыны құрамындағы алюминий тотығын арттыру арқылы ерітіндідегі натрий катионының активтігін өлшейді. Келесі құрамдағы шыныны әзірлеп, ерітіндідегі калий не күміс ионын анықтайды. Әрине, бұл иондарды анықтауды буферлі ерітінділердің белгілі бір рН мәнінде жүргізеді, ал натрий мен калий иондарын анықтайтын электродта олардың мәні аса үлкен емес. Бұлар таңдайтын шыны электродқа, басқа да бір зарядты катиондарға тән.
