
- •2.Энергия және оның түрлері.Жүйенің ішкі энергиясы.Энтальпия.
- •3. Жұмыс және жылу.Термодинамиканың бірінші заңы.
- •13. Биологиялық реакциялар жылдамдығына температураның әсері. Ферменттер биологиялық катализаторлар ретінде
- •14. Химиялық тепе-теңдік. Тепе-теңдік константасы. Ле-Шателье принципі
- •15. Катализ және катализаторлар. Гомогенді катализ. Қышқылдық- негіздік катализ. Гетерогенді катализ.
- •49)Беттік құбылыстар. Беттік керіліс және беттік энергия.
- •50)Беттік құбылыстар.Беттік-активті және беттік-бейактивті заттар.
- •51)Сорбциялық құбылыстардың жалпы сипаттамасы.
- •53. Қатты беттердегі адсорбция.
- •54.Қатты денелерде ерітіндіден жүретін адсорбция. Молекулалық адсотбция. Электролиттер адсорбциясы.
- •55. Хроматография. Биологияда және медицинада қолданылуы.
- •56. Дисперсті жүйелердің жіктелуі
- •61. Коагуляция теориясы. Пептизация және каллоидты қорғаныш.
- •62. Ірі дисперсті жүйелер. Эмульсиялар.Аэрозольдер.Суспезилядар.
- •64. Полимерлердің ісінуі және еруі. Жмқ ертінділерінің тұтқырлығы. Жмқ ерітінділері тұрақтылығының бұзылуы. Гельдер әне сірнелер.
1.Химиялық темодинамика пәні.Неізгі термодинамикалық түсініктер.Химиялық термодинамика-химиялық реакция кезінде байқалатын энергияның бір түрден екінші түрге айналуын,реакиялардың бағытын және олардың осы жағдайда өздігінен жүру шегін,сонымен қатар химиялық тепе теңдіктің болу жағдайларын анықтайды.Негзгі түсініктер:
Жүйе деп қоршаған ортадан ойша бөлініпн алынған және онымен әрекеттесуде болатын дене не денелер тобын айтамыз.Қоршаған ортамен әрекеттесуіне байланысты жүйелер:
1.Оқшауланған жүйе-Қоршаған ортамен зат және энергия алмаспайды.(дьюар қабырғасына су буы)
2.Жабық жүйе-қоршаған ортамен тек энергия алмасып бірақ зат алмаспайды.(аузы жабық колбаға құйылған су)
3.АшыҚ жүйе-қоршаған ортамен зат та энергия да алмасады(ашық ыдыстағы су)
Жүйе күйі-берілген уақыт мезетіндегі жүйе ие бола алатын физикалық химиялық қасиеттердің жиынтығы.Жүйе күйін сипаттайтын темодинамикалық параметрлер:
1.Негізгі параметрлер-жүйенің әртүрлі қасиеттерін сипаттайды.температура көлем қысым концентрация.
2.Қосымша параметрлер немесе күй функциялары олардың көмегімен жүйе күйін тікелей сипаттай алмаймыз,бірақ бұл шамалардың өзгерістері арқылы процестік жүру мүмкіндігі оның бағыты тепе теңдік күй туралы процестік жүру жағдайына байланысты толық мағлұмат алуға болады.(ішкі энергия,энтропия,энтадьпия,гиббс энергиясы)
Жүйе құрайтын фазалар бірдей агрегаттық күйде болса - біртекті (гомогенді), ал әртүрлі күйде болса - әртекті (гетерогенді) деп бөлінеді. Жалпы термодинамикалық жүйе тыңғылықты сипаттау үшін, оның физикалық - химиялық қасиеттерінен, яғни көлемі, қысымы, температурасы, химиялық құрамы және т.б. хабардар болуымыз керек. Осы орайда өзімізге таныс күй теңдеулерінің тәуелділігінен өзара байланыста болатын шамалар туралы дәйекті ұғым алуымызға мүмкіндік туындайды. Аталған күй теңдеулерінде кездесетін айналмалылар күй шамалары (параметрі) деп аталынады. Кез-келген күй шамаларыныц өзгepici термодинамикалық құбылыс (процесс) деп аталынады да күй шамасының тұрақтылығына қарай төмеңдегіше жіктелінеді: р = const – изобарлы, V = const – изохорлы, Т = const – изотермиялы, Сыртқы қоршаған ортамен жылу және зат алмаспай жүретін құбылыс – адиабатты деп аталып pVγ = const теңдеуімен өрнектеледі. Мұндағы γ – адиабата көрсеткіші және бұл құбылыс оқшауланған жүйелерде орын алады.
2.Энергия және оның түрлері.Жүйенің ішкі энергиясы.Энтальпия.
Энергия[1] (гр. energeіa – әсер, әрекет) – материя қозғалысының әртүрлі формасының жалпы өлшеуіші. Энергия екіге бөлінеді: потенциалдық және кинетикалық энергия. Потенциалдық энергия денелердің немесе дене бөліктерінің өзара алмасуынан пайда болады. Кинетикалық энергия дене қозғалысқа түскенде пайда болады.
Жүйенің ішкі энергиясы деп оны құрайтын молекулалар атомдар иондар және элементар бөлшектердің барлық қозғалыс және әрекеттесу түрлерінің эалпы энергия қорын айтамыз.
Жүйе энергиясының түрі:молекулалардың ілгермелі және айнымалы қозғалыс энергиясы,атомдар мен молекулалардың молекулаларды құрайтын атомдар тобының молекула ішіндегі тербелмелі қозғалысының энергиясы,атомдардағы электрондардың айналу энергиясы атом ядроларының энергиясы және энергияның басқ түрлері құрайды.
Энтальпия деп тұрақты қысымдағы жүйенің энергиясын айтады,ол жүйенің ішкі энергиясы(U) және қысым мен көлемнің көбейтіндісінің (pV) қосындысына тең.
H=U+pV
3. Жұмыс және жылу.Термодинамиканың бірінші заңы.
Жұмыс -жүйенің сыртқы параметрлерін өзгерту арқылы алынған немесе берілген энергия көрсеткіші.
Термодинамиканың бірінші тануының негізгі түрі былай айтылады:
Түрлі энергиялар бір-біріне тең эквиваленттілік қатынаста айналады.
Оңашаланған күйде энергияның әр түрінің қысымы өзгермейді.
Бір түрден екінші түрге айналғанда энергия жоғалмайды да, жаңадан пайда болмайды.
Жұмысты жоқтан шығаратын машина жасау мүмкін емес.
Термодинамикалық
жүйемен энергия алмасуы - жылу мен жұмыс
түрінде орын алатындықтан аталған
шамалар ішкі энергия өзгерісімен тәуелді
байланыста болады.
Жүйеге,
жылу түрінде берілген энергия, жүйе
ішкі энергиясын өзгертіп, белгілі бip
жұмыс атқаруға жұмсалады.
Күнделікті
өмірде, тұрмыста орын алатын жылу, жұмыс
және ішкі энергия шамаларының өзара
байланыстығы термодинамика ілімінің
бірінші бастамасы деген атпен төмендегінше
тұжырымдалады.
Оқшауланған
жүйенің энергиясы тұрақты шама: U ~
const.
Жүйеге
қоршаған ортадан жылу түрінде берілген
энергия - оның ішкі энергиясын өзгертіп,
белгілі бip жұмыс атқарады және бұл
математикалық тілде төмендегідей
өрнектеледі:
Q
= ∆U + A,
мұндағы:
![]() -
жылу мөлшері;
-
жылу мөлшері;
![]() -
ішкі энергия өзгерісі;
-
ішкі энергия өзгерісі;
![]() -
жұмыс шамасы;
T,p=const
A=p∆V
-
жұмыс шамасы;
T,p=const
A=p∆V
![]() осыдан
шығатыны
осыдан
шығатыны
![]()
![]()
Міне
осыдан,
![]() –
қосындысы Н – энтальпия деп атайды.
Демек, энтальпия термодинамикалық
жүйені толықтау сипаттайтын энергетикалық
шама.
–
қосындысы Н – энтальпия деп атайды.
Демек, энтальпия термодинамикалық
жүйені толықтау сипаттайтын энергетикалық
шама.
![]() –
болғандықтан, энтальпия шамасы да
күй функциясы
болып табылады,
оған ішкі энергия қасиеттерінің бәрі
де тән.
–
болғандықтан, энтальпия шамасы да
күй функциясы
болып табылады,
оған ішкі энергия қасиеттерінің бәрі
де тән.
8.
Химиялық реакциялардың жылдамдығына әсер ететін негізгі факторларға әсер етуші заттардың концентрациясы, температура, катализатордың болуы жатады.
Концентрация
Әсер етуші заттардың концентрациясын жоғарылату — үдерістерді қарқындатудың ең кең тараған тәсілдерінің бірі.
Химиялық реакция жылдамдығының концентрацияға байланыстылығы салмақ әсері заңымен анықталады. Мысалы, сірне(патока) өндірісінде тұз қышқылын(хлорсутек қышқылы) натрий карбонатымен нейтралдау реакциясы үшін жылдамдық келесі теңдеу бойынша жазылады:
2НС1 + Na2C03 = 2NaCl + H20 + С02,
Жылдамдық тұрақтысы(константа скорости) әсер етуші заттардың табиғатына, температурасына, катализатордың болуына байланысты және химиялық реакцияға қатысатын заттардың концентрациясына байланысты емес. Реакция жылдамдығының тұрақтысы реакцияның реті мен молекулярлығына байланысты.
Реакцияның молекулярлығы химиялық әсерлесуге қатысатын молекула санымен анықталады. Егер ол үшін бір молекула қажет болса реакция мономолекулалы деп аталады. Мысалы, мұндай реакцияға қантқызылшасы зауытындағы жоғарғы температурада әкті күйдіру кезіндегі СаС03 ыдырау реакциясы жатады:
СаСО3 = СаО + С02.
Екі молекуланың қатысуымен жүретін реакция бимолекулалы, үш молекуламен — үшмолекулалы деп аталады. Бұл бір заттың немесе әртүрлі зат молекулалары болуы мүмкін. Жоғарыдағы тұз қышқылының натрий карбонатымен өзара әрекеттесу реакциясы үшмолекулалы реакцияға жатады(тұз қышқылының екі молекуласы және натрий карбонатының бір молекуласы).
Температура
Температура — реакцияның жылдамдығын анықтайтын маңызды фактор.
Температура жоғарылаған сайын реакцияның жылдамдығы да өседі, бұл реакция жылдамдығы тұрақтысының жоғарылауымен байланысты.
Вант-Гофф ережесіне байланысты температураны 10оСқа жоғарылату реакция жылдамдығын 2...4 есе жылдамдатады. Бұл ереже 0 ден 300оС температура аралығында жүретін реакцияларға қолданылады.
Химиялық реакция жүру үшін әсер етуші заттар молекуласындағы ішкі молекулалы байланыстарды үзу қажет. Егер бір бірімен соқтығысатын молекулалардың байланысты үзе алатындай энергиясы болса, онда реакция жүреді, ал егер молекула энергиясы қажетті энергиядан аз болса, онда соқтығысу тиімсіз болып реакция жүрмейді.
Температураны жоғарылатқан кезде белсенді молекулалар саны өседі, олардың арасындағы соқтығысу саны да жоғарылап, нәтижесінде реакция жылдамдығы тез болады. әсер етуші заттар концентрациясын жоғарылатқан сайын соқтығысудың жалпы саны көбейіп, нәтижесінде реакцияның жылдамдығы тез өседі.
Катализатор
Катализатор деп реакция жылдамдығын өзгертетін және реакция нәтижесінде өзгеріссіз қалатын заттарды айтады.
Егер катализатор реакция жылдамдығын арттыратын болса, оны ОҢ. Ал баяулайтын болса. ТЕРІС катализатор деп айтады.
Егер катализатор реакция барысында түзілсе, оны АВТОКАТАЛИЗ деп атайды.
Кейбір заттар катализаторлың әсер етуіне кедергі жасайды, ондай заттарды ИНГИБИТОРЛАР немесе КАТАЛИЗАТОР УЛАРЫ дейді.
Кейбір заттар өздері катализатор болмаса да, катализатордың активтігін арттырады, ондай заттарды АКТИВАТОРЛАР дейді.
Реакцияға қатысатын заттар мен катализатор бірдей агрегаттық күйде болса, ГОМОГЕНДІ КАТАЛИЗ, әртүрлі агрегаттық күйде болса, ГЕТЕРОГЕНДІК КАТАЛИЗ деп атайды.
Химиялық кинетика- химиялық реакцияның жылдамдығын және оған әртүрлі факторлардың әсерін, реакцияның жүру мезанизмін зерттейді.
Химиялық реакцияның жылдамдығы-белгілі бір уақытта әрекеттесетін заттар мөлшерінің өзгеруін айтады.
Химиялық
реакцияның орташа жылдамдығы :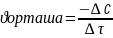
9.
Химиялық реакциялар молекулалардың санына және реакциялардың ретіне байланысты жіктеледі.
Бір мезгілде әрекеттесетін молекулалардың санына баланысты реакциялар моно-, би- және үшмолекулалық болып бөлінеді.
Реакцияның реті кинетикалық теңдеу бойынша әрекеттесуші заттардың концентрацияларының дәреже көрсеткіштерінің қосындысымен анықталады. Химиялық реакциялар нөлінші, бірінші, екінші және үшінші ретті болып бөлінеді.
Реакцияның реті-реакцияның оған қатысатын заттардың концентрациясына аса тәуелді екендігін көрсетеді. Реакцияның реті кинетикалық теңдеу бойынша анықталады және ол әрекеттесетін заттар концентрациясының дәреже көрсеткіштерінің қосындысна теі болады. Химиялық реакцияның реті нөлінші, бірінші, екінші, үшінші және бөлшекті болып бөлінеді. Нөлінші реттегі реакцияның жылдамдығы әрекеттесуші заттардың концентрациясына тәуелсіз болады. Бұл реакция сирек кездеседі де, металл бетінде жүретін гетерогендік реакцияларға тән болады. Бірінші ретті реакциялар жиірек кездеседі.
Иодтың не азот оксидінің ыдырау реакцияларын бірінші ретті реакциялар қатарына жатқызуға болады.
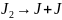 ;
;
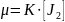
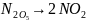 +
O;
+
O;

