
- •2.Теория растворов в аналитической химии. Химическое равновесие. Термодинамическая и концентрационная константы равновесия. Сильные и слабые электролиты, степень диссоциации.
- •3.Аналитическая и равновесная концентрации, активность, коэффициент активности. Способы выражения концентрации растворов.
- •4.Гравиметрический метод анализа. Особенности и область применения. Метод осаждения, гетерогенное равновесие, произведение растворимости, растворимость осадков.
- •5.Расчеты гетерогенных равновесий. Расчет растворимости осадков в насыщенном растворе и в электролитах. Солевой эффект
- •6.Основные условия получения кристаллических и амфотерных осадков. Причины загрязнения осадков.
- •7.Выбор осадителя. Форма осаждения, требования к ней. Гравиметрическая форма, способы ее получения, требования к гравиметрической форме.
- •8. Расчеты результатов в гравиметрическом методе анализа. Гравиметрический фактор.
- •9. Титриметрический метод анализа, область применения, основные преимущества и недостатки. Классификация титриметрических методов, требования к реакциям в титриметрии.
- •12. Основные понятия в титриметрии: способы титрования, способы отбора пробы для анализа.
- •13. Кислотно-основное равновесие. Теории кислот и оснований. Теория Бренстеда-Лоури, основные ее понятия. Растворители, свойства растворителей, классификация растворителей.
- •19. Кислотно-основный метод анализа, основные стандартные растворы, кислотно-основный индикатор.
- •20. Кривые титрования в кислотно основном методе анализа. Построение кривой титрования сильной кислоты сильным основанием. Выбор индикатора, расчёт ошибки титрования.
- •22. Построение кривой титрования слабой кислоты сильным основанием, выбор индикатора для титрования.
- •23. Построение кривой титрования многопротонной кислоты сильным основанием. Выбор индикатора.
- •24. Окислительно-восстонавительные методы анализа, классификация методов, область применения. Понятие окислительно-восстановительного потенциала. Стандартный и реальный потенциалы, уравнение Нернста.
- •25. Построение кривой титрования в окислительно восстановительном методе анализа, выбор индикатора, требования к индикатору.
- •26.Метод осаждения. Классификация методов. Требования к реакциям.
- •27.Построение кривых титрования методом осаждения. Способы фиксирования точки эквивалентности, выбор индикатора.
- •28.Метод комплексометрического анализа, класссификация стандартных растворов, комплексонометрический метод анализа, металлоиндикаторы и механизм их действия.
- •29.Мерная посуда в аналитической лаборатории. Подготовка посуды, основные правила работы с пипетками, бюретками ,мерными колбами.
- •30.Отбор проб для анализа (метод пипептирования, метод отдельных навесок).
- •31. Весы в аналитической лаборатории: технические и аналитические. Устройства весов и правила взвешивания на весах.
- •Абсорбционная спектроскопия. Спектры поглощения, характеристика спектров поглощения.
- •36.Спектрофотометры: схема одно- и двухлучевого спектрофотометра, схема простейшего монохроматора.
- •Эмиссионная спектроскопия. Спектральные приборы. Тепловые источники. Пламенная фотометрия, процессы, протекающие в пламени. Уравнение Ломакина. Качественный количественный анализ.
- •Хроматографические методы анализа, классификация. Газожидкостная хроматография. Схема хроматографа (хл-4). Качественный, количественный анализ.
30.Отбор проб для анализа (метод пипептирования, метод отдельных навесок).
Метод пипетирования. Навеску анализируемого в-ва растворяют в мерной колбе, разбавляют водой до метки, перемешивают р-р, пипеткой отбирают аликвотную часть р-ра и титруют. Измерение проводят три раза. Берут средний объём р-ра, пошедший на титрование.
Метод отдельных навесок. Берут отдельные, близкие по величине навески анализируемого в-ва. Растворяют в произвольном объёме воды и целиком титруют получаемые при этом р-ры.
Наиболее воспроизводимые результаты получаются м.о.н. (объём измеряют один раз бюреткой, а в методе пипет. 3 раза: пипетка, колба, бюретка).
m(H2C2O4)= C(1/zKMnO4)*V(KMnO4)*M(1/z H2C2O4)
m1=C1*V1*M, m2=C2*V2*M, m3=C3*V3*M
C1(KMnO4)=m1(H2C2O4)/V1(KMnO4)*M(1/z H2C2O4), C2=m2/V2*M, C3=m3/V3*M
Cср=С1+С2+С3/3.
При проведении титрования можно брать либо определенную массу анализируемого вещества, либо точно отмеренный объем анализируемого раствора. В соответствии с этим различают два подхода: метод отдельных навесок и метод пипетирования.
Способы отбора проб для анализа:
А) способ отдельных навесок
Прямое титрование 1 стандартный раствор(титрат) R.
X+R=P
n(1/zX)=n(1/zR)
c(1/zX)=c(1/zR)*V(R)/V(X)
m(X)= c(1/zR)* V(R)т.э *M(1/zX)/1000
Косвенное титрование применяется когда невозможна реакция между анализируемым веществом и титрантом(2 стандартных раствора R+Dдоп.ст.р)
1)X+D=P
2)P+R=P’
n(1/zX)=n(1/zP)= n(1/zR) Формулы те же , что и при прямом титровании.

X D
2
P

R
Обратное титрование(2 стандартных р-ра)
R-основной стандартный раствор
R’-вспомогательный стандартный раствор
1)X+R’изб=P+R’остаток
2) R’остаток+R=P’’
n(1/zX)=n(1/zR’) - n(1/zR)
Пример

X R’изб остаток
NaOH
+ HCl

R’остаток R
m(X)=

Б) Способ пипептирования( все формулы выше домножаются на дробь * Vколбы/Vпипетки)
31. Весы в аналитической лаборатории: технические и аналитические. Устройства весов и правила взвешивания на весах.
Весы технические
лабораторное оборудование для определения массы образцов и проб. Могут применяться с приспособлением для гидростатического взвешивания (определения массы образца в воде).
Взвешивание - сравнение массы данного предмета с известной массой разновесов, выраженной в определенных единицах (мг, г, кг). Весы являются важнейшим прибором в химической лаборатории. В зависимости от точности, с которой проводят взвешивание, различают технические и аналитические весы (рис. 6), их точность ±1·10-2 г и ±(2·10-4-2·10-5) г соответственно.
Чтобы исключить вибрацию весов и малейшие колебания стрелки, весы устанавливают в специальной комнате (весовой) на бетонной консоле, Весы помещают в застекленный шкаф, предохраняющий их от пыли и движения воздуха. Устанавливают весы горизонтально. Для этого весы снабжены отвесом или уровнем.

Рисунок 6. Лабораторные электронные аналитические и технические весы
Общие правила работы на аналитических весах:
Нагрузка на чашки весов не должна превышать предельной для данной системы весов.
При работе на весах необходимо проявлять осторожность, не делать резких движений.
Весы всегда должны находиться в чистоте. При попадании на чашку весов сыпучих веществ их удаляют специальной кисточкой или перышком.
Взвешиваемый предмет и разновесы помещают на чашки весов и снимают с них только при закрытом арретире.
Для взвешивания необходимо пользоваться чистой сухой посудой (бюкс, стакан, часовое стекло, тигель), помещать вещества непосредственно на чашку весов запрещено. Летучие и гигроскопичные вещества следует взвешивать только в закрытых бюксах.
Температура взвешиваемого предмета и окружающей среды должна быть одинакова. Нельзя взвешивать теплые предметы и растворы.
Все дверки весов во время взвешивания должны быть закрыты.
Аналитические разновесы необходимо брать только пинцетом, после взвешивания разновесы сразу помещать в футляр.
Все взвешивания для данного анализа следует проводиться одних и тех же весах.
32.Физико-химические методы измерений, испытаний и контроля. Фотометрический метод анализа. Закон Ламберта-Бугера-Бера, закон аддитивности. Причины нарушения закона Ламберта-Бугера-Бера. Схема фотоколориметра. Выбор светофильтра.
Основные физикохимические методы:1.Спектральный;2.Фотометрический;3.Хроматографический;4.Электрохимический
Преимущества
ФХМИ перед химическими:1)быстрота
проведения анализа;2)высокая
чувствительность(
 );3)анализ
окрашенных и мутных растворов;4) анализ
сложных смесей без их предварительного
разделения;5)удобно для автоматического
контроля.
);3)анализ
окрашенных и мутных растворов;4) анализ
сложных смесей без их предварительного
разделения;5)удобно для автоматического
контроля.
Фотометрический
метод анализа основан на измерении
интенсивности светового потока,прошедшего
через анализируемый раствор. Основным
законом фотометрии является закон
Ламберта-Бугера_Бера: ,
где
,
где
 – интенсивность падающего и прошедшего
через раствор света соответственно, Лм
; 10-основание десятичного логарифма;
-молярный коэффициент ослабления,
– интенсивность падающего и прошедшего
через раствор света соответственно, Лм
; 10-основание десятичного логарифма;
-молярный коэффициент ослабления,
 ;
С_концентрация раствора, моль/
;
С_концентрация раствора, моль/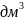 ;
;
 – толщина слоя поглощающего раствора,
см.
– толщина слоя поглощающего раствора,
см.
Смысл закона Ламберт-Бугера-Бера можно выразить следующим образом. Одинаковые слои одного и того же вещества поглощает свет в одинаковой степени в независимости от интенсивности падающего на них светового потока.
Абсорбция:
 .
Абсорбция раствора прямо пропорциональна
концентрации анализируемого вещества
и толщине слоя раствора.
.
Абсорбция раствора прямо пропорциональна
концентрации анализируемого вещества
и толщине слоя раствора.
Существует два метода фотометрического анализа:
1)Прямой фотометрический анализ.
Метод основан на определении концентрации анализируемого вещества по закону Д-Б-Г. Аналитическим сигналом в этом методе является либо абсорбция, либо светопропускание растворов.
Если вещество окрашено, то анализ проводят по методу собственного поглощения. В основном этот метод применяется для определения красителей или их смесей. В последнем случае при расчете концентраций отдельных компонентов смеси используют закон аддитивности абсорбций:

 -абсорбция
смеси невзаимодействующих красителей
на аналитической длине волны;
-абсорбция
смеси невзаимодействующих красителей
на аналитической длине волны;
 -
абсорбции отдельных красителей,
измеренные на той же длине волны и в тех
же кюветах, что и абсорбция смеси.
-
абсорбции отдельных красителей,
измеренные на той же длине волны и в тех
же кюветах, что и абсорбция смеси.
Абсорбция (светопропускание) анализируемых растворов измеряется на фотометрах или колориметрах. При измерении абсорбции используется относительный метод, который позволяет исключить поглощение света растворителем и учесть спектральные характеристики источников и приемников излучения.
2)Косвенный метод – фотометрическое титрование.
Фотометрическое титрование - \то титриметрический метод анализа, в котором точка эквивалентности определяется по резкому изменению абсорбции в ходе титрования.В фотометрическом титровании используются реакции нейтрализации, осаждения, окислительно-восстановительные и комплексо-образования. Метод позволяет проводить титрование по собственному поглощению и с помощью реагентов, в качестве последних могут использоваться индикаторы.

Где 1-источник видимого излучения;2-конденсор- система линз, собирающих лучи в одной точке;3-вхоная щель;4-коллиматор – система линз, направляющая параллельный пучок света на кювету;5-тепловой фильтр;6-сменные светофильтры(от 3 до 11);7,7”- кюветы с раствором сравнения и анализируемым раствором соответсвенно;8-светокомпенсатор(серые фильтры);9-фотоэлемент – преобразует световую энергию в электрическую; 10-усилитель;11-измерительный прибор, шкала котрого отградуирована в единицах абсорбции и светопропускания.
Выбор светофильтра:
1)По таблице дополнительных цветов
Основной цвет(цвет р-ра) |
Дополнительный цвет(цвет светофильтра) |
Красный |
Зеленый |
Зеленый |
Красный |
желтый |
синий |
2)По максимальной абсорбции
|
400 |
440 |
540 |
670 |
А |
0,1 |
0,2 |
0,5 |
0,3 |
Рабочий =540 нм
33.Методы фотометрического анализа: метод коэффициента экстинкции, метод двух растворов, метод добавок, метод калибровочного графика, метод фотометрического титрования, метод дифференциальной фотометрии.
А=𝜀cl
А(абсорбция)-на фотоколориметре
1.Метод
коэф. экстинкции



(таблица либо расчет по станд. р-ру)
2 Метод двух р-ров



 =
=
3.Метод добавок(анализ смесей)


 (
(
=
4.Метод калибровочного графика
1)Приготавливают стандартные растворы С1-С5
2) Измеряем абсорбцию на фотоколориметре
3)А=f(C) –строим калибровочный график
4)
5)По калибровочному графику определяем концентрацию анал.р-ра
5.Метод дифференциальной фотометрии
обычная фотометрия
 чистый
растворитель
чистый
растворитель
 ан-мый
р-р
ан-мый
р-р
Т
= ; А= lg
; А= lg
A
диф фотометрия(А>0,8)
стандартный
р-р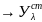
 ан-мый
р-р
ан-мый
р-р
 =
= ;
;
 =
lg
=
lg ;
;

6.Фотометрические титрования (в ходе титрования которого изменяется абсорбция)
Х+R P
1)c-? c(1/zX)=c(1/zR)*V(R)/V(X)
2)m(X)-? m(X)= c(1/zR)* V(R)т.э *M(1/zX)/1000
3)ω%=
34.Спектральные методы анализа. Волновые характеристики электромагнитного излучения.
Методы основаны на излучение взаимодействия электромагнитного излучения с веществом.
Основные виды электр. излучения:
1Гамма-лучи
2Ренгеновские
3Ультрофиолетовые
4Видимые
5Инфракрасные
6Микроволны, радиоволны
Основные волновые характеристики электромагнитного излучения:
1 -частота,
-частота,
𝑣 =
 , с-скорость света, 𝛌-длина
волны
, с-скорость света, 𝛌-длина
волны
2)𝛌-длина волны (длина между 2мя точками в одной фазе)
3)ῡ-волновое
число,
ῡ=
j-радиоволны
𝛌-увеличивается
𝑣-уменьшается
Е=h𝑣
Различают 2метода спектрального анализа
1 Абсорбционная спектроскопия-излучение спектров поглощения(спектры поглощения)
2Эмиссионная спектроскопия-основанная на эмиссионных спектров(излучение света)

 светофильтра,
нм
светофильтра,
нм