
7 Лабораторная работа №15
Гальванический элемент. Электрохимическая коррозия металлов
Цель работы: ознакомление на опыте с принципами работы гальванического элемента и с некоторыми моделями возникновения коррозионных элементов, овладение методикой расчета ЭДС гальванических элементов.
Оборудование и реактивы: медная и цинковая пластины, присоединенные к проводникам, медная и цинковая пластины, соединенные проводниками с медными пластинами, наждачная бумага, вольтметр, 3 химических стакана на 200 – 250 мл, мерный цилиндр, штатив с закрепленной в нем U-образной трубкой, солевой мост, 0,1 М растворы сульфата меди, сульфата цинка, сульфата натрия, 0,1%-ный раствор фенолфталеина в 50%-процентном этиловом спирте, две пробирки, 2н. раствор H2SO4, 0,1М раствор K3Fe(CN)6, кусочки цинка и олова, железные канцелярские скрепки, дистиллированная вода.
7.1 Теоретические пояснения
7.1.1 Гальванический элемент
Гальванический элемент представляет собой разновидность химических источников тока. Эти устройства применяют для преобразования энергии химической реакции в электрическую энергию.
Окислительно-восстановительную реакцию можно осуществить так, что полуреакции окисления и восстановления окажутся пространственно разделены. Тогда электроны будут переходить от восстановителя к окислителю не непосредственно, а по проводнику электрического тока. Возникнет направленное движение электронов – электрический ток. Энергия окислительно-восстановительной реакции превратится в энергию направленного движения электронов, то есть электрическую энергию, которую можно использовать, подключив во внешнюю цепь устройство, работающее за счет электрической энергии.
Итак, гальванический элемент – это химический источник тока, в котором энергия практически необратимой окислительно-восстановительной реакции преобразуется в электрическую энергию. Гальванические элементы предназначены для однократного использования в один или несколько приемов.
Рассмотрим гальванический элемент Даниэля-Якоби (рисунок 7.1). Это устройство неудобно для практического использования, но на его примере проще всего разобраться в принципах работы гальванического элемента.
Элемент Даниэля-Якоби состоит из цинкового и медного электродов, погруженных в растворы их солей. Электрод – это электрохимическая система, состоящая из веществ, обладающих различными видами проводимости, например, электронной и ионной, находящихся в контакте друг с другом. В рассматриваемом случае используются металлические электроды. Они представляют собой металлическую пластинку с электронным типом проводимости, контактирующую с раствором электролита, обладающим ионной проводимостью.
 е–
е–





Cu
+
+ +
+ +
+ +
+



Zn
_
_ _
_ _
_ _
_
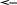 Zn2+ Cu2+
Zn2+ Cu2+
_ _
+ + _ _
+ + _ _
+ + _ _
+ +
ZnSO4 CuSO4
Рисунок 7.1 – Схема гальванического элемента Даниэля-Якоби
При погружении металла в воду или раствор его соли устанавливается равновесие между металлом и раствором:
Меn++nе–⇄Ме. (7.1)
На границе раздела металл–раствор возникает двойной электрический слой, характеризуемый определенной разностью потенциалов, причем величина и знак потенциала металлического электрода зависит от природы металла и концентрации (активности) его ионов в растворе.
Если металл активен (легко отдает электроны) или концентрация его ионов в растворе мала, то равновесие (2.1) устанавливается при более отрицательных значениях потенциала электрода. Если же металл неактивный (с трудом отдает электроны) или концентрация его ионов в растворе велика, то равновесие (7.1) устанавливается при более положительных значениях потенциала электрода. Цинк – более активный металл, чем медь, его равновесный электродный потенциал будет меньше, чем у меди.
Если два электрода соединить между собой металлическим проводником, то электроны будут передвигаться по нему от электрода с меньшим потенциалом, к электроду с большим потенциалом, то есть от цинка к меди. В результате этого равновесие (7.1) на цинковом электроде сместится (по принципу Ле Шателье) влево, в раствор будут переходить все новые и новые количества цинка в виде катионов: Zn→ Zn2++2е–.
На медном электроде в то же самое время равновесие (7.1) сместится вправо: Cu2++2e–→Cu. Дополнительные количества катионов меди из раствора будут разряжаться на медном электроде.
Таким образом, при замыкании внешней цепи будут протекать процессы растворения цинка на цинковом электроде (окисление цинка) и выделение меди на медном электроде (восстановление катионов меди). Токообразующая реакция:
Zn+Cu2+=Cu+Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых они протекают, называют анодами. Процессы восстановления носят название катодных процессов, электроды, на которых они идут, называют катодами. В гальваническом элементе потенциал анода меньше потенциала катода. В нашем примере цинковый электрод является анодом, а медный электрод – катодом.
Для обеспечения самопроизвольной работы гальванического элемента необходимо соединить жидкие среды полуэлементов, то есть замкнуть электрическую цепь внутри гальванического элемента. Для этого пользуются солевым мостиком (электролитическим ключом). Обычно это U-образная трубка, заполненная гелем агар-агара, пропитанным насыщенным раствором хлорида калия. Выбор в качестве электролита хлорида калия обусловлен тем, что катионы калия и анионы хлора обладают большой подвижностью, уступая только Н+ и ОН–.
При работе
гальванического элемента Даниэля-Якоби
у цинкового электрода создается избыток
катионов цинка, а у медного электрода
– дефицит катионов меди, то есть избыток
анионов SO42-.
Это приводит к диффузионной разности
потенциалов
![]() ,
которая препятствует токообразующей
реакции. Благодаря же солевому мостику
в каждом растворе постоянно поддерживается
состояние, близкое к электронейтральному,
так как под действием даже небольшой
величины
катионы калия быстро диффундируют к
медному полуэлементу, а анионы хлора –
к цинковому. Поэтому
далее не возрастает и существенно не
влияет на токообразующую реакцию.
,
которая препятствует токообразующей
реакции. Благодаря же солевому мостику
в каждом растворе постоянно поддерживается
состояние, близкое к электронейтральному,
так как под действием даже небольшой
величины
катионы калия быстро диффундируют к
медному полуэлементу, а анионы хлора –
к цинковому. Поэтому
далее не возрастает и существенно не
влияет на токообразующую реакцию.
В случае
гальванического элемента Даниэля-Якоби
складывается из разности потенциалов
между растворами ZnSO4
и KCl
(![]() )
и разности потенциалов между растворами
KCl
и CuSO4
(
)
и разности потенциалов между растворами
KCl
и CuSO4
(![]() ):
):
=
+
=![]() .
.
В виду высокой
подвижности катионов К+
и анионов
Cl–
потенциалы
![]() и
и
![]() можно считать приблизительно одинаковыми
(хотя и не абсолютно). Тогда
можно считать приблизительно одинаковыми
(хотя и не абсолютно). Тогда
![]() .
.
Таким образом, солевой мостик не устраняет диффузионную разность потенциалов, а делает ее минимальной.
Кроме того, во внутренней цепи гальванического элемента возникают контактные разности потенциалов на границах между металлическими электродами и соединяющими их металлическими проводниками.
Максимальная разность потенциалов между электродами гальванического элемента называется электродвижущей силой гальванического элемента (ЭДС). Ее вычисляют как разность равновесных потенциалов катода и анода:
![]() . (7.2)
. (7.2)
ЭДС определяется суммой всех скачков потенциала во внутренней цепи гальванического элемента, однако ее максимальное значение все-таки не отличается от разности равновесных потенциалов катода и анода, так как сумма всех скачков потенциала гальванического элемента обусловлена только энергией процессов, протекающих на электродах. В отсутствие химической реакции сумма диффузионных скачков потенциала равнялась бы нулю, так как потенциалы растворов CuSO4 и ZnSO4 не отличались бы друг от друга. Их различие создается лишь благодаря тому, что растворы по-разному обмениваются ионами с металлическими пластинками. В отсутствие химической реакции равнялась бы нулю и сумма контактных скачков потенциалов.
Напряжение U на клеммах работающего гальванического элемента, измеренное вольтметром, всегда меньше ЭДС. Это связано с поляризацией электродов (Е) и омическими потерями на внутреннем сопротивлении гальванического элемента (IR) при прохождении электрического тока.
![]() (7.3)
(7.3)
Измерение ЭДС проводят компенсационным методом на специальной установке. Суть этого метода заключается в том, что в момент измерения разности потенциалов электродов ток, проходящий через гальванический элемент, близок к нулю.
Более простой, но менее точный метод измерения ЭДС заключается в прямом измерении напряжения на клеммах гальванического элемента при разомкнутой внешней цепи с помощью вольтметра, имеющего высокое сопротивление. Вследствие высокого сопротивления вольтметра, ток, протекающий через гальванический элемент при измерении, очень мал, поэтому невелика разница между ЭДС элемента и напряжением.
Гальванический элемент будет вырабатывать электрическую энергию до тех пор, пока не разомкнут внешнюю цепь, или пока не израсходуется полностью хотя бы один из реагентов (если не брать в расчет побочных химических и электрохимических процессов, приводящих к саморазряду гальванических элементов).
Гальванические элементы часто записывают схематически, при этом границу раздела между проводником с электронной проводимостью (проводник первого рода) и проводником с ионной проводимостью (проводник второго рода) изображают одинарной чертой; двойной чертой показывают границу раздела между двумя проводниками второго рода; слева записывают символ более отрицательного электрода, а справа – более положительного электрода; полуреакция, протекающая на левом электроде, записывается как окислительная, а полуреакция на правом электроде – как восстановительная. В соответствии с этим схематическая запись для гальванического элемента Даниэля-Якоби выглядит следующим образом:
Zn / ZnSO4 // CuSO4 /Cu или Zn / Zn2+// Cu2+/ Cu.
