
МАТИ-РГТУ имени К. Э. Циолковского
Кафедра: технологии проектирования и эксплуатации летательных аппаратов
Коллоквиум
Растворы неэлектролитов и электролитов
Выполнил:
студент 1 курса,
группы 2АВС-1ДБ-270
Бессонов И.И.
Проверил:
Евдокимов Сергей Васильевич
Москва 2014
1) Способы выражения концентрации растворов
Концентрацию веществ в растворах можно выразить разными способами. На этой страничке вы с ними познакомитесь. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) - молярная масса растворенного вещества г/моль.
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, r - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c · p · 10) / m N = (c · p · 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
2)В чем разница между растворами неэлектролитов и электролитов?
Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. Одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие — нет. В этом можно убедиться с помощью прибора, состоящего из угольных электродов, присоединенных проводами к электрической сети.
2
В цепь включена электрическая лампочка, которая показывает присутствие или отсутствие электрического тока в цепи. Если опустить электроды в раствор сахара, то лампочка не загорается. Если же опустить электроды в раствор поваренной соли, то лампочка ярко вспыхнет. Следовательно, сахар (раствор) — неэлектролит, т.к. не проводит электрический ток, а раствор поваренной соли — электролит, т.к. проводит электрический ток.
3)Как зависит понижение температуры кристаллизации и повышение температуры кипения растворов неэлектролитов от их концентрации?
Понижение давления насыщенного пара растворителя над раствором приводит к повышению температуры кипения и понижению температуры замерзания раствора по сравнению с чистым растворителем.
Согласно первому следствию из закона Рауля повышение температуры кипения и понижение температуры замерзания растворов неэлектролитов прямо пропорционально моляльной концентрации растворенного вещества:
ΔТкип.=ЕСm(2)
ΔТзам..=KСm(2)
где Сm(2)Сm(2) – моляльная концентрация раствора; Е - эбулиоскопическая и К – криоскопическая постоянные, соответствующие повышению температуры кипения и понижению температуры замерзания раствора с Сm(2)=1 моль/1000 г растворителя. Значения Е и К зависят только от природы растворителя.
4)Какую формулу используют для вычисления молекулярной массы растворенного вещества методом криоскопии?
М=Р1․Ек·1000/Р2Δtk, где P1 и P2 — соответственно масса растворённого вещества и растворителя в г. Разность температур Δtк измеряют обычно метастатическим термометром или с помощью термопары. Методом К. могут быть определены значения Ek для веществ с известной молекулярной массой, а также концентрация вещества в растворе.
5)Что такое изотонический коэффициент?
Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
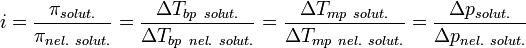 ,
,
3
6
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания).
|
6)Назовите количественные характеристики процесса диссоциации. На какие группы подразделяют электролиты в зависимости от значений константы диссоциации? Количественная характеристика диссоциации электролитов называется степенью диссоциации (обозначение α); для веществ-электролитов всегда больше нуля (α = 0 в случае неэлектролитов). Степень диссоциации может выражаться как в долях от 1, так и в процентах. Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). |
7)Какую зависимость выражает закон разбавления Оствальда? Как, пользуясь этим законом, вычислить степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации?
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:

Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
4
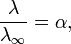
где α — степень диссоциации.
8)Что такое водородный показатель?
Водоро́дный показа́тель, pH (лат. pondus Hydrogenii - сила водорода, произносится «пэ аш», английское произношение — piː'eɪtʃ) — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр:
![]()
9. Вычислите рН растворов: а) 0,05 М НCl; б) 0,05 М CH3COOH; в) 0,05 М NaOH; г) 0,05 М NH4OH
а) pH = 1.3
б) pH = 3.03
в) pH = 12.7
г) pH = 11
10. Чему равна концентрация ионов Н+ в растворе КОН с концентрацией 0,01 моль/л?
[H+] = 10-12
11. Сформулируйте определение произведения растворимости. Напишите формулы для вычисления произведения растворимости по результатам растворимости для малорастворимых веществ различного состава.
Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
ПР малорастворимых электролитов в воде можно рассчитать из формул:
если m:a = 1:1, то Р=; если m : a =2:1 или m:a = 1:2, то Р=
если m : a =3:1 или m:a = 1:3, то Р=
если m : a =3:2 или m:a = 2:3, то Р=
5
12. Какие реакции называют гидролизом? Запишите формулы для определения рН гидролиза солей по катиону и аниону.
Гидролиз — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
рН гидролиза солей:
при гидролизе по катиону рНгидр. = = -
Формула справедлива для солей, при растворении которых Cкатиона=Cсоли
например,AlCl3, ZnSO4, Cu(NO3)2.
Для солей, содержащих в своём составе два катиона, например,
Al2(SO4)3, Fe2(SO4)3, Cr2(SO4)3/.
Cкатиона=2Cсоли; рНгидр. =–lg[H+]=
при гидролизе по аниону рНгидр == 14 +
Формула справедлива для солей, при растворении которых Cаниона=Cсоли,
например, KCN, NaNO2, KF.
Для солей, содержащих в своём составе два аниона, например,
Ba(CN)2, Ca(NO2)2.
Cаниона=2Cсоли; рНгидр. =
13. Как, пользуясь принципом Ле Шателье, можно ослабить гидролиз солей?
Гидролиз можно ослабить, пользуясь этим принципом и действуя следующим образом:
1) увеличить концентрацию растворенного вещества;
2) охладить раствор ( для ослабления гидролиза растворы солей следует хранить концентрированными и при низких температурах);
3) ввести в раствор один из продуктов гидролиза; например, подкислять раствор, если его среда в результате гидролиза кислая, или подщелачивать, если щелочная
6
