
- •Физико-химические методы анализа
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •3 Абсорбционная спектроскопия
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с непересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •Библиографический список
- •1 Хроматографические методы анализа
- •1.1 Теоретические основы
- •1.2 Газожидкостная хроматография
- •1.2.1 Качественный анализ. Идентификация компонентов анализируемой смеси
- •1.2.2 Количественный анализ
- •Метод нормализации площадей
- •Определение калибровочных коэффициентов
- •Метод стандартных добавок
- •1.2.3 Блок-схема газового хроматографа
- •Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
- •2 Электрохимические методы анализа
- •2.1 Кондуктометрический метод анализа
- •2.1.1 Теоретические основы
- •Кондуктометрическое титрование
- •Аппаратура кондуктометрических измерений
- •2.1.3 Методика кондуктометрических измерений
- •2.2 Высокочастотное титрование
- •2.2.1 Теоретические основы
- •2.2.2 Аппаратура для проведения высокочастотного титрования
- •Для высокочастотного титрования
- •2.3 Потенциометрический метод анализа
- •2.3.1 Теоретические основы
- •С использованием ионоселективных электродов:
- •Лабораторная работа № 9 анализ смеси протолитов в неводных средах методом потенциометрического титрования
- •Вопросы к отчету по теме «Потенциометрический метод анализа»
Вопросы к отчету по работе
1 Метод абсорбционной спектроскопии, его сущность и область применения.
2
Электромагнитный спектр, соотношение
между длиной волны (),
частотой ()
и волновым числом (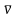 ).
).
3 Спектры поглощения, способы их изображения. Применение спектров поглощения в аналитической химии.
4 Схема простейшего монохроматора, диспергирующая призма и дифракционная решетка.
5 Запись спектров поглощения на однолучевом и двухлучевом спектрофотометре.
6 Качественный и количественный анализ по электронным спектрам поглощения. Закон Ламберта-Бугера-Бера
7 Особенности количественного анализа смесей красителей с пересекающимися и непересекающимися спектрами. Правило аддитивности абсорбций.
5 Пламенная фотометрия
5.1 Теоретические основы
Метод пламенной фотометрии является одним их видов эмиссионной спектроскопии. Он основан на измерении интенсивности излучения, испускаемом анализируемыми элементами в пламени. Чувствительность метода определяется температурой пламени и условиями возбуждения атомов. В качестве источников возбуждения атомов используется пламя различных типов. Средняя температура некоторых наиболее широко распространенных видов источников возбуждения приведена в таблице 5.1.
Таблица 5.1 - Основные источники возбуждения атомов
Источник возбуждения |
Горючий газ |
Окислитель |
Температура, К |
Пламя |
Пропан-бутан |
Воздух |
1700 |
Ацетилен |
Воздух |
2250 |
|
Ацетилен |
Кислород |
3050 |
|
Ацетилен |
Закись азота |
2950 |
|
Вольтовая дуга |
- |
- |
11000 |
Конденсированная искра |
- |
- |
11000 |
Лазерное излучение |
- |
- |
15000 |
Вследствие невысокой температуры пламени горючих смесей, их эмиссионные спектры состоят их небольшого числа спектральных линий и имеют низкие потенциала возбуждения. Это позволяет использовать при анализе фотометры, снабженные интерференционными светофильтрами.
Атомные спектральные линии в пламени излучают щелочные и щелочноземельные металлы, галлий, кадмий, хром, марганец, никель, кобальт, медь, серебро и другие элементы. В настоящее время методом пламенной фотометрии можно определять до 40 элементов.
Набор частот, соответствующий спектру каждого элемента, определяется структурой внешней оболочки атома и, следовательно, положением элемента в таблице Менделеева. Вследствие этого не может быть случаев полного совпадения эмиссионных спектров различных веществ.
Качественный анализ анализируемых веществ основан на наличии в спектре излучения характеристических линий, присущих данному элементу. В пламенной фотометрии качественный анализ проводится с использованием набора светофильтров.
В основе количественного анализа лежит прямо пропорциональная зависимость интенсивности спектральных линий от числа возбужденных частиц, и, следовательно, от концентрации определяемого элемента при постоянных температуре и условиях атомизации. Эта зависимость выражается уравнением Ломакина:
 ,
(5.1)
,
(5.1)
где I – интенсивность спектральной линии; с – концентрация элемента в пробе; a – коэффициент, зависящий от режима работы источника возбуждения; b – коэффициент самопоглощения.
Определяемые элементы поступают в пламя в виде аэрозоля, полученного при распылении анализируемых растворов воздухом в распылительной камере.
В пламени протекает ряд следующих процессов:
Растворитель испаряется или сгорает, а в пламени остаются мельчайшие частицы твердого образца;
Твердые вещества переходят в газообразное состояние (превращаются в пар), то есть образуется атомный пар;
Возбуждение атомов под действием энергии пламени. Возбуждение газообразных атомов связано с переходом одного из электронов в более высокое энергетическое состояние;
В условиях термодинамического равновесия доля возбужденных атомов определяется уравнением Больцмана:
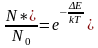 ,
(5.2)
,
(5.2)
где N* – количество возбужденных атомов в пламени; N0 – общее количество атомов в пламени; ΔE – потенциал возбуждения, Дж; k – постоянная Больцмана (k=1,380662 10-22 Дж К); T – абсолютная температура, К.
Согласно уравнению Больцмана, только небольшая часть газообразных атомов переходит в возбужденное состояние и доля возбужденных атомов быстро снижается при возрастании потенциала возбуждения элементов. Например, при одинаковой температуре доля возбужденных атомов натрия в 107 раз превышает долю возбужденных атомов цинка. Вследствие этого для определения цинка требуется более высокая температура. При повышении температуры число возбужденных атомов увеличивается.
Излучение света возбужденными атомами: при возвращении электрона из возбужденного состояния на более низкий энергетический уровень или в основное состояние испускается ультрафиолетовое или видимое излучение. Интенсивность и частота излучения зависят от природы, концентрации анализируемого элемента в растворе. Частота испускаемого излучения зависит от разности энергий двух состояний атома:
 ,
(5.3)
,
(5.3)
где E2 – энергия более высокого возбужденного состояния, Дж; Е1 – энергия более низкого возбужденного или основного состояния, Дж; h – постоянная Планка; ν – частота испускаемого ультрафиолетового или видимого света, Гц; с – скорость света, м/с; λ – длина волны излучаемого света, м.
