
- •Физико-химические методы анализа
- •1 Фотометрический метод анализа
- •1.1 Теоретические основы
- •1.2 Блок-схема фотоколориметра кфк-2
- •1.3 Порядок работы на фотоколориметре кфк-2
- •Лабораторная работа № 1 фотометрический анализ красителей по методу собственного поглощения
- •Вопросы к отчету по теме «Фотометрический метод анализа»
- •Дополнительные вопросы
- •3 Абсорбционная спектроскопия
- •Блок-схема двухлучевого спектрофотометре сф-10
- •3.6 Порядок работы на спектрофотометре сф-10
- •Лабораторная работа № 12 анализ смеси невзаимодействующих красителей с непересекающимися спектрами на двухлучевом спектрофотометре сф-10
- •Вопросы к отчету по работе
- •5 Пламенная фотометрия
- •5.1 Теоретические основы
- •5.2. Схема пламенного фотометра
- •Вопросы к отчету по лабораторной работе
- •Дополнительные вопросы
- •Библиографический список
- •1 Хроматографические методы анализа
- •1.1 Теоретические основы
- •1.2 Газожидкостная хроматография
- •1.2.1 Качественный анализ. Идентификация компонентов анализируемой смеси
- •1.2.2 Количественный анализ
- •Метод нормализации площадей
- •Определение калибровочных коэффициентов
- •Метод стандартных добавок
- •1.2.3 Блок-схема газового хроматографа
- •Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
- •2 Электрохимические методы анализа
- •2.1 Кондуктометрический метод анализа
- •2.1.1 Теоретические основы
- •Кондуктометрическое титрование
- •Аппаратура кондуктометрических измерений
- •2.1.3 Методика кондуктометрических измерений
- •2.2 Высокочастотное титрование
- •2.2.1 Теоретические основы
- •2.2.2 Аппаратура для проведения высокочастотного титрования
- •Для высокочастотного титрования
- •2.3 Потенциометрический метод анализа
- •2.3.1 Теоретические основы
- •С использованием ионоселективных электродов:
- •Лабораторная работа № 9 анализ смеси протолитов в неводных средах методом потенциометрического титрования
- •Вопросы к отчету по теме «Потенциометрический метод анализа»
Вопросы к отчету по лабораторной работе: «Качественный и количественный анализ многокомпонентных смесей углеводородов методом газо-жидкостной хроматографии»
Теоретические основы и области применения хроматографии. Классификация хроматографических методов.
Газо-жидкостная хроматография, теоретические основы и область её применения.
Блок-схема газо-жидкостного хроматографа.
Качественный и количественный анализ в газо-жидкостной хроматографии.
Приёмы количественного хроматографического анализа: метод нормализации площадей, метод внутреннего стандарта, метод добавок, метод абсолютной калибровки.
Детектирование в газо-жидкостной хроматографии. Устройство и принципы действия детектора катарометра и пламенно-ионизационного детектора.
Механизм разделения компонентов в хроматографии. Закон распределения Нернста.
2 Электрохимические методы анализа
2.1 Кондуктометрический метод анализа
2.1.1 Теоретические основы
Электропроводность раствора электролита G и его концентрация С связаны между собой функциональной зависимостью. При низких концентрациях
 ,
(2.1)
,
(2.1)
где k – некоторая постоянная величина.
Для правильного построения методики кондуктометрического анализа необходимо знать электрические свойства растворов, термины, определения, физико-химические основы переноса зарядов в электролитах, причины нелинейности электропроводности [3].
Электропроводность
растворов в системе СИ G
измеряется в сименсах (См). Различают
удельную χ
 и
эквивалентную λ электропроводность
раствора. Удельная электропроводность
См/см или Ом-1·см-1
– электропроводность 1 см3
раствора, находящегося между электродами
площадью 1 см2
каждый, расстояние между которыми равно
1 см. Эквивалентная электропроводность
– электропроводность слоя электролита,
содержащего 1 эквивалент вещества,
измеренная при расстоянии между
электродами 1 см. Удельная и эквивалентная
электропроводность связаны соотношением
и
эквивалентную λ электропроводность
раствора. Удельная электропроводность
См/см или Ом-1·см-1
– электропроводность 1 см3
раствора, находящегося между электродами
площадью 1 см2
каждый, расстояние между которыми равно
1 см. Эквивалентная электропроводность
– электропроводность слоя электролита,
содержащего 1 эквивалент вещества,
измеренная при расстоянии между
электродами 1 см. Удельная и эквивалентная
электропроводность связаны соотношением
 ,
,
где С – молярная концентрация эквивалента, моль/дм3 .
Эквивалентная электропроводность – аддитивная величина, которая выражается соотношением
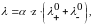
где α – степень диссоциации;
z – заряд иона;
 и
и
 - подвижности положительных и отрицательных
ионов.
- подвижности положительных и отрицательных
ионов.
В
свою очередь,
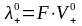 ;
;
 ,
где F
– число Фарадея,
,
где F
– число Фарадея,
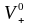 и
и
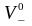 – абсолютные скорости движения ионов
(в см/с) в поле напряженностью 1 В/см. В
таблице 2.1 приведены подвижности ионов
в водных растворах при бесконечном
разбавлении при t=25˚С.
– абсолютные скорости движения ионов
(в см/с) в поле напряженностью 1 В/см. В
таблице 2.1 приведены подвижности ионов
в водных растворах при бесконечном
разбавлении при t=25˚С.
Таблица 2.1 - Подвижности ионов в водных растворах
при бесконечном разбавлении при t=25˚С
Катионы |
|
Анионы |
|
H+ |
349,9 |
OH- |
198,4 |
K+ |
73,5 |
Cl- |
76,4 |
Na+ |
50,1 |
Br- |
78,2 |
Li+ |
38,7 |
J- |
76,8 |
½ Ca2+ |
59,5 |
NO3- |
71,5 |
½ Mn2+ |
53,8 |
CH3COO- |
40,9 |
½ Zn2+ |
53,5 |
H2PO4- |
36,0 |
NH4+ |
73,5 |
½ SO42- |
80,0 |
Подвижности ионов определяют значение k в (2.1) и вид кривых титрования.
Измерение электропроводности растворов и величин, связанных с электропроводностью, лежит в основе кондуктометрического метода анализа. Метод реализуется двумя вариантами применения.
Прямая кондуктометрия, основанная на измерении электропроводности растворов по уравнению (2.1). Аналитическим сигналом является G, а k – коэффициент чувствительности.
В данном методе необходимо знать функциональную зависимость G от C. Ее устанавливают, измеряя электропроводность стандартных растворов с известными концентрациями, и выражают в виде калибровочной характеристики: в виде графика, таблицы или информации, введенной в ЭВМ.
Кондуктометрическое титрование, в котором по изменению электропроводности анализируемого раствора определяют точку эквивалентности.
В кондуктометрическом титровании вид функциональной зависимости не имеет существенного значения, важен перелом на кривой кондуктометрического титрования, соответствующий точке эквивалентности.
Измерение электропроводности растворов
(прямая кондуктометрия)
Благодаря простоте аппаратурного оформления, возможности определения электропроводности в мутных, окрашенных и вязких растворах кондуктометрия широко применяется в химических лабораториях и на производстве. С помощью кондуктометрии можно быстро и с малыми погрешностями простым измерением электропроводности найти концентрацию раствора. С помощью кондуктометрического метода определяют также растворимость, константу и степень диссоциации и другие важные физико-химические свойства электролитов. Типичная калибровочная кривая изображена на рисунке 2.1, стрелками показан способ нахождения концентрации. Точками отмечены измерения электропроводности стандартных растворов. Начальная часть графика представляет собой прямую линию, выходящую из начала координат (при учете собственной электропроводности растворителя).

моль/дм3
Рисунок 2.1 – Калибровочная кривая метода прямой кондуктометрии
