- •Дисперсные системы
- •Классификация дисперсных систем:
- •Методы получения коллоидных систем (Методическое руководство к практикуму по общей химии, стр.161-163).
- •3.А. Получение суспензий.
- •3.Б. Получение эмульсий.
- •Методы очистки коллоидных систем.
- •Образование, строение и заряд коллоидной частицы. Формула мицеллы. Строение двойного электрического слоя. Электрокинетический потенциал.
- •Свойства коллоидных систем:
- •Высокомолекулярные соединения
- •Классификация вмс
- •Особенности растворения вмс как следствие их структуры. Механизм набухания и растворения вмс.
- •Стадии набухания
- •Зависимость величины набухания от различных факторов.
- •Аномальная вязкость растворов вмс.
- •Осмотическое давление растворов вмс. Уравнение Галлера
- •Изоэлектрическая точка и методы ее определения иэт или pI.
- •Методы определения иэт:
- •Мембранное равновесие Доннана.
Зависимость величины набухания от различных факторов.
Величина набухания ВМС зависит от:
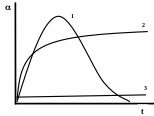
– природы ВМС. У жестких полимеров (с большим числом поперечных связей между цепями) степень набухания невелика – ограниченное набухание. При уменьшении числа поперечных связей набухание неограниченное. Оно плавно переходит в растворение. На рис. 6 зависимость набухания в бензоле от жесткости полимерных цепей.
– природы растворителя. Полярные полимеры набухают в полярных жидкостях (белок в воде), неполярные – в неполярных (каучук в бензоле).
– температуры. Повышение температуры ускоряет набухание, но уменьшает степень набухания. Ограниченное набухание желатина в холодной воде сменяется неограниченным в горячей.
– давления. Увеличение внешнего давления вызывает увеличение степени набухания.
– присутствия посторонних веществ, особенно электролитов. Возрастание жесткости кислоты или основания подавляет набухание.
– рН среды. Влияние рН среды на набухание особенно значительно для амфотерных полиэлектролитов (к ним относятся важнейшие биополимеры — белки и нуклеиновые кислоты). Степень набухания белка минимальна в изоэлектрической точке.
– формы и степени измельченности образца.
|
Рис. 3. Зависимость набухания () в бензоле полимерных цепей различной жесткости от времени. 1 – неограниченное растворение (натуральный каучук); 2 – ограниченное растворение (резина); 3 – практически не растворяется (эбонит).
|
Аномальная вязкость растворов вмс.
Растворы ВМС не подчиняются законам Ньютона, Пуазейля, Эйнштейна.
Уравнение Штаудингера связывает молекулярную массу и характеристическая вязкость:
ηхар. = КМα , где η (эта) – коэффициент вязкости, характеристическую вязкость;
К – коэффициент пропорциональности, определяется экспериментально;
М – молекулярная масса ВМС;
α – показатель степени, ½ ≤ α ≤ 1. α зависит от формы макромолекул, определяется экспериментально. ½ – гибкие (глобулы), 1 – жесткие (палочки).
Для измерения вязкости растворов ВМС можно использовать методы капиллярного истечения жидкости (с помощью вискозиметра), падающего шарика (метод Стокса) и вращающихся цилиндров.
Осмотическое давление растворов вмс. Уравнение Галлера
Экспериментально определенное осмотическое давление для растворов многих ВМС данной концентрации значительно превышает вычисленное по уравнению Вант-Гоффа: = СRT, причина в высокой подвижности фрагментов ВМС, одна макромолекула по влиянию на осмотическое давление ведет себя как несколько молекул меньшего размера. Для расчета осмотического давления растворов ВМС применяют уравнение Галлера:
|
γ – массовая концентрация раствора ВМС, г/л; М – молярная масса ВМС, г/моль; – коэффициент, учитывающий гибкость и форму макромолекул в растворе. |
Осмометрический метод применяется при определении молярной массы полимеров.
Онкотическое давление плазмы крови. Онкотическое давление крови – часть осмотического давления, создаваемая растворенными в ней белками (альбумины, глобулины). Доля онкотического давления составляет 0,5% от суммарного осмотического давления. В артериальной части капилляров гидростатическое давление больше онкотического, в венозной меньше (рис. 7 ).
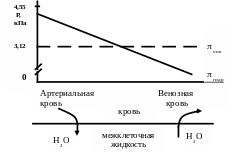
Рис. 4. Осмотическое равновесие
В артериальной части тканевых капилляров гидростатическое давление крови способствует, а онкотическое давление крови препятствует выходу воды из крови. В венозной части капилляров происходит осмос воды из ткани в кровь. Онкотическое давление способствует, а гидростатическое давление препятствует вхождению воды в кровь.