
- •Курс физики и биофизики
- •Введение
- •I.Поступательное движение
- •1. Кинематика поступательного движения.
- •2.Скорость поступательного движения
- •Динамика поступательного движения
- •1.Основные законы динамики
- •Закон изменения импульса
- •Закон сохранения импульса
- •Вес тела и невесомость
- •Работа и мощность
- •6. Энергия системы
- •7. Особенности движения тела в условиях невесомости.
- •II. Вращательное движение
- •Кинематика вращательного движения
- •1. Угловая скорость
- •2. Линейная скорость
- •3. Угловое ускорение
- •2. Момент инерции
- •3 Кинетическая энергия вращательного движения
- •4. Основной закон динамики вращательного движения
- •5. Закон изменения момента импульса
- •6. Закон сохранения момента импульса
- •III. Колебательное движение
- •Гармонические колебания
- •2. Основные характеристики гармонического колебания
- •7. Математический маятник
- •Сложение гармонических колебаний, происходящих по однойпрямой с одинаковой частотой
- •Сложение гармонических колебаний с кратными частотами
- •10. Затухающие колебания
- •11. Вынужденные колебания
- •12. Механический резонанс
- •Колебательные процессы в природе
- •IV. Волны
- •Поперечные и продольные волны
- •Уравнение плоской гармонической волны
- •3. Интенсивность плоской волны или плотность потока энергии
- •V. Акустика
- •1. Природа звука
- •2. Интенсивность звуковой волны
- •Звуковой резонанс
- •Характеристики слухового ощущения
- •Закон Вебера-Фехнера
- •6. Шкала единиц для интенсивности звука
- •Кривые равные громкости
- •Ультразвук и инфразвук
- •9. Физические основы измерения звуковых колебаний вклинике (звуковые методы исследований)
- •VI. Молекулярно – кинетическая теория (мкт)
- •1. Основные положения мкт:
- •Газовые законы для идеального газа
- •2. Основные уравнения мкт
- •3. Понятие о степенях свободы
- •Внутренняя энергия идеального газа
- •Работа газа в изопроцессах
- •5. Реальные газы
- •VII. Гидродинамика. Гемодинамика
- •Идеальная жидкость
- •Уравнение Бернулли
- •3. Течение реальной жидкости. Формула Ньютона
- •4. Физические свойства крови
- •5. Виды течения жидкости
- •Закон Гагена-Пуазейля
- •Модели сердечно-сосудистой системы
- •8. Пульсовые волны
- •9. Работа сердца
- •VIII. Реальные среды (жидкости и твердые тела)
- •1. Основные свойства жидкостей
- •2. Поверхностное натяжение жидкости
- •3. Дополнительное (Лапласовское) давление жидкости
- •4. Капиллярные явления
- •5. Газовая эмболия
- •6. Виды твердых тел
- •7. Закон Гука
- •8. Механические свойства биологических тканей
- •Моделью вязко-упругих свойств является параллельно соединенные этиэлементы, а для упруго-вязких – последовательное соединение:
- •IX. Термодинамика
- •1. Основные определения
- •2. Термодинамические системы
- •3. Первое начало термодинамики
- •4. Применение первого начала термодинамики к биологическим системам
- •Приведенная теплота и энергия
- •6. Второе начало термодинамики
- •7. Живой организм как открытая термодинамическая система
- •X.Электростатика
- •1. Электрическое поле
- •3. Потенциальная энергия электрического поля
- •4. Электроемкость
- •5. Проводники и диэлектрики в электрическом поле
- •Проводники:
- •Диэлектрики:
- •6.Поляризация диэлектриков
- •XI. Электрический ток
- •2. Правила Кирхгофа
- •3. Работа и мощность тока
- •4. Переменный электрический ток
- •Общее сопротивление переменному току
- •XII. Элементы электроники
- •Полупроводниковые электронные устройства
- •1. Полупроводниковый диод
- •Полупроводниковый триод
- •XIII. Постоянное магнитное поле
- •1. Магнитное поле
- •2. Взаимодействие магнитных полей двух токов в параллельных проводниках
- •3. Вещества парамагнитные, ферромагнитные и диамагнитные
- •XIV. Электромагнетизм
- •Опыты Фарадея
- •Направление тока эми
- •Основное уравнение эми
- •Самоиндукция
- •Токи замыкания и размыкания
- •Энергия магнитного поля
- •Вихревые токи
- •Электронно-лучевая трубка
- •XV.Действие электромагнитных полей, электрических токов на биообъекты
- •1.Действие на биоткани переменных высокочастотных токов. Диатермия.
- •2.Действие на биоткани переменного электрического поля ультравысокой частоты. Увч-терапия
- •Действие переменного высокочастотного магнитного поля. Индуктотермия
- •Воздействие на биологическиеткани электромагнитными волнами
- •5. Чувствительность живых существ к электромагнитным полям
- •Действие электрических токов на биологические структуры
- •1. Действие постоянного тока
- •2. Действие импульсных токов
- •3.Действие переменного тока на живые ткани
- •4. Эквивалентные электрические схемы моделирования биологических структур
- •5. Реография
- •XVI. Физические процессы в биологическихмембранах
- •1. Структура и свойства биологических мембран
- •Транспорт веществ через клеточные мембраны
- •2. Общее уравнение переноса
- •3. Электродиффузионное уравнение переноса
- •4. Пассивный и активный транспорт
- •Натрий-калиевый насос
- •5. Мембранный потенциал – φм
- •1)Потенциал покоя
- •2) Потенциал действия
- •6. Осмос
- •XVII. Волновые свойства света
- •1. Интерференция волн
- •2 . Интерференция света
- •3. Интерференция в природе
- •4. Интерференция на тонкой пленке
- •Интерферометр
- •5. Дифракция волн и света
- •Дифракционная решетка
- •Поляризация волн
- •Поляризация света
- •7. Интенсивность волны
- •8. Двойное лучепреломление
- •9. Оптически активные вещества
- •10. Дисперсия света
- •XVIII. Квантовые свойства света
- •1. Двойственность (дуализм) природы света
- •2. Постулаты Бора
- •3.Энергетические уровни атома
- •4. Виды излучения
- •Правило Стокса по фотолюминесценции
- •Применение люминесцентного анализа
- •XIX.Лазеры
- •Свойства лазерного излучения
- •XX. Тепловое излучение
- •Основные характеристики теплового излучения.
- •Абсолютно черное тело
- •Закон Кирхгофа
- •Закон Стефана-Больцмана
- •Закон Вина
- •Формула Планка
- •Инфракрасное излучение (ик)
- •Ультрафиолетовое излучение (уф)
- •XXI. Рентгеновское излучение
- •Биологическое действие рентгеновского излучения.
- •XXII. Ядро атома. Радиоактивность Состав ядра
- •Ядерные силы
- •Модели атомных ядер
- •Энергия связи
- •Радиоактивность
- •Основной закон радиоактивности распада.
- •Виды распадов
- •XXIII. Дозы излучения
- •XXIV. Элементы квантовой механики
- •XXV. Бионика
- •Введение в лабораторный практикум
- •1. Подготовка к выполнению лабораторной работы
- •2. Понятия об измерении и погрешностях измерения
- •3. Погрешности прямых измерений
- •4. Элементы теории погрешностей
- •5. Порядок вычисления погрешностей прямого измерения
- •6. Точность вычисления
- •7.Правила построения графиков
- •8. Контрольные задания для построения графиков
- •9. Основные правила техники безопасности при работе в лабораториях физики
- •Заключение
- •Рекомендуемая литература
- •Краткий справочник по физике Фундаментальные константы
- •Система единиц Приставки Си
- •Механика Кинематика:
- •Уравнение состояния:
- •Броуновское движение:
- •Распределение в потенциальном поле:
- •Термодинамика:
- •Тепловой баланс:
- •Тепловое расширение:
- •Тепловые машины:
- •Электрические и электромагнитные явления Электростатика:
- •Электродинамика. Постоянный ток:
- •Законы электролиза:
- •Электромагнетизм
- •Пространственно-энергетический параметр
Газовые законы для идеального газа
Идеальный газ – это такой газ, в котором расстояние между молекулами (или атомами) много больше их размеров, поэтому в таком газе, в основном, проявляются только силы отталкивания, а силы притяжения очень малы.
Первоначально, экспериментальным путем, были открыты следующие законы:
Закон Бойля-Мариотта.Изотермический процесс (T=cons)
![]()
где Р- давление;ʋ - объем.
Закон Гей-Люссака. Изобарический процесс, давление постоянно (
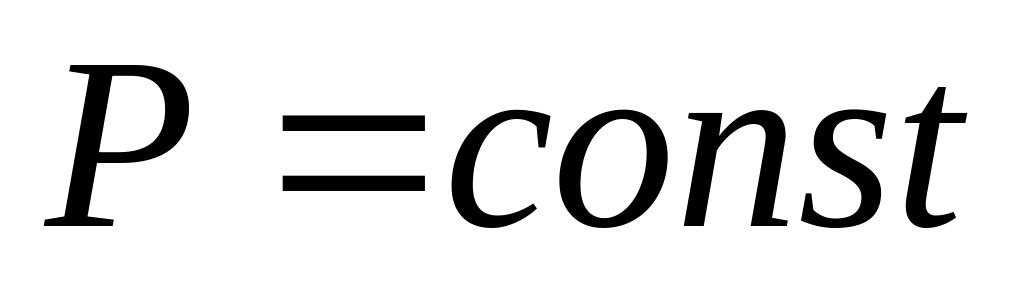 ):
):
![]()
Закон Шарля – для изохорических процессов (
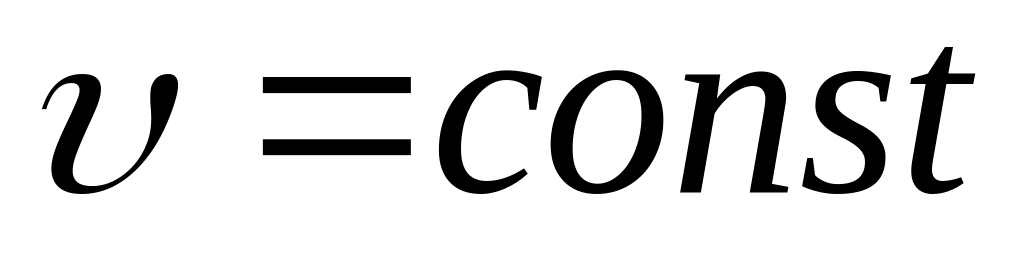 )
)
![]()
Далее Клапейрон объединил эти законы и установил:
![]() -
постоянная величина, зависящая от массы
и природы вещества.
-
постоянная величина, зависящая от массы
и природы вещества.
Менделеев предложил рассматривать этот закон для одного моля:
![]()
где
![]() -
универсальная газовая постоянная.
-
универсальная газовая постоянная.
В одном моле каждого вещества (газа) содержится одно и то же число молекул. Это число называется числом Авогадро.
NA- число Авогадро; NA=6,021023 моль-1
Для всей массы газа уравнение принимает вид:
![]() .
.
Здесь:![]() ;
;
![]() ;
;
где ν- число молей; m - масса газа; N - число всех молекул; ʋ - объем;
![]() -
молярная масса,
-
молярная масса,
![]() - число Авогадро.
- число Авогадро.
Или:![]()
![]()
Эти уравнения называются уравнениями состояния идеального газа.
2. Основные уравнения мкт
Идеальным газом называют газ, молекулы которого не взаимо-действуют на расстоянии, но испытывают упругие столкновения.
Давление газа обусловлено тепловым движением его молекул и проявляется благодаря ударам молекул о стенки.
Основное уравнение молекулярно-кинетической теории идеального газа утверждает, что давление газа (Р) прямо пропорционально средней кинетической энергии (Wi) поступательного движения молекул и их концентрации (n):
Р
=
![]() nWi.
nWi.
Средняя кинетическая энергия поступательного движения молекул идеального газа пропорциональна термодинамической температуре (Т) и зависит только от нее:
Wi=![]() КТ,
КТ,
где к = 1,3810-23 Дж/К – постояннаяБольцмана.
Из основного уравнения кинетической теории идеального газа следуют опытные законы:
PV = const – закон Бойля-Мариотта;
V/V0 = Т/Т0; Р/Р0 = Т/Т0 – законы Гей-Люссака и Шарля.
3. Понятие о степенях свободы
Число степеней свободы - это наименьшее число независимых координат, необходимых для описания всех возможных движений системы.
В общем случае, число степеней свободы складывается из трех движений - поступательного, вращательного и колебательного.
і=іn+іb+2іk,
где i - общее число степеней свободы;
in- число степеней свободы поступательного движения;
ib- число степеней свободы вращательного движения;
ik– число степеней свободы колебательного движения.
Цифра «2» пред іkозначает, что при колебательных движениях учитывается как кинетическая, так и потенциальная энергия движений.
Для идеального газа его энергия состоит только из кинетической энергии поступательного и вращательного движений, поэтому в степенях свободы есть только два члена для поступательного и вращательного движений:
і= іn+ іb
Примеры: материальная точка имеет только три степени свободы поступательного движения в соответствии с тремя осями координат, а вращательное движение не меняет её положение.
Твердое тело имеет шесть степеней свободы - три поступательного и три вращательного движений.
Колесо вагона имеет 2 степени свободы (поступательного и вращательного движений). Шар на горизонтальной плоскости имеет 5 степеней свободы - 2 поступательного и 3 вращательного движений.
По Больцману на каждую степень свободы приходится, в среднем, одинаковая энергия и в общем случае кинетическая энергия равна:
W=![]() ,
,
где W- кинетическая энергия;
і - число степеней свободы;
k - постоянная Больцмана;
Т - термодинамическая температура.
1) Одноатомная молекула - (i=3), подобно материальной точке имеет только 3 степени свободы поступательного движения. Вращательное движение не меняет её положение в пространстве.Для неё:
W=
![]() kT.
kT.
2) Двухатомная молекула имеет 3 поступательных и 2 вращательных степеней свободы.
i=3(п)+2(в)=5
У нее нет вращательного движения вдоль оси симметрии между атомами. В этом случае:
W=
![]() kT.
kT.
3) Трехатомные и более (многоатомные) молекулы имеют:i=3+3=6 степеней свободы.
Поэтому
у них: W=
![]() kT=
3kT.
kT=
3kT.
