
- •Цель работы.
- •Введение.
- •Теоретические основы. Электродные реакции и термодинамика процесса электролиза.
- •Кинетика электродных процессов.
- •Основные технологические показатели электролиза. Выход по току.
- •Удельный расход электроэнергии.
- •Коэффициент использования электроэнергии.
- •Конверсия сырья.
- •Выбор оптимального технологического режима. Состав электролита.
- •Температура.
- •Плотность тока.
- •Материал электродов.
- •Диафрагма.
- •Описание экспериментальной установки. Описание экспериментальной установки.
- •Проведение опыта. Исходные данные:
- •Предварительные расчёты:
- •Порядок выполнения работы:
- •Экспериментальные данные.
- •Контроль процесса. Определение концентрации щёлочи в католите.
Общая химическая технология. Лаб.2.2. Электролиз. С-41, Черкасов Д.С., 2011/12 гг
Лабораторная работа 2.2
Электрохимическое получение гидроксида натрия, хлора и водорода диафрагменным методом.
Цель работы.
Ознакомление с основными закономерностями протекания электролиза в диафрагменной ванне непрерывного действия, особенностями расчёта основных технологических показателей и составлением материального баланса электрохимического процесса.
Введение.
Основным промышленным способом одновременного получения гидроксида натрия, хлора и водорода является электролиз водного раствора хлорида натрия. Есть два параллельных производства нгидроксида натрия:
С использованием жидкого ртутного катода (амальгамный метод);
С использованием твёрдого катода (диафрагменный катод).
Католит – электролит, находящийся в катодном пространстве; анолит – в анодном пространстве.
Диафрагменный способ прост в аппаратурном оформлении, относительно дешёвый и не использует ртуть; но гидроксид натрия, получаемый при использовании электролизёра диафрагменного типа, не обладает достаточной чистотой и в ряде случаев не применим.
Теоретические основы. Электродные реакции и термодинамика процесса электролиза.
Электролиз концентрированного раствора хлорида натрия – сложный гетерогенный процесс, протекающий на границе раздела фаз: твёрдый электрод – жидкий электролит – газ.
Процесс может быть описан брутто-формулой:

В реальных условиях получения гидроксида натрия в ванне диафрагменного типа протекают следующие основные электродные реакции:
на катоде – выделение водорода (восстановление):
![]()
на аноде – выделение хлора (окисление):
![]()
Вероятность протекания электродных реакций можно оценить по величине стандартного электродного потенциала (Е0).
Таблица 1. Электродные реакции и потенциалы разряда ионов.
№ |
Электродная реакция |
Потенциала разряда, В |
||
Стандартный, Е0 |
Равновесный, Ер |
В условиях электролиза, Е |
||
1 |
|
+1,36 |
+1,32 |
+1,57 |
2 |
|
+0,40 |
+0,82 |
+1,91 |
3 |
|
-2,71 |
-2,72 |
-2,72 |
4 |
|
0,00 |
-0,41*) |
-1,13 |
*) При выделении водорода из щелочного раствора ЕН+р =-0,83 В |
||||
При стандартных условиях (платиновый электрод) на катоде наиболее вероятно выделение водорода, а на аноде – кислорода в результате разрядки гидроксоаниона. Выделение металлического натрия на твёрдом электроде невозможно, т.к. поскольку реакция (3) имеет большой отрицательный потенциал. В кислой среде возможно совместное получение хлора и водорода (1, 2), т.к. их потенциалы близки.
В условиях, отличных от стандартных, электродный потенциал называют равновесным (Ер) и рассчитывают по уравнению Нернста:
![]()
где E0 – величина стандартного электродного потенциала, В;
R – универсальная газовая постоянная, равная 8,315 Дж/моль*К;
T – температура, К;
n – число электронов, участвующих в электродной реакции;
F – число Фарадея, равное 96500 Кл (или 26,8 А/ч) на моль;
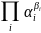 – произведение активности или концентраций
(парциальных давлений) веществ, участвующих
в электродной реакции, равных
стехиометрическим коэффициентам (с
учётом знака βi), по
форме совпадающее с константой равновесия;
– произведение активности или концентраций
(парциальных давлений) веществ, участвующих
в электродной реакции, равных
стехиометрическим коэффициентам (с
учётом знака βi), по
форме совпадающее с константой равновесия;
[Ox] – концентрация окисленной формы вещества;
[Red] – концентрация восстановленной формы вещества.
Второе слагаемое уравнения учитывает отклонение от стандартных условий температуры и активности ионов.
Равновесный потенциал характеризует термодинамическое равновесие, устанавливающееся без протекания тока.
В случае выделения на катоде водорода (4) равновесный электродный потенциал равен:

При выделении хлора на аноде (1):
![]()
Откуда следует, что равновесие может быть смещено в требуемую сторону с помощью изменения температуры, активности ионов (Н3О+ или Cl-) исходных реагентов и парциальных давлений конечных продуктов [p(H2) и p(Cl2)]. При этом может поменяться последовательность в ряду потенциалов.
Практический потенциал (Е) отличается от равновесного на величину перенапряжения:
![]()
где ε – потенциал перенапряжения на аноде или катоде. Потенциал анода становится более положительным, а потенциал катода – более отрицательным.
В реальных условиях на одном и том же электроде могут протекать несколько параллельных электродных реакций. Варьируя условия электролиза (Т, С, материал анода) можно, меняя перенапряжение, ускорить процесс выделения хлора по сравнению с выделением кислорода, чего и добиваются в реальных условиях.
Одновременно с основной реакцией в объёме электролита и на электродах могут протекать вторичные побочные реакции. В анодном пространстве выделяющийся хлор может растворяться в электролите и взаимодействовать с водой, образуя соляную и слабодиссоциирующую хлорноватистую кислоты:
![]()
В случае проникновения гидроксид-ионов из катодного пространства в анодное образуются хорошо диссоциирующие хлорид и гипохлорит натрия:

Суммарная реакция образования гипохлорита:
![]()
Кроме того, гипохлорит может диспропорционировать:
![]()
Образующийся кислород может взаимодействовать с графитовым анодом:
![]()
Побочные электродные процессы:

В оптимальных условиях побочные процессы составляют 3-5%, но эти реакции существенно снижают качество и выход продуктов при нарушении технологических режимов, а также вызывают разрушение диафрагмы.


