
- •Содержание
- •Примерный тематический план практических занятий
- •1 Основные понятия и определения термодинамики. Идеальный газ
- •1.1 Примеры решения задач
- •1.2 Задачи для самостоятельного решения
- •2 Анализ процессов идеальных газов
- •2.1 Примеры решения задач
- •2.2 Задачи для самостоятельного решения
- •3 Второй закон термодинамики
- •4 Реальные газы и пары
- •4.1 Примеры решения задач
- •4.2 Задачи для самостоятельного решения
- •5 Течение, истечение и нагнетание газов и паров
- •5.1 Примеры решения задач
- •5.2 Задачи для самостоятельного решения
- •6 Газовые циклы
- •6.1 Примеры решения задач
- •6.2 Задачи для самостоятельного решения
- •7 Паровые циклы
- •7.1 Примеры решения задач
- •7.2 Задачи для самостоятельного решения
- •8 Теплопроводность, закон Фурье. Теплопровоность плоских и цилиндрических стенок
- •8.1.Примеры решения задач
- •8.2 Задачи для самостоятельного решения
- •9 Подобие и моделирование процессов конвективного теплообмена
- •9.1 Примеры решения задач
- •9.2 Задачи для самостоятельного решения
- •10 Теплоотдача при свободном движении жидкости
- •10.1 Примеры решения задач
- •10.2 Задачи для самостоятельного решения
- •11 Теплообмен при вынужденном движении
- •11.1 Примеры решения задач
- •11.2 Задачи для самостоятельного решения
- •12 Теплообмен излучением
- •12.1 Примеры решения задач
- •12.2 Задачи для самостоятельного решения
- •13 Сложный теплооб мен
- •13.1 Примеры решения задач
- •13.2 Задачи для самостоятельного решения
- •14 Теплообменные аппараты
- •14.1 Примеры решения задач
- •14.2 Задачи для самостоятельного решения
- •Список использованной и рекомендуемой литературы
2.2 Задачи для самостоятельного решения
Задача 2.2.1 В изохорном процессе температура окиси углерода массой m = 2,1 кг с начальным давлением p1 = 0,12 МПа изменяется от t1= 25оС до t2=63оС. Определить параметры состояния рабочего тела в точках 1 и 2, а также теплоту, энтальпию и изменение внутреней энергии 1 кг окиси углерода в процессе. Принять ср = 1,0464 кДж/кг∙К, =296,8 кДж/кг∙К. Изобразить процесс в vр- и sT-диаграммах.
Ответ:
![]() К;
К;
![]() м3/кг;
м3/кг;
![]() К;
К;
![]() 0,735
м3/кг;
0,735
м3/кг;
![]() ;
;![]() ;
;![]() кДж/кг.
кДж/кг.
Задача 2.2.2 Воздух массой m = 1,9 кг с начальным давлением p1 =0,22 МПа адиабатно расширяется. При этом его температура изменяется от t1 =65 оС до t2 =21оС. Определить параметры состояния рабочего тела в точках 1 и 2, а также теплоту, энтальпию и изменение внутреней энергии 1 кг азота в процессе. Принять ср = 1,0121 кДж/кг∙К, =287 кДж/кг∙К.
Представить процесс в vр- и sT-диаграммах.
Ответ:
![]() К;
К;
![]() м3/кг;
м3/кг;
![]() К;
0,54
м3/кг;
К;
0,54
м3/кг;
![]() ;
;![]() ;
;
![]() кДж/кг;
кДж/кг;
![]() =
- 44,53 кДж/кг.
=
- 44,53 кДж/кг.
3 Второй закон термодинамики
Задача 3.1 Сухой воздух массой 1 кг совершает прямой термодинамический цикл, состоящий из четырех последовательных термодинамических процессов.
Заданные
параметры для воздуха:
![]() МПа,
МПа,
![]() 300
К,
300
К,
![]() МПа,
МПа,
![]() =
273 К. Процессы: 1-2 -
=
273 К. Процессы: 1-2 -
![]() ;
2-3 -
;
2-3 -![]() ;
3-4 -
;
4-1 -
;
3-4 -
;
4-1 -
![]() .
.
Требуется:
1. Рассчитать давление Р, удельный объем v, температуру воздуха Т для основных точек цикла.
2.
Для каждого из процессов определить
значения показателей политропы n,
теплоемкости c, вычислить изменение
внутренней энергии
![]() ,
энтальпии
,
энтальпии
![]() ,
энтропии
,
энтропии
![]() ,
теплоту процесса q,
работу процесса
,
теплоту процесса q,
работу процесса
![]() ,
располагаемую работу
,
располагаемую работу
![]() .
.
3. Определить суммарные количества подведенной q1 и отведенной q2 теплоты, работу цикла ц, термический КПД цикла t.
4. Построить цикл в vP - и sT - координатах.
Принять
газовую постоянную
![]() 287,3
Дж/(кгК), теплоемкость при постоянном
давлении
287,3
Дж/(кгК), теплоемкость при постоянном
давлении
![]() =1,025
кДж/(кгК), что соответствует свойствам
сухого воздуха при Т=273 К.
=1,025
кДж/(кгК), что соответствует свойствам
сухого воздуха при Т=273 К.
Решение.
1. Определим параметры в характерных точках.
Точка
1.
![]() К.
К.
Точка 2. Процесс 1-2 – адиабатный
Показатель
адиабаты:![]() ;
;
![]() кДж/(кгК)
кДж/(кгК)
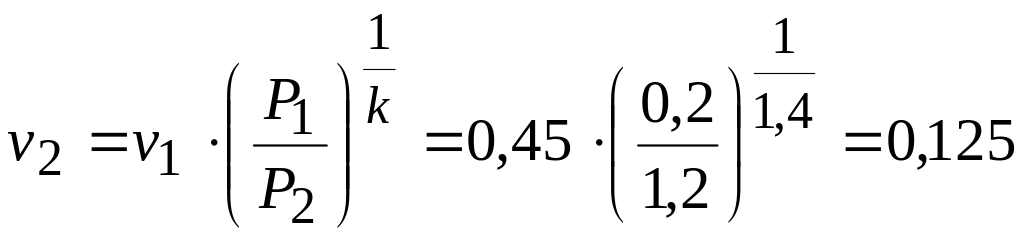 м3/кг.
м3/кг.
 К.
К.
Точка
3. Процесс 2-3 – изохорный =>
![]() =0,125
м3/кг.
=0,125
м3/кг.
![]() МПа.
МПа.
Точка
4.
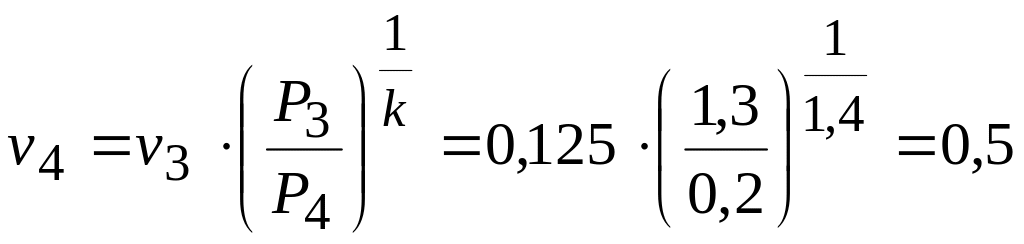 м3/кг.
м3/кг.
 К
К
Таблица 3.1 - Результаты вычислений параметров
Термические параметры |
Точка цикла |
|||
1 |
2 |
3 |
4 |
|
Р, МПа |
0,2 |
1,2 |
1,3 |
0,2 |
v, м3/кг |
0,45 |
0,125 |
0,125 |
0,5 |
Т, К |
313 |
523 |
573 |
335 |
2. Рассчитаем параметры процессов.
Процесс
1-2
– адиабатный:
![]() .
.
Показатель политропы рассчитаем по формуле:
 .
(3.1)
.
(3.1)
Для данного
процесса:
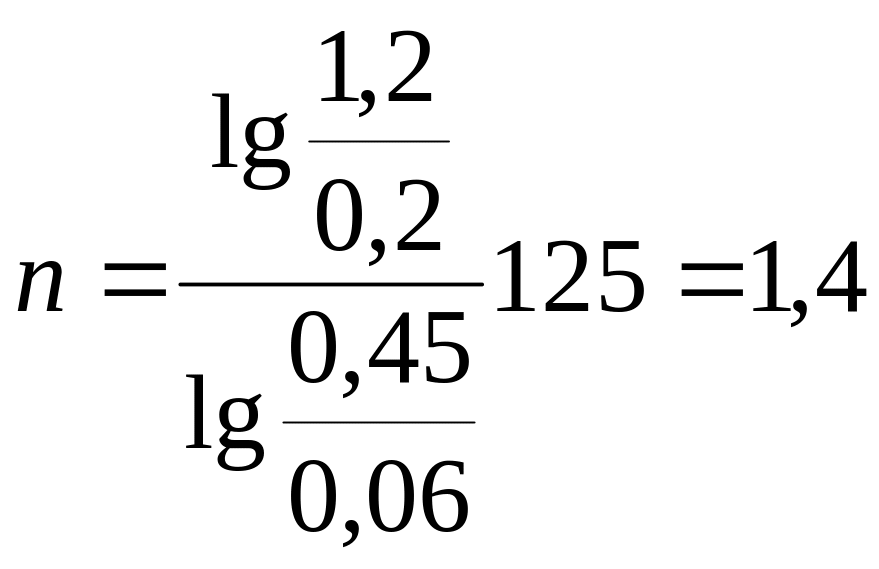 .
.
Теплоемкость:
![]() . (3.2)
. (3.2)
В адиабатном
процессе теплоемкость равна нулю, т.к.
![]() :
:
![]() .
.
Изохорная
теплоемкость:
![]() кДж/кг·К
кДж/кг·К
Изменение внутренней энергии и энтальпии:
![]() кДж/кг;
кДж/кг;
![]() =215,25
кДж/кг.
=215,25
кДж/кг.
Изменение энтропии определяется по формуле:
![]() . (3.3)
. (3.3)
Т.к.
в адиабатном процессе
![]() ,
то и
=0.
,
то и
=0.
В адиабатном процессе работа совершается за счет изменения внутренней энергии:
=- , (3.4)
тогда: =- =-154,98 кДж/кг.
Располагаемая
работа в адиабатном процессе в
![]() раз больше работы изменения объема:
раз больше работы изменения объема:
![]() =
=
![]() =1,4·
=1,4·![]() кДж/кг.
кДж/кг.
Процесс
2-3 – изохорный:
![]() .
.
В изохорном процессе показатель политропы равен бесконечности:
 .
.
![]() =
0,738 кДж/(кг·К).
=
0,738 кДж/(кг·К).
Изменение внутренней энергии и энтальпии:
![]() кДж/кг;
кДж/кг;
![]() кДж/кг.
кДж/кг.
Изменение энтропии в изохорном процессе определяется по формуле:
![]() , (3.5)
, (3.5)
Тогда в данном
случае:
![]() кДж/кг·К.
кДж/кг·К.
В изохорном процессе
вся теплота расходуется на изменение
внутренней энергии:
![]() 36,9
кДж/кг.
36,9
кДж/кг.
Работа в изохорном
процессе равна нулю за счет того объем
остается постоянным:
 .
.
Располагаемая
работа:
![]() кДж/кг
кДж/кг
Процесс 3-4 - адиабатный: .
 ;
=0.
;
=0.
![]() кДж/кг;
кДж/кг;
![]() =-243,95
кДж/кг;
=-243,95
кДж/кг;
=-
=175,6кДж/кг;
=
![]() =1,4·
=1,4·![]() кДж/кг;
=0
кДж/кг;
=0
Процесс
4-1
– изобарный:
![]() ,
т.е.
,
т.е.
![]() .
.
Таким образом,
![]()
Теплоемкость
процесса:
![]() кДж/(кг·К).
кДж/(кг·К).
![]() кДж/кг;
кДж/кг;
![]() кДж/кг;
кДж/кг;
=![]() кДж/(кг·К);
кДж/(кг·К);
![]() =
=![]() -22,55
кДж/кг;
-22,55
кДж/кг;
![]()
![]() кДж/кг;
кДж/кг;
 .
.
3. Определим
суммарные количества подведенной q1
и отведенной q2
теплоты, работу цикла
![]() ,
термический КПД цикла t.
,
термический КПД цикла t.
Подведенная
теплота:
![]() кДж/кг.
кДж/кг.
Отведенная теплота:
![]() кДж/кг.
кДж/кг.
Работа
цикла:![]() =36,9-22,55=14,35
кДж/кг.
=36,9-22,55=14,35
кДж/кг.
Термический КПД
цикла
![]() :
:
![]()
4. Цикл в
![]() - координатах строим, используя результаты
вычислений п.1 (таблица 2.1.):
- координатах строим, используя результаты
вычислений п.1 (таблица 2.1.):

Рисунок 3.1 - Цикл в vP-координатах
Для построения
цикла в координатах
![]() необходимо определить значение энтропии
необходимо определить значение энтропии
![]() (Дж/кг∙К) для каждой характерной точки
цикла по формуле:
(Дж/кг∙К) для каждой характерной точки
цикла по формуле:
![]() .
(3.6)
.
(3.6)
Далее получаем:
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К).
кДж/(кг·К).
Вычислим значения изменения энтропии в термодинамическом цикле:
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К);
кДж/(кг·К);
![]() кДж/(кг·К).
кДж/(кг·К).
Вычисленные значения изменения энтропии совпадают со значениями, полученными для процессов цикла через основные термодинамические параметры.
Таблица 3.2 - Результаты вычислений энтропии в точках цикла
|
Точка 1 |
Точка 2 |
Точка 3 |
Точка 4 |
|
313 |
523 |
573 |
335 |
|
- 0,06 |
- 0,06 |
0,01 |
0,01 |

Рисунок 3.2 - Цикл в sT – координатах
Таблица 3.3 - Варианты для самостоятельного решения задачи
Заданные параметры в основных точках Р [МПа], v [м3/кг], Т [К]
|
Тип процесса или показатель политропы
|
|||||||
|
|
|
|
|
1-2 |
2-3 |
3-4 |
4-1 |
1 |
Р1=0,8 |
v1=0,12 |
P2=2,0 |
P3=1,2 |
S = const |
T = const |
S = const |
v = const |
2 |
Р1=1,3 |
T1=573 |
P2=0,5 |
T3=290 |
T = const |
S = const |
T = const |
S = const |
3 |
Р1=0,2 |
v1=0,45 |
P2=1,2 |
T3=573 |
S = const |
v = const |
S = const |
P = const |
4 |
Р1=3,5 |
T1=483 |
T2=573 |
P3=2,5 |
P = const |
n=1,2 |
P = const |
v = const |
5 |
Р1=0,1 |
T1=273 |
P2=0,5 |
T3=473 |
n=1,3 |
P = const |
n=1,3 |
P = const |
6 |
Р1=0,09 |
T1=303 |
P2=0,4 |
T3=473 |
n=1,2 |
P = const |
n=1,2 |
v = const |
7 |
Р1=0,16 |
v1=0,5 |
T2=423 |
P3=2,5 |
n=1,2 |
v = const |
n=1,2 |
P = const |
8 |
Р1=0,18 |
T1=303 |
v2=0,1 |
P3=0,3 |
n=1,1 |
T = const |
n=1,1 |
v = const |
9 |
Р1=0,3 |
v1=0,3 |
P2=2,0 |
T3=573 |
n=1,3 |
P = const |
n=1,3 |
P = const |
10 |
Р1=2,0 |
T1=473 |
T2=623 |
v3=0,12 |
P = const |
S = const |
v = const |
T = const |
11 |
P1=0,3 |
T1=298 |
P2=1,0 |
T3=573 |
S = const |
P= const |
T= const |
P= const |
12 |
P1=0,4 |
T1=373 |
P2=1,6 |
P3=0,6 |
S = const |
T= const |
S= const |
P= const |
13 |
P1=0,3 |
T1=300 |
P2=0,2 |
T3=273 |
T = const |
v= const |
T= const |
v= const |
14 |
P1=1,2 |
T1=373 |
P2=3,0 |
T3=473 |
T = const |
P= const |
T= const |
P= const |
15 |
P1=5,0 |
T1=573 |
P2=1,8 |
P3=0,2 |
T = const |
S= const |
v= const |
S= const |
16 |
P1=0,7 |
v1=0,12 |
P2=2,0 |
T3=473 |
S = const |
P= const |
S= const |
T= const |
17 |
P1=0,3 |
T1=303 |
P2=0,6 |
T3=523 |
S = const |
v= const |
S= const |
T= const |
18 |
P1=0,12 |
v1=0,7 |
v2=0,2 |
T3=423 |
T = const |
P= const |
T= const |
P= const |
19 |
P1=0,4 |
v1=0,3 |
P2=1,0 |
T3=573 |
T = const |
P= const |
S= const |
P= const |
20 |
P1=0,7 |
T1=473 |
T2=573 |
v3=0,43 |
P = const |
T= const |
v= const |
S= const |
