
- •Оглавление
- •Введение
- •Тема 1. Электронная оболочка атома химического элемента Квантовые числа
- •Электронные конфигурации атомов элементов
- •Контрольные задания
- •Тема 2. Периодический закон и периодическая система химических элементов д.И.Менделеева
- •Структура периодической системы
- •Тема 3. Химическая связь Основные понятия по теме «Химическая связь»
- •Природа химической связи
- •Теория молекулярных орбиталей
- •Формы связывающих и разрыхляющих молекулярных орбиталей и типа, образованных при комбинации атомных s- и р-орбиталей
- •Варианты контрольных заданий
- •Теория валентных связей
- •Расположение локализованных электронных пар центрального атома и пространственная конфигурация молекул
- •Варианты контрольных заданий
- •Комплексные соединения. Геометрическое строение комплексов
- •Пространственная конфигурация комплексов
- •Использованные в табл. 3.6 обозначения:
- •Контрольные задания
- •Тема 4. Растворы
- •Контрольные задания
- •Тема 5. Термодинамика химических процессов
- •Контрольные задания
- •Тема 6. Химическое равновесие
- •Закон действующих масс. Константа химического равновесия
- •Смещение химического равновесия. Принцип Ле Шателье
- •Контрольные задания
- •Варианты контрольных заданий
- •Приложения
- •Энергии ионизации атомов и ионов
- •Стандартные электродные потенциалы некоторых систем в водных растворах
- •Константы ионизации кислот
Теория молекулярных орбиталей
Для описания химической связи используют теорию молекулярных орбиталей (ТМО) и теорию валентных связей (ТВС).
Описать молекулы согласно ТМО – значит определить тип ее орбиталей, их энергию и выяснить характер распределения электронов по орбиталям, то есть решить те же задачи, что и при рассмотрении электронных структур атомов.
Теория МО позволяет определить порядок связи; установить зависимость между порядком связи и энергией связи, ее длиной; различить парамагнитные и диамагнитные молекулы.
Молекулярные орбитали. В атомах электроны пребывают на атомных орбиталях (АО), называемых s-, p-, d-, f-орбиталями. Согласно ТМО в молекуле электроны пребывают на молекулярных орбиталях (МО) более сложных, чем атомные орбитали. Их обозначают греческими буквами , , , . Молекулярная орбиталь есть результат комбинации атомных орбиталей (рис. 3.4). Комбинация атомных орбиталей сводится к их перекрыванию. Возможно положительное и отрицательное перекрывание. Из двух перекрывающихся атомных орбиталей образуются две молекулярные орбитали. При положительном перекрывании образуется связывающая молекулярная орбиталь, при отрицательном – разрыхляющая молекулярная орбиталь. Связывающая молекулярная орбиталь характеризуется повышенной электронной плотностью в пространстве между ядрами, поэтому такая орбиталь энергетически более выгодная, чем атомные орбитали. На разрыхляющей орбитали электронная плотность концентрируется, наоборот, за ядрами, поэтому подобная орбиталь энергетически менее выгодная, чем исходные атомные орбитали.

Рис. 3.4. Схема образования связывающей(s ) и разрыхляющей (s*) молекулярных орбиталей при перекрывании атомных s-орбиталей
Вышеотмеченное можно изобразить в виде энергетической диаграммы, где по вертикали откладывают значение энергии Е орбиталей (рис. 3.5). Слева и справа на диаграмме приводят энергетические уровни атомных орбиталей, в середине – уровни молекулярных орбиталей. Уровень энергии связывающей орбитали на схеме располагают ниже уровня исходных атомных орбиталей. В случае разрыхляющих орбиталей их энергетическое положение на схеме выше исходных атомных.

Рис. 3.5. Энергетическая диаграмма s-атомных и s- молекулярных орбиталей двухатомной гомоядерной молекулы
Двухатомные гомоядерные молекулы элементов 1-го периода. Энергетическую диаграмму (рис. 3.5) используют для описания двухъядерных молекулярных образований типа Н2+, Н2, Не2+, Не2.
Обобществленные электроны распределяют по молекулярным орбиталям согласно принципу наименьшей энергии и принципу Паули. По характеру распределения электронов по орбиталям оценивают порядок связи как разность числа связывающих и разрыхляющих электронов:
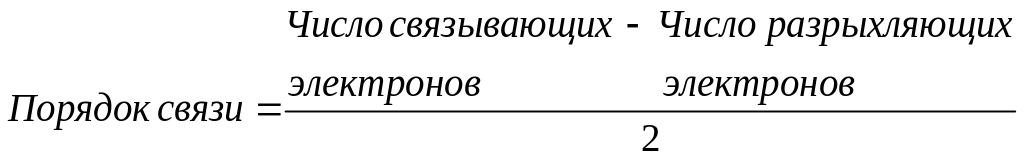
Опишем некоторые молекулы по методу МО.
• Молекула Н2. В молекуле водорода два электрона. Согласно принципу наименьшей энергии и принципу Паули, эти два электрона с противоположными спинами заселяют s-орбиталь:

Реакцию образования молекулы водорода из атомов можно записать следующим образом:
Н[1s1] + Н[1s1] Н2 [s2].
Энергия двух электронов на связывающей МО s ниже, чем у тех же электронов на 1s-орбиталях изолированных атомов. Поэтому молекула Н2 более устойчива, чем два изолированных атома водорода.
Порядок
связи =
![]() .
.
• Молекула Не2. В системе из двух атомов Hе2 четыре электрона: два – на связывающей и два – на разрыхляющей орбиталях:

He [1s2] + He [1s2] He [s2s*2]
Молекулы гелия в невозбужденном состоянии не существует, так как у нее одинаковое число связывающих и разрыхляющих электронов.
Порядок
связи =
![]()
По характеру распределения электронов по молекулярным орбиталям можно предсказать изменение энергии и длины связи. Пребывание электронов на связывающих МО вызывает упрочнение связи и сокращение ее длины. Наоборот, пребывание электронов на разрыхляющих МО приводит к ослаблению связи и увеличению межъядерного расстояния. Сопоставим значения энергий диссоциации (напомним, что для двухядерных образований энергия связи равна энергии диссоциации) и длины связей у Н2+, Н2, Не2+, Не2 :
|
H2+ |
H2 |
He2+ |
He2 |
Молекулярные орбитали |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Энергия диссоциации, Едис, кДж/моль |
255,7 |
435 |
230 |
- |
Межъядерное расстояние (длина связи) d, нм. |
0,106 |
0,074 |
0,108 |
- |
Порядок связи |
0,5 |
1 |
0,5 |
0 |
В ряду Н2+ - Н2 - Не2+ по мере заполнения электронами связывающей орбитали энергия диссоциации молекул возрастает, с появлением же электрона на разрыхляющей орбитали, наоборот, уменьшается. Межъядерное расстояние вначале уменьшается, а затем увеличивается. Порядок связи, учитывающий и связывающие и разрыхляющие электроны, вначале увеличивается, а затем уменьшается.
Двухатомные гомоядерные молекулы элементов 2-го периода. У элементов 2-го периода в образовании молекулярных орбиталей участвуют валентные 2s- и 2р-орбитали. Примем, что перекрывание исходных атомных орбиталей происходит по оси Z . Комбинации из 2s-орбиталей (как и 1s-орбиталей) формируют две молекулярные орбитали:s и s* (табл. 3.1).
Положительное и отрицательное перекрывание 2рz-орбиталей (вытянуты вдоль оси Z) приводит к связывающей (z) и разрыхляющей (z*) орбиталям. Перекрывание же двух 2рх-орбиталей дает молекулярные π-орбитали: πх и πх*. Аналогичные молекулярные орбитали -типа (у и у*) возникают от перекрывания 2ру-орбиталей. Однако они будут повернуты на 90о вокруг межъядерной оси молекулы. Поскольку АО 2рх и 2ру одинаковы по форме и энергии, то и πх и πу имеют одинаковую форму и энергию; то же самое относится к πх*- и πу*-орбиталям (табл. 3.1).
Таблица 3.1

 s*
s*
 s
s