
- •Контрольні питання:
- •1. Теоретичні основи
- •1.1. Константа нестійкої комплексного з'єднання
- •1.2. Суміщені рівноваги і конкуруючі процеси.
- •2. Лігандообмені процеси, що протікають в організмі в нормі
- •2.1. Загальна характеристика.
- •2.2. Комплексні сполуки порфіріна і корріна.
- •2.3. Транспорт кисню гемоглобіном.
- •2.4. Металоферменти
- •2.5. Інші комплекси металів з білками.
- •2.6. Металолігандний гомеостаз.
- •3. Лігандообменні процеси, що протікають в організмі при патології
- •Ситуативні нетипові завдання.
- •Література
2.2. Комплексні сполуки порфіріна і корріна.
Типовою комплексною сполукою, що відрізняється високою стійкістю і великою специфічністю ролі металу, є гем, що входить до складу гемоглобіну і міоглобіну. Гем відноситься до групи металло-порфірінов. Центральний іон в геме — залізо(II) з координаційним числом 6, хелатообразующий ліганд — тетрадентатний порфін.
Профін утворює багато похідних — порфірінов, що відрізняються характером і положенням заступників. Гем є плоским жорстким макроциклом, що обумовлене існуванням системи сопряжених зв'язків. Розмір порфірінового „вікна" декілька менше розміру іона високоспину заліза (II), але трохи більше, чим розмір нізкоспінового іона заліза(II) (порфірін утворює комплекси і з іншими іонами Зd-елементів, але такий характер геометричної відповідності існує тільки для заліза).

У координаційній сфері заліза тільки чотири місця зайнято атомами азоту порфіріна. П'яте місце займає донорний атом азоту в бічному ланцюзі гистідіна, зв'язуючого гем з білковою частиною молекули — глобіном. Шосте місце є вакантним, його може займати молекула кисню (утворюється оксигемоглобін або оксиміоглобін). При утворенні оксиформи гемоглобіну або міоглобіну ступінь окислення заліза не змінюється. Гемовая структура входить в склад і інших сполук, що виконують важливі функції, зокрема катав ази і цитохромов. Гемовая частина цитохромов відрізняється від гема гемоглобіну тим, що шосте місце в координаційній сфері заліза зайняте донорним атомом амінокислоти (сірки метіоніну). Таким чином, цитохром не може координувати молекулу кисню. Механізм його дії пов'язаний з можливістю зміни ступеню окислення центрального іона.
По структурі до порфіріну близький коррін. Відмінність полягає у відсутності одного метенового містка, зв'язуючого піррольне кільце в цикл. Комплексне сполука корріна з кобальтом лежить в основі структури вітаміну В12.

відсутність
метенового
містка
2.3. Транспорт кисню гемоглобіном.
Одна
з основних функцій гемоглобіну полягає
у перенесенні кисню кров'ю. Міоглобін
переносить кисень в м'язах. Обидві
сполуки є білки, простетічної групою
яких є гем. Гемоглобін на відміну від
міоглобіну володіє чвертковою структурою
— його молекула складається з чотирьох
протомеров (мал.1). Пари протомеров
відрізняються складом поліпептідних
ланцюгів. Молекула гемоглобіну дорослої
людини містить 2
 -цепи
і 2
-цепи
і 2
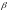 -цепи,
кожна з яких приблизно на 3/4 спіралізує.
Відносна молекулярна маса міоглобіну
рівна 17 800, гемоглобіну — 64 500. Молекула
міоглобіну і протомер молекули гемоглобіну
є дуже компактними утвореннями, внутрішня
частина яких полягає практично цілком
з
-цепи,
кожна з яких приблизно на 3/4 спіралізує.
Відносна молекулярна маса міоглобіну
рівна 17 800, гемоглобіну — 64 500. Молекула
міоглобіну і протомер молекули гемоглобіну
є дуже компактними утвореннями, внутрішня
частина яких полягає практично цілком
з
М ал.1.
Тетрамерноє будова молекули гемоглобіну.
1-полипеетидные ланцюги; 2-гем
ал.1.
Тетрамерноє будова молекули гемоглобіну.
1-полипеетидные ланцюги; 2-гем
неполярних груп бічних ланцюгів амінокислотних залишків. Гем, що знаходиться в своєрідній гидрофобній кишені, пов'язаний ковалентно з пептидним ланцюгом кріз атом азоту імідазольного фрагмента залишку гистідіна:
вакантне місце


Конформаційна стабілізація здійснюється за рахунок гидрофобних взаємодій між піррольнимі кільцями і неполярними групами в бічних ланцюгах амінокислот, а в молекулі гемоглобіну — додатково за рахунок встановлення іонних взаємодій між протомерамі з ідентичними поліпептіднимі ланцюгами. Протомери з неідентичними поліпептіднимі ланцюгами ( і ) утримуються разом за рахунок ван-дер-ваальсових взаємодій.
Молекула міоглобіну (Mb) має велику спорідненість до кисню. Процес скріплення кисню міоглобіном описується константою стійкості, визначуваної по наступному рівнянню:
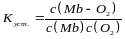 (2)
(2)
Парціальний тиск кисню, відповідний напівнасиченню міоглобіну, тобто умові c(Мb) = c(Мb — O2), рівне 133 Па. Кінетика скріплення кисню міоглобіном описується рівнянням другого порядку;k=2.107 л/(міль .с).
Спорідненість гемоглобіну до кисню виражена у меншій мірі. Парціальний тиск кисню, відповідно напівнасиченню гемоглобіну, рівне 3,47 кпа, тобто в 26 разів більше, ніж для міоглобіну. Це зв'язано i з присутністю в еритроцитах 2,3-дифосфоглицерата, здатного оборотно з'єднуватися з гемоглобіном.

2,3 – діфосфогліцерат
Молярні концентрації діфосфогліцерата і гемоглобіну приблизно рівні між собою. Константа стійкості оксигемоглобіну визначається по наступному рівнянню:

У рівняння (3) вводиться коефіцієнт n, оскільки в молекулі гемоглобіну є чотири центри, що зв'язують кисень. Якби протомери зв'язували кисень незалежно один від одного, то коефіцієнт n мав би значення 1 і рівняння (2) і (3) були б ідентичними.
В тому випадку, якщо б чотири молекули кисню одночасно «сідали» на молекулу гемоглобіну, то n дорівнювало б 4. Дослідження, проведені ще в 1913 р., показали, що у фізіологічних умовах n= 2,8 (коефіцієнт Хилла) . Таке значення n указує на складніший характер взаємодії протомеров в реакції комплексоутворювання, тобто існування так званого кооперативного механізму. Суть його полягає в тому, що приєднання однієї молекули кисню полегшує приєднання наступної. Таким чином, спорідненість центру скріплення кисню, тобто приватна константа стійкості комплексної сполуки, залежить від того, зайняті або вільні решта центрів скріплення в молекулі гемоглобіну. Важче зв'язується перша молекула кисню, найлегше — четверта (константи стійкості відрізняються приблизно в ЗОО разів). Розберемо механізм цього цікавого феномена.
Залізо в гемоглобіні знаходиться у високоспіновом стані і, не поміщаючись у вікно макроциклу, розташовується декілька над його площиною. Акцепірована молекула кисню збільшує ступінь розщеплювання 3 d-підрівня (сильне поле лігандов), високоспиновий іон заліза перетворюється на низькоспиновий і втягується всередину макроциклу (мал. 2)
Переміщення атома заліза на 60 пм щодо площини циклу викликає прогинання поліпептідною ланцюга. Зміну конформації поліпептідной ланцюга полегшує приєднання наступної молекули кисню. Відзначено, що скріплення кисню завжди починається з - протомера. Це пояснюється, мабуть, тим, що іон заліза в геме ( - протомеров екрановано залишком валіна. При конформаційних змінах залишок валіна відсовується від гема, що полегшує акцептацію молекули кисню. Крім того, акцептація кожної молекули кисню супроводжується зменшенням числа іон-іоних взаємодій між протомерамі, що також полегшує скріплення кисню незавантаженими центрами. На мал. 3 приведені схеми двох моделей, що пояснюють кооперативний механізм скріплення кисню. У основі обох моделей лежить уявлення про те, що протомери гемоглобіну можуть знаходитися як в жорсткій конформації (Т — від англ. tight—жесткий),, так і в релаксированой (I — від англ. relaxed — розслаблений) конформація має більшу спорідненість до кисню, чим Т-конформація.
Дисоціація комплексу гемоглобіну з киснем відбувається також ступінчасто, причому перша молекула звільняється з більшею працею, чим друга і т.д.

Мал. 2. Переміщення атома заліза в геме при скріпленні кисню, а — атом високоспину заліза не поміщається в площини порфірінового циклу; б — нізкоспіновий атом заліза входить в площину порфірінового циклу.
Незначні зміни величини рН і парціального тиску вуглекислого газу роблять вплив на скріплення кисню гемоглобіном. Це явище, що отримало назву ефекту Бору (1904) пояснюється тим, що при протонірованні або депротонірованні, а також при приєднанні молекули вуглекислого газу до вільних аміногруп змінюється конформація поліпептідних ланцюгів:
Г лобін
– NH2+CO2
Глобін – NHCOO-
+ H+
лобін
– NH2+CO2
Глобін – NHCOO-
+ H+



Т – конформація

R – конформація

молекула кисню
Мал. 13.3. Кооперативне зв’язування кисню гемоглобіном. а — модель Жакоба; б — модель Кош-ленда.
Збільшення парціального тиску СO2 і концентрації O2 в тканинах сприяє дисоціації комплексу гемоглобіну з киснем. Це має велике фізіологічне значення, оскільки саме активно метаболізіруючі тканини вимагають підвищеної притоки кисню. До 15% вуглекислого газу, що утворюється в тканинах, транспортується у формі карбгемоглобіна.
 Мал.
4. Криві насичення киснем гемоглобіну
і міоглобіну. 1— міоглобін; 2 —
гемоглобін.
Мал.
4. Криві насичення киснем гемоглобіну
і міоглобіну. 1— міоглобін; 2 —
гемоглобін.
На рис.4 представлений графік залежності ступеня насичення міоглобіну і гемоглобіну киснем (Y %) від величини парціального тиску кисню.
Криві насичення мають різну форму для міоглобіну і гемоглобіну (сигмовідную). Відмінність у формі кривих викликана наявністю коопера-тівного ефекту скріплення у гемоглобіну. Інша важлива відмінність полягає в тому, що крива насичення гемоглобіну знаходиться значно правішем: однакові значенням pO2 відповідає значно великий ступінь насичення киснем міоглобіну, чим гемоглобіну. Ці відмінності і обумовлюють специфічну функцію гемоглобіну — здатність легко насищатися киснем у легенів і легко віддавати кисень міоглобіну в капілярах м'язів.
Крім кисню, гем може зв'язувати і оксид вуглецю (II). Токсичність чадного газу пояснюється з позицій теорії суміщених лігандообменних рівноваг: кисень і оксид вуглецю (II) конкурують за центральний нон — атом заліза в геме. Оксид вуглецю(II) утворює приблизно в 300 разів міцніше, ніж кисень, сполуку з гемоглобіном — карбоксигемоглобін. Дисоціація карбоксигемоглобіна протікає приблизно в 3500 разів повільніше, ніж дисоціація оксигемоглобіну. Навіть при невеликих концентраціях чадного газу в повітрі наступає гемічна (транспортна) гіпоксія. Оксид вуглецю (II) досить міцно зв'язується тканинами: він може затримуватися ними більш ніж на 16 діб. Що постраждали від отруєння чадним газом слід негайно винести на свіже повітря: збільшення парциального тиску кисню сприяє дисоціації карбоксигемоглобіна.
