
- •Контрольні питання:
- •1. Теоретичні основи
- •1.1. Константа нестійкої комплексного з'єднання
- •1.2. Суміщені рівноваги і конкуруючі процеси.
- •2. Лігандообмені процеси, що протікають в організмі в нормі
- •2.1. Загальна характеристика.
- •2.2. Комплексні сполуки порфіріна і корріна.
- •2.3. Транспорт кисню гемоглобіном.
- •2.4. Металоферменти
- •2.5. Інші комплекси металів з білками.
- •2.6. Металолігандний гомеостаз.
- •3. Лігандообменні процеси, що протікають в організмі при патології
- •Ситуативні нетипові завдання.
- •Література
Одеський Національний Медичний Університет
Кафедра медичної хімії
Методична розробка проведення практичного заняття по темі:
:
«Будова і класифікація комплексних сполук. Комплексоутворювання в біологічних системах»
для викладачів ОНМедУ по курсу «Медична хімія»
Одеса - 2015
Тема: Металлолігандний гомеостаз. Порушення гомеостазу. Основи хелатотерапії.
Актуальність теми :
Біологічна роль d-елементів обумовлена здатністю принимати участь у лігандообмених, гетерогених, протолітічних і редокс-процесів. Практично усі іони d-елементів в умовах організму знаходиться в зв'язаному стані у вигляді комплексних сполук з різними біолігандамі.
Нижче викладені основні положення теорії лігандообменних равновесий дозволяють зрозуміти суть реакцій комплексоутворювання, що протікають в організмі, з'ясувати природу металлолігандного гомеостазу, а причини його порушення. Учбовий матеріал цього розділу теоретично обгрунтовує застосування хелатотерапії для виведення з організму деяких ксенобіотиків, що поступають в нього, як правило, в екологічно несприятливих ситуаціях.
Контрольні питання:
1. Суть реакцій комплексоутворювання в організмі.
2. Природа металлолігандного гомеостазу. Причини його порушення.
3. Основні термодинамічні принципи хелатотерапії.
1. Теоретичні основи
1.1. Константа нестійкої комплексного з'єднання
Схемний процес комплексоутворювання можна представити таким чином:
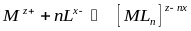
де
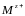 — іон атома-комплексоутворювач;
— іон атома-комплексоутворювач;
 – ліганд (х може приймати значення O)
– ліганд (х може приймати значення O)
З
термодинамічних позицій стійкість
комплексного іона, що утворився,
характеризується константою стійкості
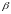 :
:
 (1)
(1)
Зазвичай стійкість комплексних з'єднань характеризують константою нестійкості Кн:
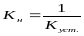
Константи нестійкості дозволяють прогнозувати спрямування лігандообменних процесів. У водному розчині у відсутність інших лігандов іон металу існує у вигляді аквакомплексу, тобто комплексу, в якому навколо центрального нона координовані молекули води:
[Cu (H2O)4]2+ тетрааквамедь (II); [Fe (Н2O)6]3+ – гексаакважелезо (III). Освіта у водному розчині комплексу між іоном металу і яким-небудь лігандом можна розглядати як реакцію заміщення молекул води в внутрішній координаційній сфері цим лігандом:

Наприклад:
[Zn
(H2O)4
]2+
+
4NH3
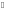 [Zn
(NH3)4]
2++
4Н2O;
(Сг(Н2О)6]3++4OН-
[Сг(ОН)4(Н2O)2]
+ 4Н2О
[Zn
(NH3)4]
2++
4Н2O;
(Сг(Н2О)6]3++4OН-
[Сг(ОН)4(Н2O)2]
+ 4Н2О
Лігандообменниє реакції протікають по механізму SN. Міцність комплексних сполук, що утворюються, залежить від багатьох чинників. Крім природи реагуючих речовин, вплив роблять і умови проведення реакції. В більшості випадків в малополярних розчинниках міцність комплексних сполук вища, ніж в полярних, оскільки в них взаємодія між іонамі-комплексоутворювачами і молекулами розчинника слабка. На стійкість комплексів впливає зміна температури: з її підвищенням, як правило, стійкість знижується (більшість діссоциатівних процесів при підвищенні температури протікають інтенсивніше). Нарешті, на стійкість комплексних іонів впливає значення рH середовища.
На відміну від реакцій іонного обміну утворення комплексних сполук часто не є квазімиттєвим процесом. Наприклад, руйнування гексааммінкобальта(III) при додаванні кислоти повністю відбувається при 20°С за декілька днів (відзначимо, що константа рівноваги цієї реакції має дуже велике значення: K=1025).
Для кінетичної характеристики комплексних сполук використовуються парні поняття—лабільний (швидко вступаючий в реакції) і інертний (поволі вступаючий в реакції). Ці поняття застосовуються відносно конкретної реакції, тобто комплексної сполуки і реагенту. Лабільними комплексами, за пропозицією. Таубе, вважаються такі, які повністю обмінюються лігандамі протягом 1 мін при тем¬ пературе 25 °С. Необхідно чітко розрізняти термодинамічні [міцний (стійкий) / непрочный (нестійкий)] і кінетичні (інертний /лабильный) поняття.
1.2. Суміщені рівноваги і конкуруючі процеси.
За наявності у розчині декількох лігандов, здібних до утворення комплексної сполуки з іоном металу, спостерігається суміщена лігандообменна рівновага. Процеси утворення комплексного сполуки іона металу з кожним з лігандов є такими, що конкурують: переважаючим буде процес, який веде до утворення найміцнішого (тобто з найменшою константою нестійкості комплексної сполуки. Висновок про порівняльну міцність комплексних - сполук на підставі величин констант нестійкості можна робити тільки для однотипних сполук.
Існують і такі суміщені лігандообменниє рівноваги, в яких об'єктом конкуренції є ліганд, а частинки які конкурують — іони металів.
Приклад конкуренції за іон металу. У розчині присутні іони цинку, аміак, цианід-іон. Іон цинку здатний утворювати, окрім аквакомплексу, аміачним і цианідний комплекс. Як що кожен з присутніх в даному розчині лігандов є монодентатним, а цинк у всіх трьох комплексних іонах має координаційне число 4, стійкість сполук можна порівнювати безпосередньо по константах. Міцнішим є цианідний комплекс, процес утворення якого і переважатиме в даній системі.
Приклад конкуренції за ліганд. В даний час з різними цілями, у тому числі і в медицині, використовується етілендіамінтетрауксусна кислота (ЕДТА) або її дінатрйева сіль—Na2 ЕДТА.
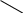
 НООС—CH2
CН2—СООН
НООС—CH2
CН2—СООН
N—СН2—СН2—N
нсос— CН2 CН2—соон
Для написання формули ЕДТА та її аніонів використовують позначення H4Y, НзY– , H2У2– і т.д. Nа2 ЕДТА можна записати як Na2H2 У. ЕДТА та її сіль утворюють міцні комплекси майже зі всіма металами (окрім лужних). Особливістю їх взаємодії є незалежність величини молярного співвідношення металл/ ЕДТА від заряду іона металу, яке завжди рівне 1:1. Припустимо, що у розчині є іони металів: магнію, міді(II), заліза(II). хрому(III), марганцю(II). При введенні в такий розчин ЕДТА в невеликій кількості відбувається скріплення того іона, який утворює найміцніший комплекс: Fe3+. У міру додавання нових порцій ЕДТА відбуватиметься скріплення і інших іонів в наступній послідовності: Сг3+, Cu2+, Co2+, Mn2+, Mg2+.
