
- •Внутренняя энергия и энтальпия системы. I закон термодинамики.
- •Тепловые эффекты химических реакций. Термохимические законы (Лавуазье-Лапласа, Гесса). Термохимические расчеты.
- •Энтропия. II закон термодинамики.
- •Энергия Гиббса. Направленность хим. Процессов. Энтальпийный и энтропийный факторы протекания реакции.
- •Скорость химических реакций в гомогенных и гетерогенных системах. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
- •Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
- •Химическое равновесие. Понятие о константе химического равновесия, ее физический смысл.
- •Смещение химического равновесия. Принцип Ле-Шателье.
- •Протонно-нейтронная теория строения атома. Изотопы.
- •Энергетическое сотояние электрона в атоме. Квантовые числа.
- •Электронная структура многоэлектронных атомов. Правила Клечковского, Хунда, Паули (показать на примере).
- •Валентность атомов в нормальном и возбужденном состояниях.
- •Периодический закон и периодическая система д.И.Менделеева. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность элементов.
- •Понятие о химической связи. Обменный механизм образования ковалентной связи.
- •Донорно-акцепторный механизм образования ковалентной связи
- •Ионная связь. S-, p- и d-связи.
- •Гибридизация атомных орбиталей. Типы гибридизации (показать на примерах).
- •Характеристики химической связи (насыщаемость, направленность, энергия, длина, кратность, полярность).
- •Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •Гидролиз солей.
- •Электрохимия. Понятие о проводниках первого и второго рода.
- •Понятие об электродном потенциале. Причины его возникновения. Двойной электрический слой.
- •Факторы, влияющие на величину электродного потенциала. Уравнение Нернста.
- •Гальванический элемент. Эдс гальванического элемента.
- •Гальванический элемент Даниэля-Якоби. Концентрационный гальванический элемент.
- •Электролиз. Основные понятия. Электролиз расплавов солей.
- •Электролиз водных растворов солей с инертным анодом и с активным анодом.
- •Законы Фарадея. Выход по току.
- •Химическая коррозия. Виды коррозионных разрушений.
- •Основная схема электрохимической коррозии. Кислородная и водородная деполяризация.
- •Защита металлов от коррозии. Металлические покрытия.
- •32. Химические свойства металлов. Отношение металлов к кислотам.
- •Взаимодействие металлов с водой и щелочами.
Скорость химических реакций в гомогенных и гетерогенных системах. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
Химическая кинетика - раздел химии, изучающий скорости химических реакций.
Фазой называется часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком.
Скорость химической реакции – число элементарных актов реакции, происходящий в единицу времени, в единице объема (гомогенная реакция) или на единице поверхности (гетерогенная реакция) раздела фаз.
Мера скорости химической реакции – количество вещества, вступившего в реакцию или образовавшегося при реакции за единицу времени в единице объема системы или на единице поверхности раздела фаз.
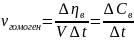 ;
;

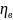 - число молей
какого- либо из получающихся при реакции
веществ; V – объем системы; t – время; S
– площадь поверхности фазы, на которой
протекает реакция;
- число молей
какого- либо из получающихся при реакции
веществ; V – объем системы; t – время; S
– площадь поверхности фазы, на которой
протекает реакция;
 – молярная концентрация данного
вещества.
– молярная концентрация данного
вещества.
Средняя скорость реакции при определенной температуре равна изменению концентрации одного из реагентов или одного из продуктов за единицу времени.
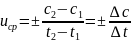
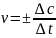 – мгновенная
скорость реакций.
– мгновенная
скорость реакций.
Скорость химической реакции зависит от природы и концентрации реагентов, давления(для газов), температуры, присутствия катализатора, наличие примесей, степень измельчения, среды.
Закон действующих масс: скорость химических реакций пропорциональна концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов.
Для гомогенных
реакций:

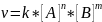
k- константа скорости; [ ] – молярная концентрация.
Величина k зависит от природы реагирующих веществ, от температуры и присутствия катализатора, но не зависит от концентрации реагирующих веществ.
Физический смысл k: если [A]=[B]=1 моль/л, то k=v – это скорость реакции в момент, когда концентрации реагирующих веществ равны единице.
Для гетерогенных реакций в уравнении закона действующих масс входят концентрации только тех веществ, которые находятся в газовой форме или в растворе. Концентрация твердых веществ представляет собой постоянную величину и поэтому входит в константу скорости. Скорость любого гетерогенного процесса возрастает при увеличении поверхности контакта фаз. Для этого используют измельчение твердой фазы.
Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
С ростом температуры число активных молекул возрастает, следовательно скорость химической реакции увеличивается.
Правило Вант-Гоффа:
при увеличении (уменьшении) температуры
на каждые 10
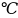 скорость гомогенной реакции возрастает
(уменьшается) в 2-4 раза
скорость гомогенной реакции возрастает
(уменьшается) в 2-4 раза
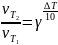
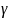 – температурный
коэффициент скорости реакции – это
число, показывающее во сколько раз
увеличивается скорость реакции при
повышении температуры реагирующего
вещества на 10
.
– температурный
коэффициент скорости реакции – это
число, показывающее во сколько раз
увеличивается скорость реакции при
повышении температуры реагирующего
вещества на 10
.
Энергия активации - избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества.
Энергия активации – это один из основных параметров, характеризует скорость химического взаимодействия, зависит от природы реагирующих веществ. Чем больше энергия активации, тем меньше скорость реакции.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
Уравнением
Аррениуса:
 , где A – предэкспоненциальный множитель,
зависящий только от природы реагирующих
веществ; Ea – энергия активации,
представляющая собой высоту энергетического
барьера, разделяющего исходные вещества
и продукты реакции (см. рисунок 2.1); R –
универсальная газовая постоянная; T –
абсолютная температура.
, где A – предэкспоненциальный множитель,
зависящий только от природы реагирующих
веществ; Ea – энергия активации,
представляющая собой высоту энергетического
барьера, разделяющего исходные вещества
и продукты реакции (см. рисунок 2.1); R –
универсальная газовая постоянная; T –
абсолютная температура.
Снижение энергии активации по каким-либо причинам, согласно уравнению Аррениуса, приводит к увеличению скорости реакции.
