
- •Внутренняя энергия и энтальпия системы. I закон термодинамики.
- •Тепловые эффекты химических реакций. Термохимические законы (Лавуазье-Лапласа, Гесса). Термохимические расчеты.
- •Энтропия. II закон термодинамики.
- •Энергия Гиббса. Направленность хим. Процессов. Энтальпийный и энтропийный факторы протекания реакции.
- •Скорость химических реакций в гомогенных и гетерогенных системах. Закон действующих масс. Константа скорости химической реакции и ее физический смысл.
- •Влияние температуры на скорость химической реакции, правило Вант-Гоффа.
- •Химическое равновесие. Понятие о константе химического равновесия, ее физический смысл.
- •Смещение химического равновесия. Принцип Ле-Шателье.
- •Протонно-нейтронная теория строения атома. Изотопы.
- •Энергетическое сотояние электрона в атоме. Квантовые числа.
- •Электронная структура многоэлектронных атомов. Правила Клечковского, Хунда, Паули (показать на примере).
- •Валентность атомов в нормальном и возбужденном состояниях.
- •Периодический закон и периодическая система д.И.Менделеева. Энергия ионизации. Энергия сродства к электрону. Электроотрицательность элементов.
- •Понятие о химической связи. Обменный механизм образования ковалентной связи.
- •Донорно-акцепторный механизм образования ковалентной связи
- •Ионная связь. S-, p- и d-связи.
- •Гибридизация атомных орбиталей. Типы гибридизации (показать на примерах).
- •Характеристики химической связи (насыщаемость, направленность, энергия, длина, кратность, полярность).
- •Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •Гидролиз солей.
- •Электрохимия. Понятие о проводниках первого и второго рода.
- •Понятие об электродном потенциале. Причины его возникновения. Двойной электрический слой.
- •Факторы, влияющие на величину электродного потенциала. Уравнение Нернста.
- •Гальванический элемент. Эдс гальванического элемента.
- •Гальванический элемент Даниэля-Якоби. Концентрационный гальванический элемент.
- •Электролиз. Основные понятия. Электролиз расплавов солей.
- •Электролиз водных растворов солей с инертным анодом и с активным анодом.
- •Законы Фарадея. Выход по току.
- •Химическая коррозия. Виды коррозионных разрушений.
- •Основная схема электрохимической коррозии. Кислородная и водородная деполяризация.
- •Защита металлов от коррозии. Металлические покрытия.
- •32. Химические свойства металлов. Отношение металлов к кислотам.
- •Взаимодействие металлов с водой и щелочами.
Внутренняя энергия и энтальпия системы. I закон термодинамики.
Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, а также возможность и направление самопроизвольного протекания процессов.
Системой называется тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее.
Внутренняя энергия – это такая форма энергии, скрытая в веществах и частично освобождающаяся при химических и некоторых физических процессах.
Для системы, неподверженной действию внешних сил и находящейся в состоянии макроскопического покоя, внутренняя энергия представляет собой полную энергию системы.
Внутренняя энергия вещества – это кинетическая и потенциальная энергия частиц, за вычетом потенциальной и кинетической энергии системы как целого.
Внутренняя энергия системы равна сумме кинетической энергии движения атомов, потенциальной энергии хранящейся в химических связях и гравитационной энергии системы
Внутренняя энергия системы зависит от природы вещества ее компонентов, массы и параметров состояния системы.
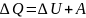 – первый закон
термодинамики:
Теплота,
подведенная к системе, расходуется на
изменения внутренней энергии системы
и на совершение работы против внешних
сил.
– первый закон
термодинамики:
Теплота,
подведенная к системе, расходуется на
изменения внутренней энергии системы
и на совершение работы против внешних
сил.
Изменение внутренней энергии определяется только начальным и конечным состояниями системы, то есть является функцией состояния системы.
Величина работы зависит от вида процесса и не является функцией состояния системы.
Теплота не является функцией состояния, но в различных процессах она связана с функциями состояния.
При изохорном
процессе
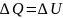 Вся подводимая
теплота идет на изменение внутренней
энергии системы.
Вся подводимая
теплота идет на изменение внутренней
энергии системы.
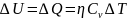
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
При изотермическом
процессе
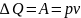
При адиабатном
процессе
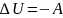 ,
то есть работа совершается за счет убыли
внутренне энергии системы.
,
то есть работа совершается за счет убыли
внутренне энергии системы.
При изобарном
процессе
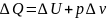
H=U+pv – энтальпия системы
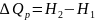
Теплота расходуется на изменение энтальпии системы
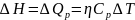
Энтальпия характеризует энергетическое состояние вещества и включает энергию, затрачиваемую на преодоление внешнего давления, то есть на работу расширения.
Энтальпия определяет состояние системы и не зависит от того, каким путем это состояние достигнуто.
Энтальпия идеального газа зависит только от его абсолютной температуры и пропорциональна массе газа.
Тепловые эффекты химических реакций. Термохимические законы (Лавуазье-Лапласа, Гесса). Термохимические расчеты.
Термохимия – раздел химии, посвященный количественному изучению тепловых эффектов реакций.
Тепловой эффект химического процесса – изменение энтальпии, произошедшее при осуществлении этого процесса, отнесенное к одному молю вещества или одному молю эквивалентов вещества.
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции, их агрегатного состояния и температуры.
Два способа записи термохимических уравнений:
Термодинамический
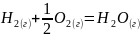 ∆Н=-242 кДж
∆Н=-242 кДжТермохимический
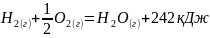
Термохимия рассматривает, сколько энергии приобрела или отдала окружающая среда. Термодинамика указывает изменение энергии, происходящее в самой реакции.
Энтальпия – теплосодержание системы.
Экзотермические
реакции –
реакции с выделением теплоты.
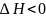
Эндотермические
– реакции, протекающие с поглощением
теплоты.
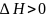
Стандартным состоянием вещества называют такое его агрегатное состояние, которое наиболее устойчиво при стандартных условиях (т.е. обладает наименьшей энергией(энтальпией)).
Изменение энтальпии может характеризовать не только реакцию, но и химическое соединение, полученное в этой реакции.
Стандартная
энтальпия образования одного моля
соединения из простых веществ в их
стандартных состояниях при стандартных
условиях называется стандартной
энтальпией образования данного
соединения.
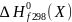
Закон Лавуазье-Лапласа: тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
Закон Гесса: тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ, но не зависит от промежуточных стадий реакций, то есть от способа проведения процесса (при изобарном и изохорном процессах).
Следствие из закона Гесса: изменение энтальпии в ходе реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрии этой реакции.
aA+bB=cC+dD
A, B – реагенты; C, D – продукты реакции; a, b, c, d – стехиометрические коэффициенты.
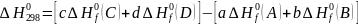 .
.
