
- •Теоретические вопросы программы Модуль 1. Элементы химической термодинамики и химической кинетики. Основные типы химических реакций и процессов в функционировании живых систем.
- •Модуль 2. Поверхностные явления. Адсорбция. Коллоидные системы. Высокомолекулярные соединения. Органическая химия.
- •Литература
- •I. Количество вещества
- •II. Количество вещества эквивалента
- •Количество вещества эквивалента:
- •III. Закон эквивалентов.
- •IV. Способы выражения концентрации растворов
Количество вещества эквивалента:
n(
X)
=
 .
.
III. Закон эквивалентов.
Вещества реагируют пропорционально их эквивалентам:
С (1/ z X) V(Х) = С (1/ z Y) V(Y)
IV. Способы выражения концентрации растворов
Массовая доля показывает отношение массы растворенного вещества m(X) к массе раствора mр-ра:
=
 ;
(%) =
·
100%.
;
(%) =
·
100%.
Массовую долю можно выражать в долях единицы или в процентах.
Например, (Х) = 0,1 или (Х) = 10%.
Молярная концентрация С(Х) – отношение количества вещества n(X), содержащегося в системе (например в растворе) к объему этой системы V.
С(Х) =
 .
.
Единица измерения моль/л.
Например, С(КСl) = 2,5 10–3 моль/л.
Молярная концентрация эквивалента С( Х) – отношение количества вещества эквивалента n( X), содержащегося в системе (например в растворе) к объему этой системы V. Единица измерения моль/л.
С(
Х)
=
 ;
С(
Х)
= Z· С(Х).
;
С(
Х)
= Z· С(Х).
Например, С(NaСl) = 2,0 10–2 моль/л.
Моляльная концентрация b(Х) – отношение количества вещества n(Х), содержащегося в системе (например в растворе) к массе растворителя – mр-ля. Единица измерения моль/кг.
b(Х) =
 .
.
Титр раствора Т(Х) – масса вещества m(Х), содержащегося в одном миллилитре раствора. Единица измерения г/мл:
 .
.
Массовая концентрация γ(Х) – отношение массы компонента, содержащегося в системе (растворе), к объему этой системы. Единица измерения г/л:

Молярная доля компонента хi – отношение количества вещества данного вещества ni к суммарному количеству вещества всех веществ в растворе:
хi =

Объемная доля компонента φ(Х) – отношение количества вещества данного вещества n(Х) к суммарному количеству вещества всех веществ в растворе:
φ(Х) =
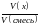
Доп. формулы.
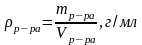 ,
,
 mр-ра = mр-ля
+ mв-ва
mр-ра = mр-ля
+ mв-ва
С(Х) =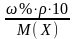 если не указан объем или масса
раствора.
если не указан объем или масса
раствора.
