
- •Теоретические вопросы программы Модуль 1. Элементы химической термодинамики и химической кинетики. Основные типы химических реакций и процессов в функционировании живых систем.
- •Модуль 2. Поверхностные явления. Адсорбция. Коллоидные системы. Высокомолекулярные соединения. Органическая химия.
- •Литература
- •I. Количество вещества
- •II. Количество вещества эквивалента
- •Количество вещества эквивалента:
- •III. Закон эквивалентов.
- •IV. Способы выражения концентрации растворов
Литература
а) основная литература
1. Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для медицинских вузов. Ю.А.Ершов, В.А.Попков, А.С.Берлянд и др. Ред.Ю.А.Ершов, 8 изд., 560 с.- М,: Высш.шк., 2010 г.
2. Общая химия. Учебник для медицинских вузов. В.А.Попков, С.А.Пузаков, 976 с. - М, ГЭОТАР Медиа, 2007 г.
3. Химия. Основы химии живого. Учебник для вузов. В.И. Слесарев.С-П.:Химиздат., 2001. - 768 с.
4. Биоорганическая химия. Учебник. Тюкавкина Н.А., Бауков Ю.И.. 7 изд., Дрофа. 2008 – 543 с.
5. Практикум по общей и биоорганической химии. Учебное пособие для студентов медицинских вузов (Ред. В.А. Попков).- М., Академия. 3 изд., 235 с., 2008 г
6. Общая и биоорганическая химия. Учебник под ред. Берлянда А.С. и Попкова В.А. М, Академия, 2010.
7. Методическое руководство к практикуму по общей химии. Юшкова Е.И., Саушкина Е.А., Королева И.П. Орел.,ОРАГС, 2005. – 180с.
8. Конспекты лекций.
б) дополнительная литература:
1. Основы биофизической и коллоидной химии Е.В. Барковский, С.В. Ткачев, Л.И. Пансевич, Т.В. Латушко, О.П. Болбас, М., изд. «Высшая школа». 2009. – 413 с.
2. Биофизическая и бионеорганическая химия А.С. Ленский, И.Ю. Белавин, С.Ю.Быликин, М, МИА, 2008, - 416 с.
3. Руководство к лабораторным занятиям по биоорганической химии, под ред. Н.А. Тюкавкиной, Дрофа, 2009 г., 5 изд. – 318 с.
4. Интернет-ресурсы.
Задание к занятию № 1
Химия и медицина. Растворы. Способы выражения концентраций растворов.
Лабораторная работа №1. «Правила по технике безопасности при работе в химической лаборатории. Лабораторное оборудование.
Химическая посуда».
Вопросы для самоподготовки:
Количество вещества.
Количество вещества эквивалента.
Закон эквивалентов.
Способы выражения концентраций растворов.
На первое занятие принести:
Tетрадь для лабораторных работ – 18 л.
Тетрадь для решения задач – 48 л.
Калькулятор (вычисляющий логарифмы).
Простой карандаш.
Химический трафарет или линейку.
Ластик.
Tетради для контрольных работ и для зачета (18 л) – 2 шт.
На занятия приходить в сменной обуви, белом халате и шапочке.
I. Количество вещества
Моль — количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 0,012 кг углерода – 12. При использовании моля как единицы количества вещества следует указывать, какие именно реальные или условные частицы имеются в виду. Обозначают: n(Х). Например, n(NaOH) = 3 моль; n(Ва2+) = 2 моль.
Молярная масса М(Х) — масса 1 моль вещества. Например: молярная масса серной кислоты М(Н2SО4) = 98 г/моль; молярная масса иона алюминия М(Al3+) = 27 г/моль.
Количество вещества: n(X) =

Число Авогадро. 1 моль любого вещества содержит одинаковое число частиц (реальных или условных). Na = 6,02 1023 моль-1.
II. Количество вещества эквивалента
Эквивалент – это реальная или условная частица вещества Х, которая в кислотно-основной реакции эквивалентна одному иону водорода или в окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности – это число обозначающее, какая доля реальной частицы вещества Х эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции. Число, стоящее в знаменателе дроби – число эквивалентности – z.
fэкв(X) =
![]()
Величина z – всегда целое положительное число (1, 2, 3 и т. д.).
Фактор эквивалентности зависит от:
природы веществ;
стехиометрии реакций, в которых они участвуют – значение фактора эквивалентности может изменятся.
а) Определение фактора эквивалентности для различных классов соединений в обменных реакциях
кислоты
fэкв(кислоты) =

для НСl, z = 1, фактор эквивалентности — 1;
для H2SO4,
z
= 2, фактор эквивалентности —
![]() ;
;
для Н3РО4
z
= 3, фактор эквивалентности —
![]() ;
;
а) H2SO4 + 2NaOH = Na2SO4 + 2H2O
В этой реакции в молекуле серной кислоты замещается два атома водорода, следовательно, z = 2, fэкв(H2SO4) = ;
б) H2SO4 + NaOH = NaHSO4 + H2O
В этом случае в молекуле серной кислоты замещается один атом водорода, z = 1, fэкв(H2SO4) = 1;
Для фосфорной кислоты, в зависимости от реакции, значения факторов эквивалентности могут быть: 1, , .
основания
fэкв(основания) =

для КОН z = 1, фактор эквивалентности— 1;
для Сa(ОН)2 z = 2, фактор эквивалентности— ;
Фактор эквивалентности многокислотных оснований может изменяться в зависимости от количества замещенных групп (также как и у кислот). Например, для гидроксида кальция возможны значения фактора эквивалентности— 1, , для гидроксида алюминия — 1, , .
соли
fэкв(соли) =
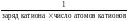
для KCl фактор эквивалентности — 1;
для Cr(NO3)3
фактор эквивалентности —

для Al2(SO4)3
фактор эквивалентности —

Значение факторов эквивалентности для солей зависит также и от реакции, аналогично зависимости его для кислот и оснований.
б) Определение фактора эквивалентности веществ в ОВР.
fэкв(окислителя или восстновителя)
=

а) 2KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + К2SO4 + 3H2O
 2 Mn+7
+ 5e = Mn+2
2 Mn+7
+ 5e = Mn+2
5 N+3 - 2e = N+5
fэкв(КMnO4) = 1/5 ; fэкв(NaNO2) = 1/2.
б) 2KMnO4 + NaNO2 + 2KOH= K2MnO4 + NaNO3 + 3H2O
2 Mn+7 + 1e = Mn+6
1 N+3 - 2e = N+5
fэкв(КMnO4) = 1; fэкв(NaNO2) = 1/2.
Молярная масса эквивалента вещества Х – масса одного моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества Х:

а) H2SO4 + 2NaOH = Na2SO4 + 2H2O
fэкв(NaOH) = 1; M(NaOH) = 40 г/моль; M(1 NaOH) = 40 г/моль;
fэкв(H2SO4) = 1/2; М(H2SO4) = 98 г/моль; М(1/2 H2SO4) = 49 г/моль.
б) H2SO4 + NaOH = NaHSO4 + H2O
fэкв(NaOH) = 1; M(NaOH) = 40 г/моль; M(1NaOH) = 40 г/моль;
fэкв(H2SO4) = 1; М(H2SO4) = 98 г/моль; М(1H2SO4) = 98 г/моль.
