
- •Молекулярная биофизика.
- •1.1. Физическая иерархия биосистем.
- •1.2. Атомарный состав живых систем.
- •1.3. Аминокислоты.
- •1.4. Нуклеиновые кислоты (нк).
- •Общая схема строения цепи:
- •1.5. Углеводы и липиды.
- •Функции полисахаридов:
- •1.6. Кофакторы. Витамины. Гормоны.
- •2. Пространственная организация биополимеров.
- •2.1. Объемные взаимодействия и переходы глобула - клубок.
- •2.2. Гибкость биополимеров
- •2.3. Объёмное взаимодействие. Переходы глобула - клубок в биополимерах.
- •2.4. Условия существования клубка и глобулы.
- •2.5. Различные типы взаимодействия в макромолекулах.
- •2.6. Ван-дер-ваальсовые (вв) силы.
- •2.7. Ориентационное взаимодействие.
- •2.8. Индукционное взаимодействие.
- •2.9. Дисперсионное взаимодействие.
- •2.10. Водородная связь и электростатические взаимодействия.
- •2.11. Физическая природа водородной связи.
- •2.12. Электростатические взаимодействия.
- •3.Элементы биофизики белка.
- •3.1. Биологические функции белков.
- •3.2. Основные задачи биофизики белка
- •3.3. Конформация полипептидной цепи.
- •3.4. Структура воды и гидрофобные взаимодействия.
- •3.5. Гидрофобные взаимодействия и структуры белков.
- •3.6. Связывание лигандов с макромолекулами.
- •Уравнение Хилла
- •3.7.Гемолиз
3.3. Конформация полипептидной цепи.
Белки высокомолекулярные соединения со строго определенным химическим строением. Молекула белка состоит из одной или нескольких полипептидных цепей, образованных в результате поликонденсации аминокислот. При объединении аминокислот в белковую цепь образуются пептидные связи (-NH-СO-), на одном конце которых находится NH+3группа, на другом COO-группа.
Рассмотрим структуру пептидной связи.

Особенностью связи является то, что 4 атома N,H,C,O располагаются в одной плоскости (обведенная область на рисунке). Из химии известно, что вращение в молекуле вокруг ординарной связи приводит к появлению поворотных изомеров.
В белках вращение вокруг пептидной связи C-N затруднено (энергия активации 40 - 80 кДж/моль), т.к. эта связь имеет характер двойной связи и, кроме того, в пептидной группе имеет место водородная связь между группой С=O и атомом водорода группы N-H (с энергией активации 20-30 кДж/моль).
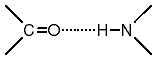
Поэтому белок можно рассматривать как
цепь связанных друг с другом плоских
пептидных звеньев. Вращение этих звеньев
возможно лишь вокруг одинарных
связей ![]() -углерода
и аминокислот (см. рис).
-углерода
и аминокислот (см. рис).

Угол поворота вокруг связи С-С обозначается , вокруг cвязи С-N обозначается .
Нахождение наиболее устойчивой
конформации белковой цепи требует
минимизации ее полной энергии, включая
энергию внутримолекулярных водородных
связей. Полинг и Кюри установили 2
основных варианта структуры белковой
цепи, которые называются ![]() -спираль
и
-спираль
и![]() -форма.
-форма.
|
|
|
|
|
|
Рис.3.1. Ориентация водородных связей в структуре белка.
![]() -спираль
может быть правозакрученной (
-спираль
может быть правозакрученной (![]() =132о,
=132о,![]() =123о)
и левозакрученной (
=123о)
и левозакрученной (![]() =228о,
=228о,![]() =237о).
=237о).![]() -формы
бывают параллельные (
-формы
бывают параллельные (![]() =61о,
=61о,![]() =239о)
и антипараллельные (
=239о)
и антипараллельные (![]() =380о,
=380о,![]() =325о).
=325о).
Кроме того, в белках встречаются участки, не образующие никакой регулярной структуры. Например, в гемоглобине 75% аминокислот образуют правозакрученные -спирали, а остальные участки цепи вообще никак не упорядочены. Упорядоченные участки часто называют кристаллической частьюбелковой молекулы, а неупорядоченные участки -аморфной формойбелка.
Аморфные участки- депо строительного материала, который в случае необходимости используется для построения упорядоченных участков.
3.4. Структура воды и гидрофобные взаимодействия.
Так как большинство белков функционирует в водной среде, то взаимодействие составляющих их мономеров с водой определяет пространственную конформацию макромолекулы белка в целом.
Рассмотрим свойства воды более подробно. Молекула воды является диполем из-за своей асимметрии. В водном растворе атом О2располагается как бы в центре тетраэдра, в двух вершинах которого находятся атомы Н.

Рис. 3.2. Тетраэдрические свойства полностью координированной воды.
Две пары электронов кислорода, не участвующие в образовании валентной связи, находятся на вытянутых орбиталях, оси которых направлены к двум вершинам тетраэдра. Эти электронные пары несут отрицательный заряд и притягивают атомы водорода двух соседних молекул, то есть образуют водородные связи. Благодаря этим взаимодействиям в жидкой воде формируются ассоциации молекул, называемые кластерами. Структура кластеров сходна со структурой льда. Однако эта кристаллическая решетка отличается определенной "рыхлостью" ( именно этим объясняется невысокая плотность льда). Вместе с тем, даже после полного таяния льда в жидкой фазе воды сохраняются льдоподобные структуры - кластеры (расчеты показывают, что если бы их не было, то плотность жидкой воды была бы =1.8 г/мл, вместо 1.0 г/мл). Наличие в воде кластеров подтверждается данными рентгенографических исследований. Между неструктурированной водой и кластерами постоянно осуществляется обмен молекулами, так что в среднем время жизни кластера составляет 10-10с. При 20оС в воде доля несвязанных в кластеры молекул составляет 29.5%. С увеличением температуры средний размер кластера уменьшается, и доля несвязанных молекул возрастает (именно плавлением кластеров объясняется аномально высокая теплоемкость воды).
В воде хорошо растворяются такие органические соединения, которые содержат полярные группы и способны вступать в диполь-дипольное взаимодействие с молекулами воды или образовывать с ними водородные связи. Такими, в частности, являются группы:

Напротив, неполярные соединения плохо растворимы в воде. Физические причины этих явлений были выяснены после измерения термодинамических параметров процессов растворения. Было установлено, что в случае плохой растворимости углеводорода в воде изменение свободной энергии положительно, и, следовательно, энтропия системы уменьшается.
![]()
Что же означает уменьшение энтропии при растворении?
Прямыми физическими исследованиями было показано, что при этом происходит увеличение доли кластеров. При растворении молекулы углеводов втискиваются в полости внутри тетраэдрических ячеек кластеров и вытесняют оттуда неструктурированную воду. Последняя образует новые кластеры, и упорядоченность системы увеличивается, а значит, энтропия уменьшается. Поэтому гидрофобные взаимодействия являются результатом свойств воды, а не каких-то особых сил, связывающих неполярные группы друг с другом. Таким образом, ассоциация неполярных молекул в воде за счет гидрофобных взаимодействий определяется выталкивающим действием воды на неполярные соединения, что обусловлено тенденцией молекул воды к достижению состояния максимальной неупорядоченности.


