
- •1. Теоретические основы органической химии.
- •2. Изомерия органических соединений:
- •1. Структурная изомерия
- •2. Пространственная изомерия (стереоизомерия)
- •3. Классификация химических реагентов и реакций.
- •4. Кислоты и основания:
- •5. Алифатические, алициклические и ароматические углеводороды: Гомологический ряд
- •Изомерия
- •Номенклатура
- •6. Химические свойства алканов: реакции галогенирования (хлорирование, бромирование, иодирование, фторирование).
- •Энергетика цепных свободнорадикальных реакций галогенирования.
- •Нитрование (м.И. Коновалов),
- •Сульфохлорирование
- •Окисление.
- •Селективность радикальных реакций и относительная стабильность алкильных радикалов.
- •Термический и каталитический крекинг.
- •Ионные реакции алканов (дейтероводородный обмен и галогенирование и нитрование в суперкислой среде).
- •7. Алкены. Гомологический ряд Структурная изомерия алкенов
- •Пространственная изомерия алкенов
- •Номенклатура
- •Геометрическая изомерия (цис, транс и z, e номенклатура).
- •Природа двойной связи.
- •Молекулярные орбитали этилена.
- •Виттига
- •Стереоселективное восстановление алкинов.
- •8. Химические свойства алкенов. Ряд стабильности алкенов, выведенный на основе теплот гидрирования. Теплота гидрирования и устойчивость алкенов
- •Гетерогенное и гомогенное гидрирование алкенов.
- •Стерео и региоселективность. Правило в.В. Марковникова, индуктивный и мезомерный эффекты.
- •Галогенирование: механизм, стереохимия.
- •Процессы, сопутствующие АdE реакциям: сопряженное присоединение, перегруппировки промежуточных карбокатионов.
- •Гидрогалогенирование: понятие о би- и тримолекулярных механизмах.
- •Гидратация. Промышленный метод синтеза этанола и пропанола-2.
- •Гидрокси и алкоксимеркурирование.
- •Метатезис алкенов.
- •Регио и стереоселективное присоединение гидридов бора.
- •Региоспецифические гидроборирующие реагенты. Превращение борорганических соединений в алканы, спирты, алкилгалогениды.
- •Вопрос 9. Алкины
- •Термоокислительный крекинг
- •2. Гидрогалогенирование (присоединение галогеноводорода).
- •3. Гидратация (присоединение воды) алкинов.
- •1. Димеризация
- •2. Тримеризация
- •Гидроборирование[
- •Натуральные и синтетические каучуки
- •Стереохимия реакции дильса-альдера
- •Область применения реакции
- •11. Циклоалканы и их производные.
- •Напряжение Ван-дер-Ваальса.
- •Напряжение трансаннулярное (напряжение Прелога).
- •Напряжение угловое (ангулярное) или байеровское напряжение.
- •Строение циклопропана
- •Строение циклобутана и циклопентана
- •Конформации циклогексана
- •Получение
- •Получение циклопентанов
- •Получение циклогексанов
- •Классификация[
- •Значение и применение
- •12. Арены.
- •Аннулены
- •Строение
- •Получение
- •Химические свойства
- •Критерии ароматичности.
- •Окисление аренов
1. Теоретические основы органической химии.
Теории строения органических соединений
Первой возникла в начале XIX в. теория радикалов (Ж. Гей-Люссак, Ф. Велер, Ю. Либих). Радикалами были названы группы атомов, переходящие без изменения при химических реакциях из одного соединения в другое. Такое понятие о радикалах сохранилось, но большинство других положений теории радикалов оказались неправильными.
Согласно теории типов (Ш. Жерар) все органические вещества можно разделить на типы, соответствующие определенным неорганическим веществам. Например, спирты R-OH и простые эфиры R-O-R рассматривались как представители типа воды H-OH, в которой атомы водорода замещены радикалами. Теория типов создала классификацию органических веществ, некоторые принципы которой применяются в настоящее время.
Современная теория строения органических соединений создана выдающимся русским учёным А.М. Бутлеровым.
1. Атомы в молекуле располагаются в определенной последовательности согласно их валентности. Валентность атома углерода в органических соединениях равна четырем.
2. Свойства веществ зависят не только от того, какие атомы и в каких количествах входят в состав молекулы, но и от того, в каком порядке они соединены между собой.
3. Атомы или группы атомов, входящих в состав молекулы, взаимно влияют друг на друга, от чего зависят химическая активность и реакционная способность молекул.
4. Изучение свойств веществ позволяет определить их химическое строение.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле. В 1857 г. Кекуле в своей статье по-новому раскрыл теоретический смысл трёх основных типов Жерара – водорода, воды и аммиака:
"Число атомов одного элемента, связанных с одним атомом другого, зависит от основности или величины сродства. Элементы в этом отношении распадаются на три главные группы:
1. Одноосновные или одноатомные (I), например H, Cl, Br, K.
2. Двухосновные или двухатомные (II), например O, S.
3. Трёхосновные или трёхатомные (III), например N, P, As.
Отсюда вытекают три главных типа соединений: I + I, II + 2 I, III + 3 I, или же в виде простейших своих представителей HH, OH2, NH3".
Здесь же Кекуле показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является СН4 – отсюда и введённый им тип метана.
В 1859 г. Кекуле постулировал существование кратных связей между атомами углерода, а в 1865 г. предложил структурную формулу бензола в виде плоского гексагонального кольца из атомов углерода, соединенных между собой попеременно одинарными и двойными связями. Формула Кекуле оказалась успешной при объяснении изомерии.
В 1916 г. В. Коссель предложил теорию, в которой связал распределение элементов по периодам с появлением новых электронных оболочек в структуре атома. Каждая оболочка содержит определенное максимальное число электронов. На основе некоторых, преимущественно электрохимических, фактов щелочным металлам был приписан один электрон на наружной оболочке, щелочноземельным металлам - 2 и т. д. Для гелия, неона, аргона, криптона и ксенона наружная оболочка состояла из 2 (для гелия) и из 8 электронов (для других газов), обнаруживающая, как показывали свойства этих веществ, особую устойчивость.
Таким образом, причина электроположительного и электроотрицательного характера элементов заключалась в их тенденции стремиться к состоянию атома благородного газа. Атом натрия, например, легко отдает наружный электрон, заряжается положительно, превращаясь в катион с конфигурацией атома неона. Атом же хлора стремится принять электрон, приобретает конфигурацию атома аргона и становится анионом. Обе заряженные частицы дополняют друг друга и электростатически взаимно притягиваются.
В 1916 г. появилась статья Г. Льюиса «Атом и молекула», в которой последовательно была развита идея о гомеополярной (ковалентной) связи. Согласно Г. Льюису, ковалентная связь образуется за счет пары обобществленных электронов, при этом каждый из партнеров достраивает свою электронную оболочку до наиболее устойчивой восьмиэлектронной конфигурации благородного газа.
Правило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов
Электронное строение органических соединений изображают с помощью электронных формул Льюиса. В них с помощью точек указывают положение всех валентных электронов: электронов химических связей и неподеленных пар электронов. При этом считают, что неподеленные пары электронов составляют часть внешней оболочки только одного атома, а электроны, участвующие в образовании ковалентной связи, являются частью внешней оболочки обоих атомов. Например, в приведенной ниже формуле Льюиса для тетрахлорметана все атомы имеют октет электронов.

Для каждого атома в структуре Льюиса определяют формальный заряд. При этом полагают, что атому принадлежат все неподеленные электроны и половина электронов ковалентных связей. Избыток электронов, принадлежащих атому в молекуле по сравнению со свободным атомом, обусловливает отрицательный заряд, а недостаток - положительный заряд. Сумма формальных зарядов всех атомов дает заряд частицы в целом.

При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу.
σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т. е. при осевом перекрывании АО) .
π-Связь
– ковалентная связь, возникающая при
боковом перекрывании негибридных р-АО.
Такое перекрывание происходит вне
прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи) . π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.

Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей.
1.σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами.
2.По σ-связям возможно внутримолекулярное вращение атомов, т. к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)) . Вращение по двойной (σ + π) связи невозможно без разрыва π-связи!
3.Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
Гибридизация.
Гибридизация – выравнивание (смешивание) атомных орбиталей (s и р) с образованием н овых атомных орбиталей, называемых гибридными орбиталями.
Sp-гибридизация (характерна для алкинов)
Происходит
при смешивании одной s- и одной p-орбиталей.
Образуется две равноценные sp-атомные
орбитали, расположенные линейно под
углом 180 градусов и направленные в разные
стороны от ядра атома углерода. Две
оставшиеся негибридные p-орбитали
располагаются во взаимно перпендикулярных
плоскостях и участвуют в образовании
π-связей, либо занимаются неподелёнными
парами электронов

Sp2-гибридизация (характерна для алкенов, диенов и аренов)
Три
sp² орбиталиПроисходит при смешивании
одной s- и двух p-орбиталей. Образуется
три гибридные орбитали с осями,
расположенными в одной плоскости и
направленными к вершинам треугольника
под углом 120 градусов. Негибридная
p-атомная орбиталь перпендикулярна
плоскости и, как правило, участвует в
образовании π-связей

sp3-Гибридизация (характерна для алканов) гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' . Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр

Электронные эффекты (индуктивный и мезомерный).
Индуктивный
эффект
Индуктивный
эффект (I-эффект) - это передача электронного
влияния заместителей по цепи σ-связей.
Этот эффект передаётся по цепи σ-связей
с постепенным затуханием и, как правило,
через три - четыре связи он уже не
проявляется.
Направление
индуктивного эффекта заместителя
качественно оценивают, сравнивая с со
связью С-Н, полагая её неполярной, а
индуктивный эффект водорода равным
нулю.
Электроотягивающие
заместители снижают элекроную плотность
в системе σ-связей, и их называют
электроноакцепторными. Элекроноподающие
заместители повышают электроннную
плотность в цепи σ-связей по сравнению
с атомом водорода, т. е. проявляют +I
эффект и являются элекронодонорными.
К ним относятся атомы с низкой
электроотрицательностью (например,
металлы) , а также отрицательно заряженные
атомы или группы, обладающие избытком
электронной плотности, которую они
стремятся перераспределить на соседние
связи.

 Мезомерный
эффект
Мезомерный
эффект, или эффект сопряжения (М-эффект)
, - это передача электронного влияния
эаместителей по сопряжённой системе.
Мезомерный эффект (эффект сопряжения,
резонансный эффект) - смещение электронной
плотности химической связи по π-связям.
Возникновение
мезомерного эффекта связано с изменением
профиля π-системы молекулы. Исходная
π-система перекрывается с π-системой
или p-орбиталью заместителя, в результате
чего возникает перераспределение
электронной плотности. Именно последнее
определяет наличие +М- или -М-эффекта.
Знак, как и в случае индуктивного эффекта
определяется прибавлением электронной
плотности и противоположен знаку
параметра заместителя σ в уравнении
Гаммета.
В
отличие от индуктивного эффекта
мезомерный эффект слабо затухает по
системе связей, с тем лишь отличием, что
в данном случае необходима система
кратных связей и p-орбиталей.
Наиболее
характерными +М-группами являются
группы, вносящие неподелённые электронные
пары в сопряжённую систему, такие как
амино-, гидрокси-, алкоксигруппы, галогены;
группы
с -М-эффектом содержат кратные связи с
гетероатомами. Можно привести аналогию
с разными типами атомов азота в
гетероциклах:
•для
+М характерны пиррольные гетероатомы;
•для
-М характерны пиридиновые гетероатомы.
-М-группами
являются карбонильная группа, цианогруппа
и т. п.
Группы
с системой сопряжённых углерод-углеродных
связей, таких как фенильная и винильная
группы, занимают промежуточное положение
с так называемым ±М-эффектом и проявляют
эффект, противоположный эффекту группы,
с которой связаны, усиливая его.
Примеры
мезомерного эффекта:
Мезомерный
эффект
Мезомерный
эффект, или эффект сопряжения (М-эффект)
, - это передача электронного влияния
эаместителей по сопряжённой системе.
Мезомерный эффект (эффект сопряжения,
резонансный эффект) - смещение электронной
плотности химической связи по π-связям.
Возникновение
мезомерного эффекта связано с изменением
профиля π-системы молекулы. Исходная
π-система перекрывается с π-системой
или p-орбиталью заместителя, в результате
чего возникает перераспределение
электронной плотности. Именно последнее
определяет наличие +М- или -М-эффекта.
Знак, как и в случае индуктивного эффекта
определяется прибавлением электронной
плотности и противоположен знаку
параметра заместителя σ в уравнении
Гаммета.
В
отличие от индуктивного эффекта
мезомерный эффект слабо затухает по
системе связей, с тем лишь отличием, что
в данном случае необходима система
кратных связей и p-орбиталей.
Наиболее
характерными +М-группами являются
группы, вносящие неподелённые электронные
пары в сопряжённую систему, такие как
амино-, гидрокси-, алкоксигруппы, галогены;
группы
с -М-эффектом содержат кратные связи с
гетероатомами. Можно привести аналогию
с разными типами атомов азота в
гетероциклах:
•для
+М характерны пиррольные гетероатомы;
•для
-М характерны пиридиновые гетероатомы.
-М-группами
являются карбонильная группа, цианогруппа
и т. п.
Группы
с системой сопряжённых углерод-углеродных
связей, таких как фенильная и винильная
группы, занимают промежуточное положение
с так называемым ±М-эффектом и проявляют
эффект, противоположный эффекту группы,
с которой связаны, усиливая его.
Примеры
мезомерного эффекта:

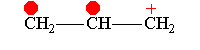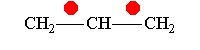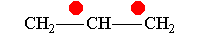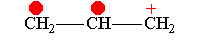

Понятие о p, π-; π,π-;σ,π-сопряжение.
Более широкие представления о сопряжении простой связи с двойной (σ,π-сопряжение) развиты А. Н. Несмеяновым.
Простейшим примером молекулы, где связь Н—С сопряжена со связью С=С, может служить молекула пропилена. В этой молекуле благодаря влиянию метильной группы возникает электрическая асимметрия двойной связи
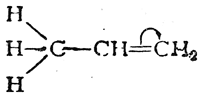
которая выражается, например, в дипольном моменте молекулы пропилена (0,35 D). Смещение π-электронной пары, очевидно, связано с некоторым смещением σ-электронов связей С—Н метильной группы в том же направлении. Обычно это изображают следующим образом:

В этом и заключается статический эффект сопряжения простых и двойных связей (σ,π-сопряжение).
Очевидно, что при таком распределении электронного облака в молекуле несколько изменится химический характер как двойной связи, так и связей С—Н метильной группы. Поэтому следует ожидать, что атомы водорода метильной группы пропилена будут более реакционноспособны, чем, например, в пропане. Экспериментальные данные подтверждают это предположение. Так, например, атомы водорода метильной группы пропилена способны легко отщепляться в виде протонов в среде жидкого дейтероаммиака (ND3) и замещаться при этом на дейтерий. Кроме того, пропилен в присутствии трехфтористого бора или галогенидов меди, серебра, бериллия как катализаторов способен вступать с формальдегидом в реакцию типа альдольной конденсации

подобно альдегидам, содержащим водородные атомы в α-положении.
 π,π-Сопряжение. Простейшим
представителем π,π-сопряженных систем
с углеродной цепью служит бутадиен-1,3
(рис. 1, а). Атомы углерода и водорода и,
следовательно, все σ-связи в его молекуле
лежат в одной плоскости, образуя плоский
σ-скелет. Атомы углерода находятся в
состоянии sр2-гибридизации.
Негибридизованные р-АО каждого атома
углерода расположены перпендикулярно
плоскости σ-скелета и параллельно друг
другу, что является необходимым условием
для их перекрывания. Перекрывание
происходит не только между р-АО атомов
С-1 и С-2, С-3 и С-4, но и между р-АО атомов
С-2 и С-3, в результате чего образуется
охватывающая четыре атома углерода
единая π-система, т. е. возникает
делокализованная ковалентная связь
(см. рис. 1, б).
π,π-Сопряжение. Простейшим
представителем π,π-сопряженных систем
с углеродной цепью служит бутадиен-1,3
(рис. 1, а). Атомы углерода и водорода и,
следовательно, все σ-связи в его молекуле
лежат в одной плоскости, образуя плоский
σ-скелет. Атомы углерода находятся в
состоянии sр2-гибридизации.
Негибридизованные р-АО каждого атома
углерода расположены перпендикулярно
плоскости σ-скелета и параллельно друг
другу, что является необходимым условием
для их перекрывания. Перекрывание
происходит не только между р-АО атомов
С-1 и С-2, С-3 и С-4, но и между р-АО атомов
С-2 и С-3, в результате чего образуется
охватывающая четыре атома углерода
единая π-система, т. е. возникает
делокализованная ковалентная связь
(см. рис. 1, б).

Рис. 1. Атомно-орбитальная модель молекулы бутадиена-1,3
Это отражается в изменении длин связей в молекуле. Длина связи С-1-С-2, а также С-3-С-4 в бутадиене-1,3 несколько увеличена, а расстояние между С-2 и С-3 укорочено по сравнению с обычными двойными и одинарными связями. Другими словами, процесс делокализации электронов приводит к выравниванию длин связей.
pπ-Сопряжение. Этот вид сопряжения чаще всего проявляется в соединениях, содержащих структурный фрагмент -CH=CH-X, где X - гетероатом, имеющий неподеленную пару электронов (прежде всего O или N). К ним относятся, например, виниловые эфиры, в молекулах которых осуществляется сопряжение двойной связи с р-орбиталью атома кислорода. Делокализованная трехцентровая связь образуется путем перекрывания двух р-АО sр2-гибридизованных атомов углерода и одной р-АО гетероатома с парой π-электронов.

Образование аналогичной делокализованной трехцентровой связи имеется в карбоксильной группе. Здесь в сопряжении участвуют π-электроны связи С=О и π-электроны атома кислорода группы ОН. К сопряженным системам с полностью выровненными связями и зарядами относятся отрицательно заряженные частицы, например ацетат-ион.

Ароматичность, антиароматичность
Ароматичность – это способность молекул некоторых соединений поддерживать индуцированных внешним магнитным полем круговой ток в молекуле, магнитное поле которого противодействует (ослабляет) внешнему магнитному полю.
В 30-е годы ХХ века немецкий химик-теоретик Хюккель сформулировал правило (называемое ныне правило Хюккеля), которое содержит четыре необходимых и достаточных условия:
Ароматическими являются:
1) плоские
2) циклические
3) системы сопряжения,
4) содержащие (4n + 2) π-электрона, где n = 0, 1, 2, 3 и т.д.).
К ароматическим соединениям относятся бензол и вещества, напоминающие его по своему химическому поведению. Бензолу присущи особые свойства, отличающие его от алифатических углеводородов, называемые ароматическими свойствами. Для непредельных алифатических углеводородов характерны реакции присоединения (присоединение происходит по кратным связям) и свободнорадикального замещения в α- положение к кратной связи, то для ароматических углеводородов характерна необычная стабильность и склонность вступать в ионные реакции электрофильного замещения, но не присоединени
Хюккель сформулировал и другое правило, объясняющее неустойчивость некоторых соединений с циклической системой сопряжения – так называемое правило Мѐбиуса (названное им в честь немецкого математика XIX века Мѐбиуса; вспомните знаменитую ленту Мёбиуса):
Антиароматическими являются:
1) плоские
2) циклические
3) системы сопряжения,
4) содержащие 4 n π-электронов, где n = 1, 2, 3 и т.д.).
При выполнении этих условий циклическое сопряжение дестабилизирует молекулу. Классическим примером такой антиароматической системы является циклобутадиен
Все попытки выделить это соединение в свободном состоянии оказались безуспешными. Например, обычная реакция дегидрогалогенирования бромциклобутена под действием спиртовой щѐлочи приводит не к циклобутадиену, а к продукту его димеризации, который является обычным ненасыщенным соединением – бицикло[2.2.0]гекса-2,5-диену:
