
- •Контрольные вопросы (часть 3) Волновая оптики
- •Законы отражения, преломления и полного внутреннего отражения света.
- •Интерференция света. Условия максимума и минимума интерференции. При каком соотношении между длиной когерентности и оптической разности хода возможно наблюдение интерференции света?
- •4. Дайте определение когерентных волн. Объясните такие понятия как время и длина когерекгности световых волн. Что такое пространственная когерентность?
- •5. Как связаны фазовые скорости распространения световых волн в среде и в вакууме? Дайте определение оптической длины пути, а также оптической разности хода двух световых волн.
- •6. Опыт Юнга и расчетная формула для расстояния между интерференционными полосами в опыте Юнга.
- •7. Полосы равного наклона. Запишите условия максимумов и минимумов интенсивности света при интерференции в тонких пленках.
- •8. Полосы равной толщины
- •9. Сформулируйте и запишите условия максимумов и минимумов интерференции света.
- •10. Кольца Ньютона и расчетная формула для радиусов темных колец Ньютона.
- •11. Дифракция света. Дифракция Френеля на круглом отверстии и на диске.
- •12. Дифракция Фраунгофера на одной щели и на дифракционной решетке.
- •13. Сформулируйте принцип Гюйгенса-Френеля. Поясните этот принцип на примере точечного источника света.
- •14. В чем заключается метод зон Френеля? Объясните с помощью метода зон Френеля? Объясните с помощью метода зон Френеля прямолинейность распространения света.
- •19. Голография. Основная идея голографии.
- •20.Изобразите схему установки для получения плоской голограммы. Поясните ход лучей на этой схеме.
- •21. Изобразите схему установки для восстановления изображения на плоской голограмме. Поясните ход лучей на этой схеме.
- •22. Естественный и поляризованный свет. Поляризация света при отражении. Закон Брюстера.
- •23.Двойное лучепреломление. Закон Малюса, одноосные кристаллы. Понятие оптической оси кристалла и главного сечения кристалла.
- •24. Искусственная изотропия, эффект Керра, метод фотоупругости.
- •26.Дисперсия света. Виды дисперсии света. Дисперсионные спектральные приборы.
- •27. Запишите формулу, описывающую поглощение света веществом (закон Бугера-Ламберта-Бера)
- •29.Изобразите ход лучей белого цвета через призму. Где это явление применяется?
- •30.Что называется a)плоскополяризованным светом; б)эллиптически поляризованным светом; в) циркулярно поляризованным светом (поляризованным по кругу)?
- •Атомная и ядерная физика
- •11. Давление света . Квантовое объяснение давление света Формула для давления.
- •12. Эффект Комптона. Формула Комптона. Какие физические законы использовались при выводе формулы Комптона?
- •13. Постулаты Бора.
- •14. Изобразите на рисунке уровни энергии атома водорода.
- •16.Изобразите на рисунке уровни энергии атома водорода и покажите переходы электрона, соответствующие серии Бальмера (см.Уровни энергии атома водорода).
- •18. Гипотеза Де Бройля
- •19. Стационарное уравнение Шредингера
- •20. Принцип неопределенности Гейзенберга. Каким соотношением он выражается?
- •21. Применение уравнения Шредингера для объяснения спектра атома водорода. Главное орбитальное и магнитное квантовые числа. Понятие о спине электрона.
- •22. Принцип Паули. Распределение электронов в атоме по состояниям. Периодическая система элементов Менделеева и её особенности.
- •23. Поглощение света, спонтанное и вынужденное излучение. Инверсия заселённости уровней. Типы лазеров и принцип их работы.
- •24. Изобразите на рисунке энергетическую трехуровневую систему, используемую в рубиновом лазере. Объясните принцип работы рубинового лазера
- •27.Ядерные реакции и законы сохранения. Реакция деления атомных ядер и понятие о ядерной энергетике.
- •28. Состав ядра атома описывается формулой , объясните смысл физических величин, входящих в эту формулу. Что такое изотопы данного химического элемента? Приведите пример изотопов.
- •29. Что такое α-распад?
- •30. Что такое β-распад?
14. Изобразите на рисунке уровни энергии атома водорода.

15. Изобразите на рисунке уровни энергии атома водорода. Электрон в атоме водорода переходит с 5-го уровня на 3-ий уровень. В какой области спектра будет находится излучение? а)ультрафиолетовой б)видимой в)инфракрасной). По какой формуле вычисляется частота излучения?
Уровни энергии атома водорода
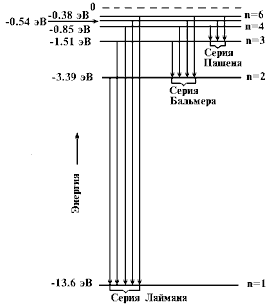
Электрон в атоме водорода переходит с 5-го на 3ий уровень. В какой области спектра будет находится излучение?
Переходы из состояний с n = 4, 5, 6, … в состояние с n = 3 образуют серию Пашена (инфракрасное излучение).
Частота излучения
v = E/h [Гц]


16.Изобразите на рисунке уровни энергии атома водорода и покажите переходы электрона, соответствующие серии Бальмера (см.Уровни энергии атома водорода).
Какие значения должны иметь n и k в сериальной формуле Бальмера, чтобы возникшее излучение имело максимальную частоту?
Переходы из состояний с n = 3, 4, 5, … в состояние с n = 2 образуют серию Бальмера (видимый свет)
Формула, описывающая серию Бальмера в спектре водорода

λ = 1/R(1/m2 – 1/n2)
R=1,1⋅1017 м-1 - постоянная Ридберга.
m - номер орбиты, на которую переходит электрон, n - номер орбиты, на которой находится электрон.
серия Бальмера – видимая серия спектра атомарного водорода. Энергия излучения данной серии выражается формулой:
E=h⋅c⋅R⋅(1/22−1/n2),n=3,4,5,...
где R = 1,097∙107 м-1 – постоянная Ридберга, h = 6,63∙10-34 Дж∙с – постоянная Планка,
с = 3∙108 – скорость света. Максимальная энергия будет при условии, что n будет очень большим (электрон в атоме переходит с уровня с очень большим номером на второй уровень). В этом случае 1/n2 будет стремится к нулю (1/n2 ≈ 0). Тогда максимальная энергия кванта
Emax=h⋅c⋅R/4.
18. Гипотеза Де Бройля
Де Бройль утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Итак,
согласно де Бройлю, с каждым микрообъектом
связываются, с одной стороны, корпускулярные
характеристики — энергия Е и импульс
р, а с другой — волновые характеристики
— частота v и длина волны X. Количественные
соотношения, связывающие корпускулярные
и волновые свойства частиц, такие же,
как для фотонов:
![]()
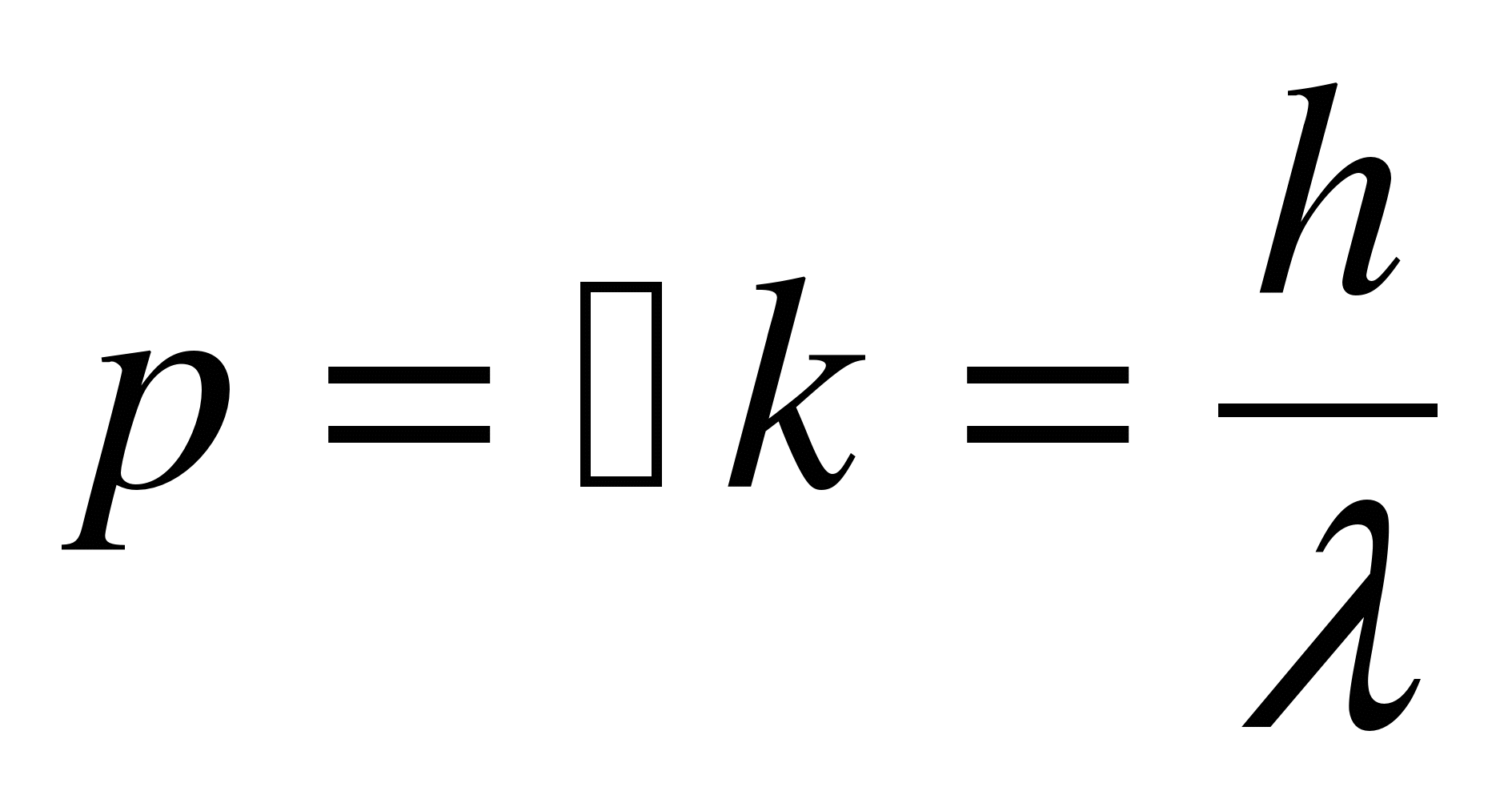
Таким образом, любой частице, обладающей импульсом, сопоставляют волновой процесс, длина волны которого определяется по формуле де Бройля:
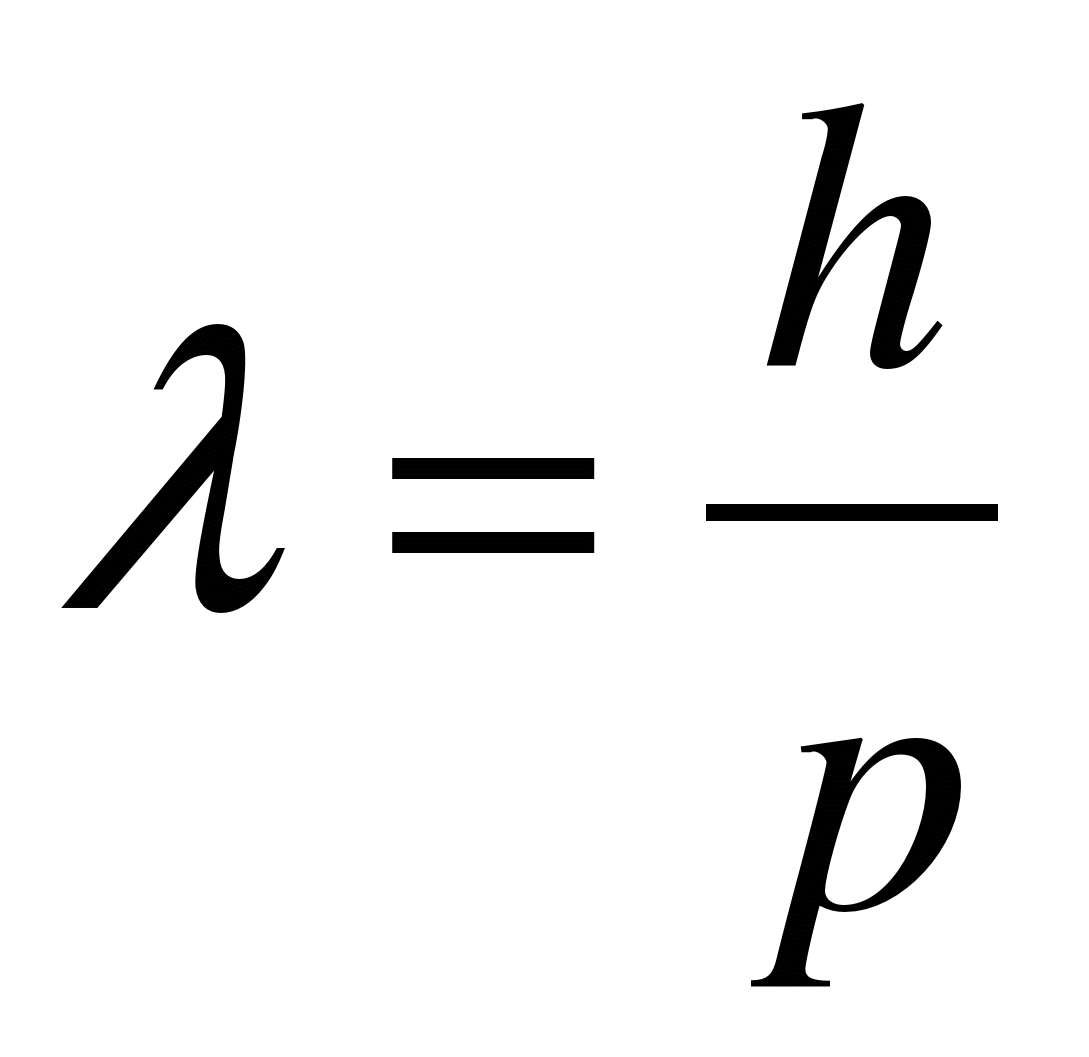
19. Стационарное уравнение Шредингера
Уравнение справедливо для любой частицы (со спином, равным 0), движущейся с малой (по сравнению со скоростью света) скоростью, т. е. со скоростью v <C с.
Уравнение Шредингера имеет вид:
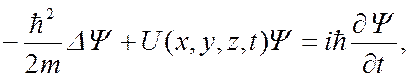
Где: m –масса частицы, i – мнимая единица,
![]() –
потенциальная
функция частицы в силовом поле, в котором
она движется,
–
потенциальная
функция частицы в силовом поле, в котором
она движется,
![]() –
искомая
волновая функция,
–
искомая
волновая функция,
∆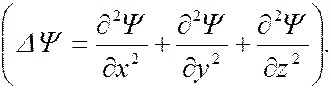 – оператор
Лапласа
– оператор
Лапласа
20. Принцип неопределенности Гейзенберга. Каким соотношением он выражается?
Объект микромира невозможно одновременно с любой наперед заданной точностью характеризовать и координатой, и импульсом.
Согласно соотношению неопределенностей Гейзенберга, микрочастица (микрообъект) не может иметь одновременно и определенную координату (x,y,z), и определенную соответствующую проекцию импульса (px,py,pz), причем неопределенности этих величин удовлетворяют условиям
![]()
т. е. произведение неопределенностей координаты и соответствующей ей проекции импульса не может быть меньше величины порядка h.
