
- •М.А. Жужа молекулярная физика
- •Краснодар
- •Предисловие
- •Введение
- •1. Броуновское движение
- •2. Законы идеального газа
- •3. Барометрическая формула. Распределение Больцмана. Опыт Перрена
- •4. Основное уравнение молекулярно-кинетической теории идеального газа
- •5. Распределение Максвелла
- •6. Средняя длина свободного пробега и число столкновениЙ
- •Vмол30 1030 м3, м.
- •7. Явления переноса
- •7.1. Диффузия в газах
- •7.2. Внутреннее трение
- •7.3. Теплопроводность
- •8. Первое начало термодинамики
- •9. Классическая теория теплоЁмкости идеального газа
- •10. Адиабатический процесс
- •11. Политропический процесс
- •12. Энтропия. Второе и третье начала термодинамики
- •13. Расчет изменения энтропии в процессах идеального газа, при нагревании и плавлении
- •14. Цикл Карно
- •15. Реальные газы. Критическое состояние
- •16. Уравнение Ван-дер-Ваальса
- •17. Особенности жидкого состояния вещества и воды
- •18. Поверхностное натяжение
- •19. Условия равновесия на границах различных сред
- •20. Мыльные пузыри и Формула Лапласа
- •21. Капилляры
- •22. Фаза. Фазовое равновесие. ФазовыЕ переходы
- •23. Уравнение Клапейрона Клаузиуса. Фазовая диаграмма состояний
- •24. Эффект Джоуля-Томсона
- •25. Методы получения низких температур и сжижения газов
- •26. Термодинамическая шкала температур. Термометры
- •27. Твёрдые тела. Симметрия кристаллов. Дефекты в кристаллах
- •28. Классическая теория теплоёмкости твёрдых тел
- •29. Квантовая статистика: Распределения Бозе-Эйнштейна и Ферми-Дирака
- •30. Квантовые теории теплоёмкости эйнштейна и дебая. Фононы
- •Пример выполнения триз-задания 30
- •Дополнительные триз-задания
- •Рекомендуемая литература по молекулярной физике*
- •Рекомендуемая литература по трИз
- •Оглавление
8. Первое начало термодинамики
Внутренняя энергия U термодинамической системы состоит из кинетической энергии всех внутренних движений частиц (поступательных, вращательных, колебательных) и потенциальной энергии их взаимодействия. Для идеального газа пренебрегают потенциальной энергией. Поэтому внутренняя энергия идеального газа определяется кинетической энергией его молекул, которая зависит только от температуры.
Внутренняя энергия является функцией состояния, т.е. определяется только состоянием системы (в данном случае – температурой) и не зависит от вида перехода в это состояние.
Если
система совершает круговой процесс
(цикл), возвращаясь в начальное состояние,
то полное изменение её внутренней
энергии
равно нулю:
![]() .
Как известно, математически это
соотношение
означает, что элементарное изменение
dU
является полным (точным) дифференциалом.
.
Как известно, математически это
соотношение
означает, что элементарное изменение
dU
является полным (точным) дифференциалом.
Изменить внутреннюю энергию системы можно двумя способами: 1) совершить механическую работу; 2) сообщить системе или отнять у неё некоторое количество теплоты.
Первое начало термодинамики: количество теплоты, сообщённое системе, идет на приращение её внутренней энергии и на совершение системой работы над внешними телами:
Q = U + A или Q = dU + A. (40)
Входящие в формулу (40) величины могут быть как положительными, так и отрицательными. Если количество теплоты передается системе, она нагревается и сама совершает работу над внешними телами, то величины – положительны. Если количество теплоты отбирается от системы, она остывает, и внешние силы совершают над ней работу, то величины – отрицательны.
Если система, например рабочее тело, в периодически действующем двигателе совершает круговой процесс (цикл), т.е. возвращается в исходное состояние, то U = 0 и при этом A = Q. Отсюда следует вторая формулировка первого начала термодинамики: невозможен вечный двигатель первого рода, т.е. такое периодически действующее устройство, которое бы совершало работу в большем количестве, чем полученная им извне энергия.
Найдём работу, которую совершает газ при расширении. Пусть газ, действуя на поршень с силой F = pS, перемещает его на расстояние dx (рис. 22) и совершает элементарную работу
 A
= F
dx
= pS
dx
= p
dV.
A
= F
dx
= pS
dx
= p
dV.
Полная работа находится интегрированием:
 .
(41)
.
(41)
На графике в координатах (p, V) работа равна площади фигуры, ограниченной осью V, прямыми V1 и V2 и кривой p = f (V). Из рис. 23 видно, что работа (площадь под кривой) зависит от вида перехода системы из состояния 1 в состояние 2. Поэтому работа А не является функцией состояния, а её элементарное изменение не является полным дифференциалом. Для элементарной работы употребляют обозначения А или dA (а не дифференциал dA).
Е сли
внешние силы уменьшают объём газа
(рис. 24), то при интегрировании получается
«отрицательная» работа, так как верхний
предел интегрированияV2
меньше нижнего V1.
сли
внешние силы уменьшают объём газа
(рис. 24), то при интегрировании получается
«отрицательная» работа, так как верхний
предел интегрированияV2
меньше нижнего V1.
Применим первое начало термодинамики к изопроцессам.
И
 зохорический
процесс
V
= const
(рис. 25). Так как V = const,
то dV
= 0 и А
= 0. Из уравнения первого начала
термодинамики (40) остается Q
= U.
В изохорическом процессе всё количество
теплоты, подводимое к системе, полностью
идет на изменение её внутренней энергии.
зохорический
процесс
V
= const
(рис. 25). Так как V = const,
то dV
= 0 и А
= 0. Из уравнения первого начала
термодинамики (40) остается Q
= U.
В изохорическом процессе всё количество
теплоты, подводимое к системе, полностью
идет на изменение её внутренней энергии.
Изобарический процесс р = const (рис. 26). В этом процессе изменяется внутренняя энергия и совершается работа Q = dU + pdV. Работа в данном случае вычисляется очень просто (это площадь прямоугольника):
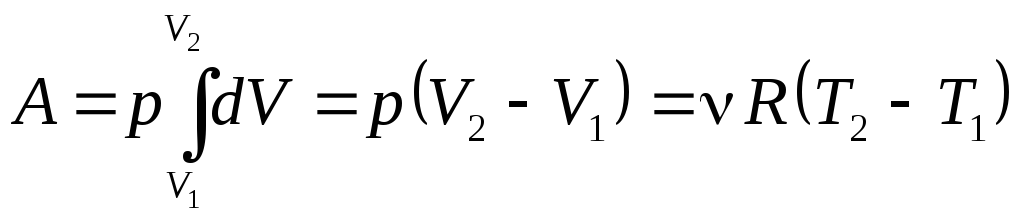
 .
(42)
.
(42)
Выражение (42) определяет физический смысл газовой постоянной: если = 1 моль и Т2 – Т1 = 1 К, то А = R, т.е. газовая постоянная R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К [Дж/(мольК)].
И зотермический
процесс
T
= const
(рис. 27). В этом процессе dU
= 0, следовательно, Q
= A,
т.е. всё подводимое количество теплоты
тратится на совершение работы. Для
нахождения работы выразим зависимость
p
= f
(V)
из уравнения Менделеева-Клапейрона:
p
= RT/V.
Работа равна:
зотермический
процесс
T
= const
(рис. 27). В этом процессе dU
= 0, следовательно, Q
= A,
т.е. всё подводимое количество теплоты
тратится на совершение работы. Для
нахождения работы выразим зависимость
p
= f
(V)
из уравнения Менделеева-Клапейрона:
p
= RT/V.
Работа равна:
![]() .
(43)
.
(43)
ТРИЗ-задание 18. Эрратология в (молекулярной) физике
Основатель ТРИЗ Г.С. Альтшуллер был ещё и писателем-фантастом. Он проанализировал фантастическую литературу и составил «Регистр научно-фантастических идей». В «регистре» имеется литературное произведение (П. Амнуэль «Странник»), в котором описана новая наука эрратология – наука о научных ошибках. Изучая молекулярную физику (и физику вообще), наполните науку эрратологию соответствующим содержанием – ошибочными гипотезами в развитии физики. Например, до середины XIX в. господствовала теория теплорода в учении о теплоте. Теплород – это невесомое вещество, которое, как считалось, является причиной тепловых явлений. Увеличение теплорода в теле вызывает повышение его температуры, а убыль теплорода из тела понижает его температуру. Теория теплорода была отвергнута в результате опытов – был установлен механический эквивалент теплоты (1 кал = 4,19 Дж), и это послужило опорой для принятия молекулярно-кинетической теории. Однако в физике из теории теплорода остались некоторые термины, например, «количество теплоты» и «теплоёмкость». Какие ещё общепринятые в физике термины напоминают о научных заблуждениях?
