
- •Модуль 8 «Электрохимия» Лекция 32
- •Физическая и химическая теории растворов.
- •Сольватация (гидратация). Электролитическая диссоциация
- •Закон электронейтральности
- •Степень диссоциации, изотонический коэффициент
- •Закон разбавления Оствальда
- •Константа диссоциации. Ступенчатая диссоциация
- •Константа гидролиза
- •Ионные равновесия в растворах. Ионное произведение воды.
- •Буферные растворы
- •Ионные равновесия в растворах электролитов в присутствии твердой фазы. Произведение растворимости
- •Активность растворов электролитов
- •Основные положения теории Дебая и Гюккеля
- •Процессы переноса в электрохимических системах
- •Электрическая проводимость. Абсолютная скорость и подвижность ионов
- •Числа переноса
Основные положения теории Дебая и Гюккеля
Дебай и Гюккель приняли основную идею Гхоша о кристаллоподобном распределении ионов в растворе. Однако в растворе ионы в результате теплового движения располагаются вокруг какого-то центрального иона в виде сферы. Так как в растворе преобладает поступательное движение (а не колебательное, как в кристаллах), ионы, входящие в состав сферы, окружающей центральный ион, непрерывно обмениваются своими местами с другими ионами. Такая статистическая сфера называется ионной атмосферой. Все ионы раствора равноценны, каждый из них окружен ионной атмосферой, и, в то же время, каждый центральный ион входит в состав ионной атмосферы какого-либо другого иона. Существование ионных атмосфер и есть тот характерный признак, который по Дебаю и Гюккелю отличает реальные растворы электролитов от идеальных.
В
очень разбавленных растворах сильных
электролитов можно условно считать,
что взаимодействие между ионами целиком
определяется электростатическими
силами. Поэтому теория растворов
электролитов Дебая и Гюккеля называется
электростатической. Данная теория
базируется на ряде допущений: Все
молекулы электролита полностью
распадаются на ионы
![]()
Ионы - точечные заряды (процессами сольватации можно пренебречь).
Можно пренебречь всеми видами взаимодействий в растворе, кроме электростатического взаимодействия иона с его ионной атмосферой.
Электростатическое поле иона и ионная атмосфера имеют шаровую симметрию.
Диэлектрическая проницаемость раствора равна диэлектрической проницаемости чистого растворителя (электролит не влияет на диэлектрические свойства).
Потенциал
вокруг иона (согласно теории Дебая и
Гюккеля) складывается из потенциала
иона
![]() и потенциала ионной атмосферы
и потенциала ионной атмосферы
![]() ,
,
Для точки r, расположенной на расстоянии r от центрального иона, его потенциал (кулоновский потенциал) с учетом диэлектрической проницаемости среды s определяется выражением
![]() , (32.23)
, (32.23)
где
![]() Ф/м
- диэлектрическая постоянная вакуума
(электрическая постоянная). Таким
образом, в растворе чисто кулоновский
потенциал понижается в s
раз по сравнению с его величиной для
изолированного иона в вакууме.
Ф/м
- диэлектрическая постоянная вакуума
(электрическая постоянная). Таким
образом, в растворе чисто кулоновский
потенциал понижается в s
раз по сравнению с его величиной для
изолированного иона в вакууме.
Второй
эффект в растворе вызван наличием ионной
атмосферы. Установлено, что потенциал
уменьшается с расстоянием r
более резко, чем это предсказывает
уравнение (32.23). Отмеченное обусловлено
наличием слабого противоположного
заряда ионной атмосферы, которая
притягивается к центральному иону. В
такой ситуации говорят, что центральный
заряд экранирован,
и
соответствующий потенциал
![]() называется экранированным
кулоновским потенциалом, для
которого 1/r
в уравнении (32.23) заменяется на
называется экранированным
кулоновским потенциалом, для
которого 1/r
в уравнении (32.23) заменяется на
![]() где
где параметр
где
где параметр
![]() определяет, как сильно отличается этот
потенциал от чисто куло-новского.
Величина
для рассматриваемой точки r
представляет собой среднее значение
потенциала, создаваемого в ней ионной
атмосферой и центральным ионом, и
определяется выражением
определяет, как сильно отличается этот
потенциал от чисто куло-новского.
Величина
для рассматриваемой точки r
представляет собой среднее значение
потенциала, создаваемого в ней ионной
атмосферой и центральным ионом, и
определяется выражением
 . (32.24)
. (32.24)
Для
реальных растворов специфическим
является потенциал ионной атмосферы,
который находят по правилу суперпозиции
потенциалов как разность
и
![]() .
Для точки r
его
величина определяется выражением
.
Для точки r
его
величина определяется выражением
![]() (32.25)
(32.25)
Для
вычисления энергии взаимодействия
необходимо определить потенциал ионной
атмосферы в точке нахождения центрального
иона, т. е найти предел
![]() при
при
![]() ,
который определяется выражением
,
который определяется выражением
![]() (32.26)
(32.26)
Величину
![]() в соответствии с уравнением (32.26) можно
рассматривать как потенциал, создаваемый
в точке нахождения центрального иона
другим ионом с противоположным знаком,
находящимся от центрального иона на
расстоянии
в соответствии с уравнением (32.26) можно
рассматривать как потенциал, создаваемый
в точке нахождения центрального иона
другим ионом с противоположным знаком,
находящимся от центрального иона на
расстоянии
![]() Величина
называется характеристической
длиной 4(или
радиусом) ионной атмосферы, под
которым следует понимать то расстояние
от центрального иона, на котором надо
было бы разместить все заряды, входящие
в ионную атмосферу, чтобы их суммарное
влияние на центральный ион было бы равно
суммарному влиянию существующей ионной
атмосферы. Эта величина является
условной, так как в действительности
плотность заряда ионной атмосферы
убывает монотонно, приближаясь к нулю.
Практически на расстоянии
плотность заряда ионной атмосферы
становится пренебрежимо малой. Радиус
ионной атмосферы рассчитывается по
уравнению
Величина
называется характеристической
длиной 4(или
радиусом) ионной атмосферы, под
которым следует понимать то расстояние
от центрального иона, на котором надо
было бы разместить все заряды, входящие
в ионную атмосферу, чтобы их суммарное
влияние на центральный ион было бы равно
суммарному влиянию существующей ионной
атмосферы. Эта величина является
условной, так как в действительности
плотность заряда ионной атмосферы
убывает монотонно, приближаясь к нулю.
Практически на расстоянии
плотность заряда ионной атмосферы
становится пренебрежимо малой. Радиус
ионной атмосферы рассчитывается по
уравнению
 , (32.27)
, (32.27)
Где
![]() моль
моль![]() - постоянная Авогадро;
- постоянная Авогадро;
![]() число
ионов в единице объема (1м
число
ионов в единице объема (1м![]() ).
Для удобства в это выражение вводят
вместо
молярную концентрацию (
).
Для удобства в это выражение вводят
вместо
молярную концентрацию (![]() моль/л) используя соотношение
моль/л) используя соотношение
![]() Тогда
с учетом (32.20)
Тогда
с учетом (32.20)
 . (32.28)
. (32.28)
Энергия Гиббса электростатического взаимодействия ионов рассчитывается по законам электростатики:
![]() . (32.29)
. (32.29)
Как уже отмечалось, работа, совершаемая системой в неидеальном состоянии, равна убыли термодинамического потенциала, т. е.
![]() (32.30)
(32.30)
Зная потенциал ионной атмосферы в точке нахождения центрального
Иона
![]() можно, исходя из выражений (32.29) и (32.30),
рассчитать работу W,
на 1 моль электролита, которую необходимо
затратить на разрушение ионной атмосферы:
можно, исходя из выражений (32.29) и (32.30),
рассчитать работу W,
на 1 моль электролита, которую необходимо
затратить на разрушение ионной атмосферы:
![]() (32.31)
(32.31)
Подставляя
в это выражение значение
![]() из (32.25), имеем
из (32.25), имеем
![]() . (32.32)
. (32.32)
Выражение
(32.32) в сочетании с (32.17) дает выражение
для расчета коэффициента активности
данного сорта ионов
![]()
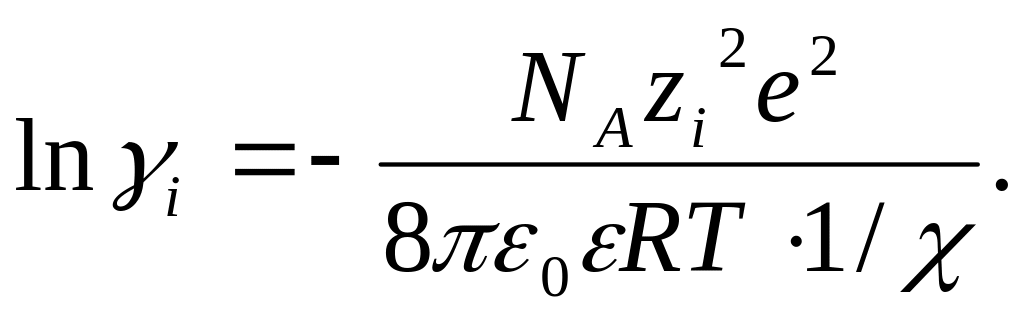 (32.33)
(32.33)
Подстановка значения из (32.28) в (32.33) приводит к
 (32.33а)
(32.33а)
В
большинстве случаев нужно знать также
и средний коэффициент активности
электролита
![]() ,
причем
опытные данные позволяют найти именно
эту величину. Рассмотренный выше материал
позволяет рассчитать средний коэффициент
активности для раствора электролита,
образованного из соединения с общей
формулой
,
причем
опытные данные позволяют найти именно
эту величину. Рассмотренный выше материал
позволяет рассчитать средний коэффициент
активности для раствора электролита,
образованного из соединения с общей
формулой
![]() Из определения среднего коэффициента
активности по аналогии с (32.19) для данного
раствора электролита
Из определения среднего коэффициента
активности по аналогии с (32.19) для данного
раствора электролита
![]() получим
или в логарифмическом виде:
получим
или в логарифмическом виде:
![]() (32.34)
(32.34)
Исходя из (32.34)
 ,
и
,
и

Подставляя
значения
![]() и
и
![]() в уравнение (32.34), после преобразований
с учетом закона электронейтральности
(32.1), перейдя к десятичным логарифмам и
подставив значения постоянных величин,
получим:
в уравнение (32.34), после преобразований
с учетом закона электронейтральности
(32.1), перейдя к десятичным логарифмам и
подставив значения постоянных величин,
получим:
![]() (32.35)
(32.35)
Обозначая
![]() через В,
имеем
через В,
имеем
![]() (32.36)
(32.36)
или для 1 -1 – электролитов
![]() (32.37)
(32.37)
Уравнение
(32.36) представляет собой предельный
закон Дебая-Гюккеля, а
коэффициент B
называют
предельным
коэффициентом или
коэффициентом
предельного закона Дебая-Гюккеля. При
298K и диэлектрической постоянной раствора,
равной диэлектрической постоянной воды
![]() B
= 0,509.
B
= 0,509.
Все
допущения Дебая и Гюккеля приводят к
тому, что предельный закон Дебая и
Гюккеля, называемый также первым
приближением теории
Дебая и Гюккеля, справедлив лишь по
отношению к разбавленным растворам
электролитов с ионами низкой зарядности.
В водных растворах он соблюдается лишь
при ионной силе меньше
![]() Однако этот закон имеет большое значение,
поскольку эмпирическая зависимость
Однако этот закон имеет большое значение,
поскольку эмпирическая зависимость
![]() от
от
![]() получает теоретическое обоснование.
Другими словами, в этом законе получило
теоретическое обоснование правило
ионной силы.
получает теоретическое обоснование.
Другими словами, в этом законе получило
теоретическое обоснование правило
ионной силы.
Во втором приближении теории Дебая и Гюккеля учитываются конечные размеры ионов с помощью параметра a и влияние других ионов на радиус рассматриваемого иона с помощью коэффициента b. Параметр a определяется как среднее расстояние при максимальном сближении ионов. Однако точное определение физического смысла этой величины для растворов электролитов затруднено. В связи с тем, что методы независимого определения параметра a не существуют, он часто рассматривается как эмпирическая константа, отражающая конечные размеры ионов. Уравнение второго приближения имеет вид
![]() . (32.38)
. (32.38)
Коэффициент
b
для
воды при 298 K
равен
![]() и
сравнительно мало изменяется с
температурой. Параметр a
подбирают
таким образом, чтобы рассчитанные по
(32.38) коэффициенты активности совпадали
с опытными. По порядку величины он близок
к размеру ионов (
и
сравнительно мало изменяется с
температурой. Параметр a
подбирают
таким образом, чтобы рассчитанные по
(32.38) коэффициенты активности совпадали
с опытными. По порядку величины он близок
к размеру ионов (![]() см).
Уравнение (32.38) для водных растворов
может быть применено вплоть до ионной
силы 0,1. Для многих электролитов величина
ионного параметра a
оказывается
равной
см).
Уравнение (32.38) для водных растворов
может быть применено вплоть до ионной
силы 0,1. Для многих электролитов величина
ионного параметра a
оказывается
равной
![]() см,
т. е.
см,
т. е.
![]() .
В этих случаях из (32.38) получаем уравнение
.
В этих случаях из (32.38) получаем уравнение
![]() , (32.39)
, (32.39)
применимое для растворов с ионной силой не более 0,05.
Для более широкой области изменения ионной силы растворов применяется уравнение
![]() (32.40)
(32.40)
учитывающее
уменьшение диэлектрической постоянной
в непосредственной близости к иону.
Коэффициент d
-
это поправка, учитывающая влияние
растворенного электролита на
диэлектрические свойства раствора и
определяющаяся практически из
экспериментальных данных по зависимости
от концентрации. В концентрированных
растворах
![]() может быть больше единицы, так как силы
отталкивания могут превысить силы
притяжения между ионами.
может быть больше единицы, так как силы
отталкивания могут превысить силы
притяжения между ионами.
