
- •Модуль 8 Лекция 33
- •Удельная электрическая проводимость
- •Молярная электрическая проводимость
- •Двойной электрический слой. Равновесный электродный потенциал. Уравнение Нернста
- •Стандартный электродный потенциал
- •Термодинамическое равновесие в электрохимических системах
- •Классификация обратимых электрохимических систем
- •Неравновесные электродные процессы
- •Отклонения от равновесного потенциала
- •Прохождение электрического тока в электрохимической системе. Законы Фарадея
Термодинамическое равновесие в электрохимических системах
Если в электрохимической системе обратимо и изотермически протекает реакция
![]() (33.31)
(33.31)
Как
известно из химической термодинамики,
константа равновесия, выраженная через
активности реагентов, в изобарно-изотермических
условиях определяется по уравнению:
![]()
то при постоянном давлении изменение термодинамического потенциала G соответствует электрической энергии системы
![]() (33.32)
(33.32)
Электрическая
работа при изобарно-изотермическом
обратимом процессе совершается за счет
убыли энергии Гиббса, т. е
![]() ,
где z
— число
электронов, участвующих в электродных
реакциях (одинаковое для обоих ионов).
,
где z
— число
электронов, участвующих в электродных
реакциях (одинаковое для обоих ионов).
Отсюда
![]() или
или
![]() (33.33)
(33.33)
Классификация обратимых электрохимических систем
В термодинамически обратимых системах обе электрохимические реакции таковы, что их можно провести термодинамически обратимо. В термодинамически необратимых системах хотя бы одна электрохимическая реакция не является обратимой.
Если термодинамически необратимую систему, например,
![]()
замкнуть на очень большое внешнее сопротивление так, чтобы электрохимические реакции протекали очень медленно, то на отрицательном электроде начнется реакция ионизации металлического цинка .Электроны во внешней цепи потекут к медному электроду, на котором единственной восстановительной реакцией будет реакция восстановления ионов гидроксония
Если
же подключить эту систему к внешнему
источнику напряжения (отрицательный
полюс к цинковому электроду, а положительный
- к медному) и отрегулировать напряжение
внешнего источника тока так, чтобы очень
малый ток пошел бы в обратном направлении,
то на цинковом электроде будет протекать
восстановительная реакция
![]() а
на медном - окисление металлической
меди
а
на медном - окисление металлической
меди
![]()
Для термодинамически необратимых систем, электрохимические реакции, протекающие на электродах при прохождении очень малого тока в одном направлении, отличаются от электрохимических реакций, протекающих при прохождении тока в обратном направлении.
В термодинамически обратимой системе, например,
![]()
![]()
![]()
(здесь c-концентрация), и если она отдает бесконечно малый ток во внешнюю цепь, идут реакции:
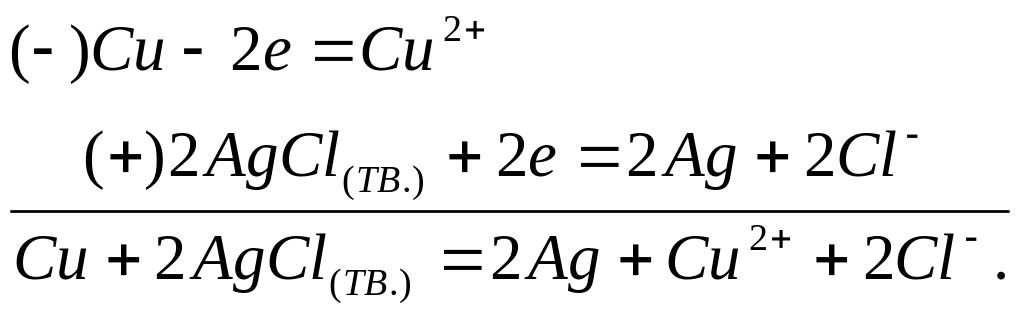
Если же система подключена к внешнему источнику напряжения, и бесконечно малый ток течет в обратном направлении, то протекают реакции:
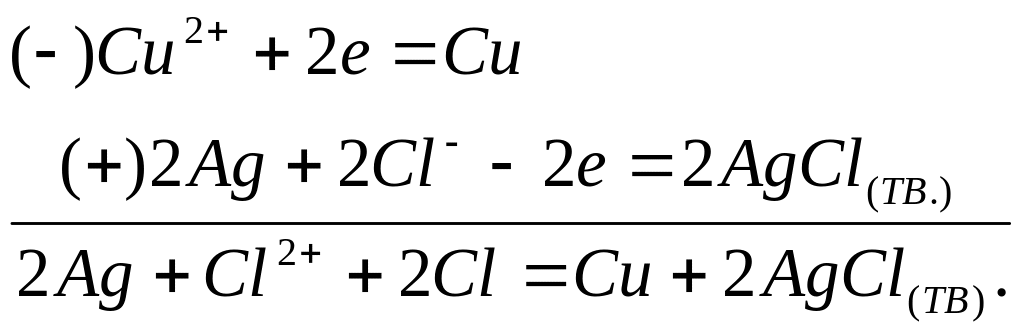
То в этом случае, как электрохимические реакции, так и химические реакции в системе остаются одни и те же, но меняют свое направление при изменении направления тока.
Химические и концентрационные цепи
Из уравнения Нернста (33.19) видно, что величина равновесного потенциала отдельного электрода зависит и от природы потенциалопределяющих ионов и от активностей ионов, участвующих в электродных реакциях. Поэтому электрохимические цепи можно разделить на два типа: химические и концентрационные.
Химические цепи состоят из различных электродов с различными химическими реакциями и ЭДС возникает за счет суммарной химической реакции, например:
![]()
в которой протекает реакция:
![]()
Электрохимические цепи, такого типа имеют широкое практическое применение в, например, химических источниках тока.
Концентрационные
цепи состоят
из одинаковых электродов с одинаковыми
химическими реакциями, но ЭДС возникает
за счет различной активности
![]() потенциалопределяющих
ионов, например:
потенциалопределяющих
ионов, например:
![]()
![]()
Например,
концентрационной цепью является
стеклянный
электрод (рис.
9), у которого активность ионов
![]() в растворах по обе стороны
мембраны
в растворах по обе стороны
мембраны
|
различна,
а ЭДС есть разность потенциалов
между двумя сторонами мембраны (которая
представляет собой тонкую пленку из
специального
стекла, проницаемого для ионов
)
по обе стороны которой находятся
растворы
с различным pH с активностями
От уже рассмотренных электродов он отличается тем, что электродная реакция сводится к обмену ионами водорода между двумя фазами - раствором и стеклом, поэтому стеклянный электрод относят к ионообменных (ионоселек-тивных) электродов. На границе раздела, скачок
|
потенциала возникает вследствие разницы концентраций ионов. Это позволяет использовать стеклянный электрод для измерения pH растворов.
Потенциал
водородного электрода при
![]() связан
с
связан
с
![]() раствора
соотношением:
раствора
соотношением:
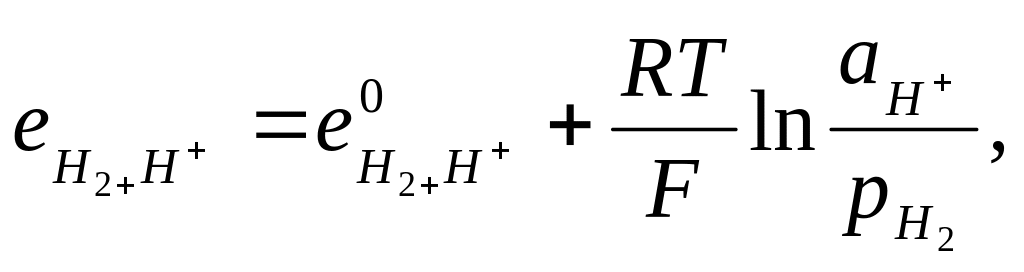 (33.34)
(33.34)
а так как стандартный потенциал водородного электрода равен нулю
![]()
![]()
Зависимость потенциала водородного электрода от pH при температуре 298 K:
![]() (33.35)
(33.35)

