
- •9) Изменение кислотно-основных свойств оксидов и гидроксидов
- •8) Гидролиз солей
- •24) Гидратация алкенов
- •33) Общая х-ка непредельных двухосн к-т. Фумаровая и малеиновая к-ты. Хим св-ва:вз-е со Спиртами, h2, галогенами, hHal. Ок-е kMnO4 в водн р-ре. Отл-е маллеин и фумаров к-т
- •Биуретовая р-я
- •Ксантопротеиновая только Na идет на oh и соон гр
- •38) Моносахариды. Классификация. Структура пентоз и гексоз, входящих в состав углеводов.
- •40)Классификация полимеров
- •46.Общая хар-ка эл-ческих методов анализа.Потенциометрия,сущность метода.Электрод сравнения и индикаторный электрод.Расчет электродных потенциалов.
- •47. Кулонометрия, теоретические основы метода. Косвенная кулонометрия. Внешняя и внутренняя генерация кулонометрическоготитранта. Определение конечной точки титрования.
- •50. Кислотно-основные равновесия в реакциях сольволиза. Расчет рН в растворах солей.
- •51.Буферные растворы. Механизм буферного действия. Расчет рН буферных растворов.
- •54.Титриметрический метод анализа.Определение,сущность метода,его достоинства.Требования ,предъявляемые к реакциям в титриметрии.Расчет результата прямого обратного и косвенного титрования.
- •55.Перманганатометрическое титрование. Приготовление и стандартизация титранта. Условия титрования,определения конечной точки титрования. Практическое применение метода.
- •56.Кислотно-основное титрование. Кривые титрования и выбор индикатора. Практическое применение методов кислотно-основного титрования.
- •57. Комплексонометрия (хелатометрия). Рабочие растворы и индикаторы метода. Практическое применение комплексонометрии.
- •58.Сущность и классификация хроматографических методов анализа. Тонкослойная хроматография.
- •61)Общий смысл второго начала термодинамики. Расчет изменения энтропии в процессах изотермического расширения и сжатия газа, изотермического изменения концентрации раствора, в фазовых переходах.
- •62)Изотермо-изохорные и изотермо-изобарные процессы в закрытых системах. Энергия Гельмгольца и свободная энергия Гиббса в закрытых системах.
- •63)Общий анализ однокомпонентных систем. Диаграмма состояния воды. Физический смысл диаграммы состояния воды.
- •64)Фазовое равновесие раствор-пар растворителя (закон Рауля) Следствие из закона Рауля. Природа эбулиоскопической и криоскопической констант. Осмотическое давление растворов.
- •Следствие из закона Рауля. 1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •65)Затвердевание бинарных жидких смесей. Диаграмма состояния системы с неограниченной растворимостью компонентов в жидком и твердом состоянии.
- •66)Расчет коэффициента активности и среднего коэффициента активности по теории Дебая-Хюккеля. Предельный случай.
- •69)Электродные потенциалы. Механизм возникновения электродных потенциалов. Зависимость электродного потенциала от активностей участников полуреакции, рН среды.
- •73)Общие понятия о гетерогенных процессах. Диффузия. Законы Фика. Скорость гетерогенных реакций.
- •78)Гетерогенные системы. Понятие фазы, комонента, степени свободы. Правило фаз Гиббса и его вывод.
- •79) Основные закономерности хт. Понятие хтп
- •80. Скорость хим.Р-и. Общая скорость хим.Пр-са.
- •81. Термодинамические расчеты химико-технологических процессов.Равновесие в системе. Расчет равновесия по термод.Данным.Термодинамический анализ.
- •82. Химическое производство как система. МоделированиеХтп. Организация хтп. Выбор схемы процесса. Управление хп.
- •83. Характеристика и классификации процессов хп
- •85. Тепловые процессы
- •86. Массообменные процессы
- •87. Принципы проектирования химических реакторов. Классификация химических реакторов. Конструкции химических реакторов.
- •88. Устройство контактных аппаратов
- •89. Общая характеристика гомогенных процессов. Гомоген.Пр-сы в газовой,жидкой фазах.
- •91. Процессы в бинарных твердых, двухфазных жидких и многофазных системах
- •92. Высокотемпературные процессы и аппараты
- •93. Каталитические процессы и аппараты. Сущность и виды катализа
33) Общая х-ка непредельных двухосн к-т. Фумаровая и малеиновая к-ты. Хим св-ва:вз-е со Спиртами, h2, галогенами, hHal. Ок-е kMnO4 в водн р-ре. Отл-е маллеин и фумаров к-т
Наиболее простые ненасыщенные двухосновные кислоты – малеиновая и фумаровая. Эти кислоты являются пространственными изомерами бутендиовой к-ты Фумаровая – транс-, а малеиновая – цис-изомер.
Как и все цис- транс- изомеры отл-ся по физ-хим св-м. маллеин к-та в прир не найдена!! Ее получ кt ок-ем бензола кислородом возд на kt V2O5.
Фумаров к-та шир распростр в прир. Сод-я в грибах, лишайн, уч-ет в биохим пр-сах. В пром-ти ее пол изомеризац маллеинов к-ты при нагревании или облучении.
34)Общая характеристика оксокислот. Номенклатура. Изомерия. Сп-бы пол-я. Оксокислоты – гетерофункциональные соединения,
содержащие карбоксильную и карбонильную (альдегидную или кетонную) группы. В соотв с этим выдел альдегидок-ты и кеток-ты.
Оксок-ты могут содерж 1, 2 и более COOH групп.
П![]()
![]()
![]() о
взаимному расположению карбоксильной
и карбонильной групп различают α-, β-,
γ- и т.д. оксокислоты. По номенкл ИЮПАК
назв строят путем введения префикса –
оксо. Для мн оксок-т сохр-сь тривиальн
назв-я. (пировиноградн, оксобутандиовая
(щавелево-уксусная),
α-оксоглутаровая(2-пентандиовая),
4-оксопентановая (левулиновая). Изомерия
углер скел, полож-я карбонильн гр.,
межкласс. Для получения оксокислот
применимы обычные методы введения
карбоксильной и оксогрупп. Специфический
метод синтеза b -кетокислот – сложноэфирная
конденсация.
о
взаимному расположению карбоксильной
и карбонильной групп различают α-, β-,
γ- и т.д. оксокислоты. По номенкл ИЮПАК
назв строят путем введения префикса –
оксо. Для мн оксок-т сохр-сь тривиальн
назв-я. (пировиноградн, оксобутандиовая
(щавелево-уксусная),
α-оксоглутаровая(2-пентандиовая),
4-оксопентановая (левулиновая). Изомерия
углер скел, полож-я карбонильн гр.,
межкласс. Для получения оксокислот
применимы обычные методы введения
карбоксильной и оксогрупп. Специфический
метод синтеза b -кетокислот – сложноэфирная
конденсация.
Гидролиз дигалогензамещенных к-т Cl2CHCOOH +H2O = (H)O –C – COOH глиоксалевая+ 2HCL
М
 ягкое
ок-е гликолей
ягкое
ок-е гликолей
Гидролиз α-оксонитрилов
![]()
Ок-е гидроксик-т
35) Химические свойства оксокислот:кислотные св-ва,р-и по COOH и C=O группе.α-оксок-ты. Специфические св-ва α-оксок-ты Оксокислоты вступают в реакции, характерные для карбоксильной и карбонильной групп. Они образуют соли, эфиры, амиды по карбокильной группе. А также оксимы (гидроксиламин NH2OH), ацетали (2 молек. С2Н5ОН), гидрозоны (NH2NH2) по карбонильной. Из-за взаимного длияния двух групп проявляют специфические свойства. Отличительная черта оксокислот – легкость, с которой протекает их декарбоксилирование.
Предст α-оксок-т – глиоксалевая и пировиноградная. 1) глиоксалевая к-та при обычн усл – сиропообразн жидк-ть при кипячении со щелочами быстро превр-ся в соли гликолевой и щавелевой к-т
![]() +
3 KOH = CH2(OH)-COOK + KOOC-COOK+H2O
+
3 KOH = CH2(OH)-COOK + KOOC-COOK+H2O
2)глиоксалевая к-та обычно прочно связ с мол-лой h2o, образуя гидрат –
+H2O = (OH)2-CH-C=O(H)
Как альдегидок-та вступ в р-ю серебр зеркала
Под д-ем сильн ок-лей ок-ся до co2
+ KMnO4+ H2SO4 = CO2+ k2so4+MnSO4+H2O
Пировиноградн к-та был авыдел при пиролизе виноградн к-ты, явл-ся 1 из промежут прод спирт брожения. Продукты- пируваты
Пировиноградн к-та к-та легко декарбоксилируется с H2SO4

Легко ок-ся под д-ем мягк ок-лей (до уксусн к-ты с выделением CO2)
Пировиногр к-та сильнее уксусной, что способсвует енолизации
Важн произв - фосфоенолпируват
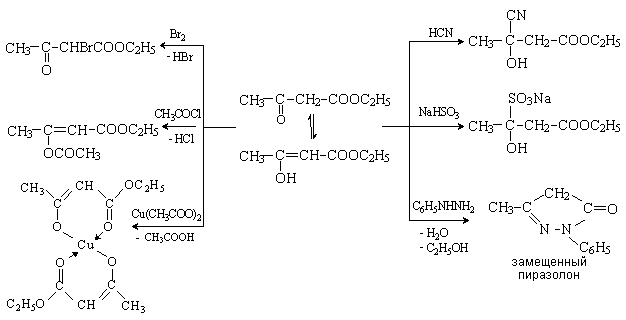 Центральное
место среди b -оксокислот и их производных
занимаетацетоукс к-та, кот дает
ацетоуксуный эфир (этиловый эфир
ацетоуксусной кислоты). Существование
в виде двух таутомерных форм обуславливает
его двойственную реакционную способность.
Как кетон, ацетоуксусный эфир присоединяет
нуклеофильные реагенты: HCN, NaHSO3,
фенилгидразин. Как енол, присоединяет
бром, замещение с актив.металлами,
ацилируется хлорангидридами кислот.
При действии на ацетоуксусный эфир
какого-либо реагента в реакцию вступает
один из таутомеров.Поскольку второй
таутомер за счет смешения равновес
восполняет убыль первого, таутомерная
смесь реа-ет в данном направ как единое
целое.
Центральное
место среди b -оксокислот и их производных
занимаетацетоукс к-та, кот дает
ацетоуксуный эфир (этиловый эфир
ацетоуксусной кислоты). Существование
в виде двух таутомерных форм обуславливает
его двойственную реакционную способность.
Как кетон, ацетоуксусный эфир присоединяет
нуклеофильные реагенты: HCN, NaHSO3,
фенилгидразин. Как енол, присоединяет
бром, замещение с актив.металлами,
ацилируется хлорангидридами кислот.
При действии на ацетоуксусный эфир
какого-либо реагента в реакцию вступает
один из таутомеров.Поскольку второй
таутомер за счет смешения равновес
восполняет убыль первого, таутомерная
смесь реа-ет в данном направ как единое
целое.
36)Общая характеристика аминокислот. Номенклатура, классификация. Природные α-а/к-ты. Хиральность а/к-т. Классификация а/к-т. получение. a-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у a-углеродного атома замещен на аминогруппу (–NН2). Различаются аминокислоты по строению и свойствам радикала R. Радикал может представлять остатки жирных кислот, ароматические кольца, гетероциклы. Благодаря этому каждая аминокислота наделена специфическими свойствами, определяющими химические, физические свойства и физиологические функции белков в организме. По ИЮПАК назв а/к-т строят от назв соотв карб к-т с доб-ем прист амино- указаением положения аминогруппы. Часто исп-ся др СП-б назв-я а/к-т . Согл нему к тривиальн назв карб к-ты доб прист амино с указанием положения амино гр. Для α а/к-т, кот игр важн роль в пр-сах жизнедеят-ти прим-ют тривиальн назв. Изомерия. 1) углер скел,2) положения амино гр 3) оптическая. Почти все прир к-ты принадл к L-ряду, а/к-ты D-ряда не вз-ют с ферментами человеч орг-ма. В молекулах всех природных аминокислот (за исключением глицина) у a-углеродного атома все четыре валентные связи заняты различными заместителями, такой атом углерода является асимметрическим, и получил название хирального атома. Вследствие этого растворы аминокислот обладают оптической активностью – вращают плоскость плоскополяризованного света. Число возможных стереоизомеров ровно 2n, где n – число асимметрических атомов углерода. У глицина n = 0, у треонина n = 2. Все остальные 17 белковых аминокислот содержат по одному асимметрическому атому углерода, они могут существовать в виде двух оптических изомеров. Существует несколько видов классификаций аминокислот входящих в состав белка.
В основу одной из классификаций положено химической природы радикалов аминокислот. Различают аминокислоты:
Алифатические – глицин, аланин, валин, лейцин
 ,
изолейцин. 2. Гидроксилсодержащие –
серин, треонин
,
изолейцин. 2. Гидроксилсодержащие –
серин, треонин .
3. Серосодержащие – цистеин, метионин
.
3. Серосодержащие – цистеин, метионин .
2. Ароматические – фенилаланин
.
2. Ароматические – фенилаланин
 ,
тирозин
,
тирозин
 ,
триптофан
,
триптофан
 .
5. С анионобразующими группами в боковых
цепях (кислотные0-аспарагиновая
.
5. С анионобразующими группами в боковых
цепях (кислотные0-аспарагиновая
 и глутаминовая кислоты на 1 ат углер
больше. 6. основные амиды-аспарагиновой
и глутаминовой кислот – аспарагин,
глутамин. 7. Основные – аргинин
и глутаминовая кислоты на 1 ат углер
больше. 6. основные амиды-аспарагиновой
и глутаминовой кислот – аспарагин,
глутамин. 7. Основные – аргинин
 ,
гистидин
,
гистидин
 ,
лизин.
,
лизин.

3 гетероциклические триптофан, гистидин, пролин
Второй вид классификации по структуре радикала:
Алиф-е 2) гидрокик-ты 3) дикарбоновые к-ты 4) двухосн-е к-ты 5) аром-е 6) серосод-е 7) гетероциклические
Кл-я
по полярности R-групп аминокислот.
Различают полярные и неполярные
аминокислоты. У неполярных в радикале
есть неполярные связи С–С, С–Н, таких
аминокислот восемь: аланин, валин,
лейцин, изолейцин, метионин, фенилаланин,
триптофан, пролин. Все остальные
аминокислоты относятся к полярным (в
R-группе есть полярные связи С–О, С–N,
–ОН, S–H). Чем больше в белке аминокислот
с полярными группами, тем выше его
реакционная способность. Номенклатура:
от соответствующих карбоновых кислот
с добавлением приставки амино и указанием
положения амино-гр. Методы получения
1Аммонолиз галогензамещенных кислот.
![]() 2)
Метод Штеккера- Зелинского
Включает стадии образования аминонитрила
при взаимодействии альдегида с HCN и
NH3 c
последующим гидролизом его в аминокислоту.
В качестве реагента применяют смесь
NaCN и NH4Cl.
+HCN=
СH3
– CH(CN)
– NH2
+ H2O
= CH3-CH(COOH)-NH2
3)восстановительное
аминирование оксок-т ch3-c(=o)-cooh
+NH3
= CH3-C(=NH)-COOH
= CH3-CH-(NH2)-COOH
4)восстановление нитрок-т (нитрок-та+H2)
5) Вз-е ненас карб к-т с NH3
6) Микробиологический. Ввиду
сложности химического синтеза и в связи
с трудностями разделения оптических
изомеров некоторые аминокислоты получают
с помощью микроорганизмов. К таким
аминокислотам относят лизин (пищевой),
триптофан, треонин
7) гидролиз белков
2)
Метод Штеккера- Зелинского
Включает стадии образования аминонитрила
при взаимодействии альдегида с HCN и
NH3 c
последующим гидролизом его в аминокислоту.
В качестве реагента применяют смесь
NaCN и NH4Cl.
+HCN=
СH3
– CH(CN)
– NH2
+ H2O
= CH3-CH(COOH)-NH2
3)восстановительное
аминирование оксок-т ch3-c(=o)-cooh
+NH3
= CH3-C(=NH)-COOH
= CH3-CH-(NH2)-COOH
4)восстановление нитрок-т (нитрок-та+H2)
5) Вз-е ненас карб к-т с NH3
6) Микробиологический. Ввиду
сложности химического синтеза и в связи
с трудностями разделения оптических
изомеров некоторые аминокислоты получают
с помощью микроорганизмов. К таким
аминокислотам относят лизин (пищевой),
триптофан, треонин
7) гидролиз белков
37)Химические
свойства α-
аминокислот.кислотно-основные св-ва.
Изоэлектрическая точка. Свойства а/к-т
по СООН и амино гр. Качественные р-и.
Кислотно-основные
свойства
Аминокислоты содержат кислотный и
основный центры и являются амфотерными
соединениями. В кристаллическом состоянии
они существуют в виде внутренних солей
(биполярных ионов – цвиттер-ионов),
которые образуются в результате
внутримолекулярного переноса протона
от более слабого основного центра (СОО-)
к более сильному основному центру (NH2).
![]()
Форма
существования аминокислот в водных
растворах зависит от рН. В кислых
растворах аминокислоты присоединяют
протон и существуют преимущественно в
виде катионов. В щелочной среде биполярный
ион отдает протон и превращается в
анион. При некотором значении рН, строго
определенном для каждой аминокислоты,
она существует преимущественно в виде
биполярного иона. Это значение рН
называют изоэлектрической
точкой(рI)
Значение pH,
При котором концентрация биполярн ионов
max,
а min
конц-и катионной и анионной форм равны
наз изоэлектрич точкой. В
изоэлектрической точке аминокислота
не имеет заряда и обладает наименьшей
растворимостью в воде. Катионная форма
аминокислоты содержит два кислотных
центра (COOH и NH3+)
и характеризуется двумя константами
диссоциации рКа1 и
рКа2.
Значение рI определяется по уравнению:
![]()
Реакции
по аминогруппе.1) вз-е с минер к-ми.
2) Дезаминирование.
Аминокислоты содержат первичную
аминогруппу и подобно первичным аминам
взаимодействуют с азотистой кислотой
с выделением азота. При этом происходит
замещение аминогруппы на гидроксильн.
RCH(NH2)COOH+HNO2=RCH(OH)COOH+N2 +H2O
Реакция используется для количественного
определения аминокислот по объему
выделившегося азота. 3)Алкилирование
и арилирование.
При взаимодействии аминокислот с
избытком алкилгалогенида происходит
исчерпывающее алкилирование аминогруппы
и образуются внутренние соли.
![]() бетаин-3алкильное произв-е.
бетаин-3алкильное произв-е.
Ацилирование. Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
![]() Реакция
используется для защиты аминогруппы в
синтезе пептидов.
Реакция
используется для защиты аминогруппы в
синтезе пептидов.
Вз-е с альдегидами. При этом образ-ся замещ имины (Осн-я Шиффа) 6) образование пептидов
Реакции
по карбоксильной группе.
Декарбоксилирование.
При сухой перегонке в присутствии
гидроксида бария аминокислоты
декарбоксилируются с образованием
аминов.
![]() Этерификация.
Аминокислоты взаимодействуют со спиртами
в присутствии газообразного HCl как
катализатора с образов. сложных эфиров.
Этерификация.
Аминокислоты взаимодействуют со спиртами
в присутствии газообразного HCl как
катализатора с образов. сложных эфиров.
![]() 3)
с ме, окс ме, меон, na2co3
3)
с ме, окс ме, меон, na2co3
Отношение
аминокислот к нагреванию.
Превращения аминокислот при нагревании
зависят от взаимного расположения
карбоксильной и аминогруппы и определяются
возможностью образования термодинамически
стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию
межмолекулярного самоацилирования.
При этом образуются циклические амиды
– дикетопиперазины.
![]()
b -Аминокислоты
при нагревании переходят a ,b -непредельные
кислоты.
![]()
гамма - и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов.
![]()
а/к-ты
у кот NH2
и COOH
гр раздел 5-ю и более ат С при нагр подв-ся
поликонденсац с образ-ем полимерн
полиамидн цепей
![]()
Качественные р-и
