
- •9) Изменение кислотно-основных свойств оксидов и гидроксидов
- •8) Гидролиз солей
- •24) Гидратация алкенов
- •33) Общая х-ка непредельных двухосн к-т. Фумаровая и малеиновая к-ты. Хим св-ва:вз-е со Спиртами, h2, галогенами, hHal. Ок-е kMnO4 в водн р-ре. Отл-е маллеин и фумаров к-т
- •Биуретовая р-я
- •Ксантопротеиновая только Na идет на oh и соон гр
- •38) Моносахариды. Классификация. Структура пентоз и гексоз, входящих в состав углеводов.
- •40)Классификация полимеров
- •46.Общая хар-ка эл-ческих методов анализа.Потенциометрия,сущность метода.Электрод сравнения и индикаторный электрод.Расчет электродных потенциалов.
- •47. Кулонометрия, теоретические основы метода. Косвенная кулонометрия. Внешняя и внутренняя генерация кулонометрическоготитранта. Определение конечной точки титрования.
- •50. Кислотно-основные равновесия в реакциях сольволиза. Расчет рН в растворах солей.
- •51.Буферные растворы. Механизм буферного действия. Расчет рН буферных растворов.
- •54.Титриметрический метод анализа.Определение,сущность метода,его достоинства.Требования ,предъявляемые к реакциям в титриметрии.Расчет результата прямого обратного и косвенного титрования.
- •55.Перманганатометрическое титрование. Приготовление и стандартизация титранта. Условия титрования,определения конечной точки титрования. Практическое применение метода.
- •56.Кислотно-основное титрование. Кривые титрования и выбор индикатора. Практическое применение методов кислотно-основного титрования.
- •57. Комплексонометрия (хелатометрия). Рабочие растворы и индикаторы метода. Практическое применение комплексонометрии.
- •58.Сущность и классификация хроматографических методов анализа. Тонкослойная хроматография.
- •61)Общий смысл второго начала термодинамики. Расчет изменения энтропии в процессах изотермического расширения и сжатия газа, изотермического изменения концентрации раствора, в фазовых переходах.
- •62)Изотермо-изохорные и изотермо-изобарные процессы в закрытых системах. Энергия Гельмгольца и свободная энергия Гиббса в закрытых системах.
- •63)Общий анализ однокомпонентных систем. Диаграмма состояния воды. Физический смысл диаграммы состояния воды.
- •64)Фазовое равновесие раствор-пар растворителя (закон Рауля) Следствие из закона Рауля. Природа эбулиоскопической и криоскопической констант. Осмотическое давление растворов.
- •Следствие из закона Рауля. 1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •65)Затвердевание бинарных жидких смесей. Диаграмма состояния системы с неограниченной растворимостью компонентов в жидком и твердом состоянии.
- •66)Расчет коэффициента активности и среднего коэффициента активности по теории Дебая-Хюккеля. Предельный случай.
- •69)Электродные потенциалы. Механизм возникновения электродных потенциалов. Зависимость электродного потенциала от активностей участников полуреакции, рН среды.
- •73)Общие понятия о гетерогенных процессах. Диффузия. Законы Фика. Скорость гетерогенных реакций.
- •78)Гетерогенные системы. Понятие фазы, комонента, степени свободы. Правило фаз Гиббса и его вывод.
- •79) Основные закономерности хт. Понятие хтп
- •80. Скорость хим.Р-и. Общая скорость хим.Пр-са.
- •81. Термодинамические расчеты химико-технологических процессов.Равновесие в системе. Расчет равновесия по термод.Данным.Термодинамический анализ.
- •82. Химическое производство как система. МоделированиеХтп. Организация хтп. Выбор схемы процесса. Управление хп.
- •83. Характеристика и классификации процессов хп
- •85. Тепловые процессы
- •86. Массообменные процессы
- •87. Принципы проектирования химических реакторов. Классификация химических реакторов. Конструкции химических реакторов.
- •88. Устройство контактных аппаратов
- •89. Общая характеристика гомогенных процессов. Гомоген.Пр-сы в газовой,жидкой фазах.
- •91. Процессы в бинарных твердых, двухфазных жидких и многофазных системах
- •92. Высокотемпературные процессы и аппараты
- •93. Каталитические процессы и аппараты. Сущность и виды катализа
1) d-Элементы II группы периодической системы. Подгруппа цинка. (Zn, Cd, Hg) Внешний ур-нь (n-1)d10ns1Степень окисления + 2, может быть +1. Высокие значения плотности, температур плавления и кипения. Высокая тепло- и электропроводность. Химическая активность небольшая, убывает с увеличением атомного номера. Все хорошие комплексообразователи. Легко образуют сплавы с другими металлами. Распространение в природе: Встречаются в виде сульфидов: ZnS (цинковая обманка), CdS (гринокит), HgS (киноварь). Ртуть встречается в самородном состоянии. Цинк - металл серебристо-белого цвета. В соединениях проявляет только одну степень окисления +2; соединения цинка неокрашены. Получают при обжиге ZnS и послед восстан углем2ZnS + 3O2 –t2ZnO + 2SO2 ZnO + C –tZn + CO
Цинк растворяется в разбавленных кислотах и щелочах: Zn+2НCl=ZnCl2+H2 Zn + H2SO4(разб)=ZnSO4 + H2 Zn+2NaOH + 2H2O=Na2[Zn(OH)4]+H2
Цинк не разлагает воду, т.к. в водном растворе он быстро покрывается защитной пленкой оксида, которая предохраняет его от коррозии. Цинк - сильный восстановитель и вытесняет менее активные мет (стоящие справа в ряду напряжений) из растворов их солей Zn + CuSO4 = ZnSO4 + Cu
Оксид цинка проявляет амфотерный характер, растворяясь как в кислотах, так и в растворах щелочей: ZnO+H2SO4=ZnSO4+H2O ZnO + 2NaOH + H2O =Na2[Zn(OH)4] Гидроксид цинка также проявляет амфотерные свойства. Ион Zn2+ является энергичным комплексообразователем с координационным числом 4. В отличие от гидроксида алюминия гидроксид цинка растворяется в водном растворе аммиака: Zn(OH)2 + 2NH3 [Zn(NH3)4](OH)2
Кадмий - белый, блестящий, ковкий металл; Получают из отходов цинкового производства CdSO4 + Zn пыль = Cd + ZnSO4 Кадмий образует только один ряд соединений, где он двухвалентен. Ион Сd 2+ - бесцветен. Оксид кадмия коричн СdО и гидроксид кадмия Сd(ОН)2 белый проявляют основной характер, растворяясь только в кислотах. CdO + 2HCl CdCl2 + H2O Cd(OH)2 + 2HCl CdCl2 + 2H2O Кадмий является хорошим комплексообразователем (координационное число 4). Гидроксид кадмия растворяется в водном растворе аммиака: Cd(OH)2 + 4NH3 [Cd(NH3)4](OH)2
Ртуть - серебристо-белый, блестящий, единственный жидкий при комнатной температуре металл; обладает низкой электропроводностью. На воздухе проявляет устойчивость. Реагирует с серой и галогенами при н.у. и с кислородом при нагревании:Hg + S HgS Hg + Br2 HgBr2 Hg + О2 2HgО Со многими металлами дает сплавы (амальгамы). Пары и соединения чрезвычайно ядовиты. Ртуть не растворяется в соляной и разбавленной серной кислотах. Ртуть легко растворяется в концентрированной азотной кислоте – образуется нитрат ртути (II): Hg + 4HNO3 Hg(NO3)2 + 2NO2 + 2H2O При растворении ртути в разб. азотной кислоте образуется нитрат ртути (I), 6Hg + 8HNO3=3Hg2(NO3)2 + 2NO + 4H2O При растворении ртути в горячей концентрированной серной кислоте в зависимости от избытка ртути или кислоты образуются соли одновалентной или двухвалентной ртути: Hg+2H2SO4=HgSO4 + SO2 + 2H2O 2Hg + 2H2SO4=Hg2SO4+SO2 + 2H2O
Ртуть растворяется в царской водке: 3Hg + 2HNO3 + 6HCl 3HgCl2 + 2NO + 4H2O
Оксид ртути (II) HgO; красный кристаллический или желтый аморфный порошок; плохо растворим в воде; раствор имеет слабо щелочную реакцию. Hg2(NO3)2=2HgO + 2NO2 2Hg+O2=2HgO (300) Сульфид ртути (II)HgS(киноварь) – ярко-красн нераст в воде порошок. Hg+S=HgS
HgO+2HCl=HgCl2(cулема)+H2O. Реактив Несслера: HgI2+2KI=K2[HgI4]
[HgI4]-+NH4+OH- = 7I- +3H2O
2) химия s и р элементов. Соединения s- и р-элементов проявляют общие закономерности в свойствах, что объясняется прежде всего сходством электронного строения их атомов. Поэтому максимальная степень окисления этих элементов в соединениях равна числу электронов во внешнем слое и соответственно равна номеру группы, в которой находится данный элемент.Другая общая особенность электронного строения s- и p -элементов состоит в том, что после отделения электронов внешнего слоя остается ион, имеющий конфигурацию атома благородного газа .Подавляющее большинство соединений s- и р-элементов (в отличие от соединений d- элементов) бесцветно, так как исключен обусловливающий окраску переход с низких энергетических уровней на более высокие по энергии. Следует отметить, что окрашенные вещества составляют лишь небольшую долю от общего числа соединений s- и р-элементов. Еще один общий характерный признак, связанный с образованием s- и некоторыми р- элементами высокостабильных «благородногазовых» ионов-значительная доля ионной связи в соединениях этих элементов. s-элементы I группы.Низкие значения первых потенциалов ионизации и высокие значения вторых потенциалов являются причиной того, что данные элементы имеют постоянную степень окисления +1. Несмотря на то, что у щелочных металлов сродство к электрону имеет положительное значение, они практически никогда не проявляют отрицательных степеней окисления. s-элементы II группы. Наиболее характерная степень окисления – +2. Первый потенциал ионизации II группы выше, чем у s-элементов первой группы, что является следствием возрастания заряда ядра. Кроме того, у атомов s- элементов второй группы более устойчивая электронная конфигурация, состоящая из заполненного двумя электронами s- подуровня и незаполненного 2р-подуровня. Именно образование заполненной двумя электронами кайносимметричной 1s-орбитали – причина того, что гелий, который по электронной конфигурации является элементом второй группы, изучается вместе с инертными газами.
p-элементы. р-Элементы (кроме А1) образуют катионы различных степеней окисления. Алюминий во всех своих устойчивых соединениях проявляет степень окисления, равную +3. Для сурьмы и висмута, например, возможные степени окисления равны +5, +3; для олова и свинца +2 и +4. В группе с возрастанием атомного номера устойчивость соединений в максимальной степени окисления р-металла уменьшается.Место водорода в периодической системе. Атом водорода состоит из одного протона и одного электрона. Этот простейший атом не имеет аналогов в периодической системе. Он способен терять электрон, превращаясь в катион Н+ и в этом отношении сходен со щелочными металлами, которые также проявляют степень окисления 1+.Атом водорода может также присоединять электрон, образуя при этом анион Н- электронная конфигурация которого такая же, как у атома гелия, В этом отношении водород сходен с галогенами, анионы которых имеют электронные конфигурации соседних благородных газов. Таким образом, водород имеет двойственную природу, проявляя как окислительную, так и восстановительную способность. Химиче свойства. при комнатной темпер водород реагирует лишь с фтором с взрывомН2+F2 = 2НF и с хлором при ультрафиолетовом облучении. Н2 + С12 = 2НС1 + 185кДж При повышенной температуре водород реагирует со многими веществами(O2,I2,S,C) например, он сгорает в атмосфере кислорода с образованием воды и выделением большого количества теплоты: 2Н2 + О2 = 2Н2О
Водород при нагрев способен реагировать не только с простыми, но и со сложными вещест: СuО + Н2 = Сu + Н2О СН2=СН2+Н2 кат.,tСН3—СН3 СО+2Н2 t СН3ОН
Во всех рассматриваемых реакциях водород является восстановителем, образуя соединения, где его степень окисления равна 1+. Со многими металлами водород вступает в реакции при повышенных температуре и давлении с образованием гидридов (NаН, КH, CаН2), где его степень окисления равна 1-: 2Nа + Н2 = 2NаH
Для промышленного получения водорода используют следующие способы:
1. Электролиз водных растворов хлоридов 2NaC1 + 2Н2О электролиз Н2 + С12 + 2NaOН
2. Пропускание паров воды (конверсия) над раскаленным углем при температуре 1000 оС: С + Н2О = СО + Н2 СО + Н2О = СО2 + Н2
3. Конверсия метана при высоких темпер в присутствии никелевого катализатора: СН4 + Н2О = СО + 4Н2
4. Крекинг углеводородов. Для лабораторного получения водорода используют следующие способы:
1. Взаимодействие металлов с кислотами, например: Zn + 2НС1=ZnС12 + Н2
2. Взаимодействие щелочных и щелочноземельных металлов с водой: Са + 2Н2О = Са(ОН)2 + Н2
3.Взаимодействие алюминия или кремния с водными растворами щелочей: 2А1+2NaОН+6Н2О=2Nа[А1(ОН)4]+3Н2 Si+2NаОН+Н2О=Nа2SiО3+2Н2
4.взаимодействие гидридов с водой NaH+H2O=NaOH+ H2
3)ОВР происходят с изменением степени окисления атомов, входящих в состав реагирующих в-в. При окислении в-в степень окисления элементов возрастает, при восстановлении - понижается.
Сте́пень окисле́ния (окислительное число, формальный заряд) — условный заряд атома в молекуле, вычесленный исходя из предположения, что молекула состоит только из ионов. “-“ знач. СО – ат.,кот.приняли электроны от других атомов“+” знач. СО – ат., кот.отдали электроны
“0” знач.СО – у простых в-в
Высшая
СО – наибольшее положительное ее
значение, равна номеру группы в
периодич.с-ме. Ок-е
– процесс отдачи e-;
Восст-е – проц.присоединения e-.
Окислители – ат.,присоединяющие e-;
Восстановители – ат.,отдающие e-.
В неорг. химии окислительно-восстановительные
реакции формально могут рассматриваться
как перемещение электронов от атома
одного реагента (восстановителя) к атому
другого (окислителя), напр.:
![]() При этом окислитель восстанавливается,
а восстановитель окисляется. При
ок-восст-х реакциях атомы в высшей
степени окисления являются только
окислителями, в низшей - только
восстановителями; атомы в промежут.
степени окисления в зависимости от типа
р-ции и условий ее протекания м.б.
окислителями или восстановителями.
Многие окислительно-восстановительные
реакции - каталитические.
По
формальным признакам
окислительно-восстановительные реакции
раздел на:
При этом окислитель восстанавливается,
а восстановитель окисляется. При
ок-восст-х реакциях атомы в высшей
степени окисления являются только
окислителями, в низшей - только
восстановителями; атомы в промежут.
степени окисления в зависимости от типа
р-ции и условий ее протекания м.б.
окислителями или восстановителями.
Многие окислительно-восстановительные
реакции - каталитические.
По
формальным признакам
окислительно-восстановительные реакции
раздел на:
межмолекулярн. (напр., 2SO2 + O2 = SO3):р-ции, протекающие с изм-ем СО ат.в разных молекулах;
внутримол. – р-ции, протекающие с изм-ем СО разных атомов в одной и той же молекуле, напр.: (NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O Последняя р-ция представляет собой самоокисление-самовосстановление (Диспропорционирование – р-ции с одновременным увеличением и уменьшением СО атомов одного и того же элемента). 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O 4) Периодический закон как основа химической систематики. Не считая попыток Лавуазье и его школы дать классификацию элементов на основе критерия аналогии в химическом поведении, первая попытка периодической классификации элементов принадлежит Дёберейнеру. Триады Дёберейнера и первые системы элементов. В 1829 г. немецкий химик И. Дёберейнер предпринял попытку систематизации элементов. Он заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы, которые он назвал триадами: Li–Na–K; Ca–Sr–Ba; S–Se–Te; P–As–Sb; Cl–Br–I. Сущность предложенного закона триад Дёберейнера состояла в том, что атомная масса среднего элемента триады была близка к полусумме (среднему арифметическому) атомных масс двух крайних элементов триады. Хотя разбить все известные элементы на триады Дёберейнеру, естественно, не удалось, закон триад явно указывал на наличие взаимосвязи между атомной массой и свойствами элементов и их соединений. Все дальнейшие попытки систематизации основывались на размещении элементов в соответствии с их атомными массами. В начале 60-х годов XIX в. появилось сразу несколько работ, которые непосредственно предшествовали Периодическому закону.
Спираль де Шанкуртуа. А. де Шанкуртуа располагал все известные в то время химические элементы в единой последовательности возрастания их атомных масс и полученный ряд наносил на поверхность цилиндра по линии, исходящей из его основания под углом 45° к плоскости основания (т.н. земная спираль). При развертывании поверхности цилиндра оказывалось, что на вертикальных линиях, параллельных оси цилиндра, находились химические элементы со сходными свойствами. Так, на одну вертикаль попадали литий, натрий, калий; бериллий, магний, кальций; кислород, сера, селен, теллур и т.д. Недостатком спирали де Шанкуртуа было то обстоятельство, что на одной линии с близкими по своей химической природе элементами оказывались при этом и элементы совсем иного химического поведения.
Попытки систематизировать химические элементы прослеживались в трудах Рихтера, который предположил, что между элементами со сходными свойствами существует определенная взаимосвязь. Он расположил щелочные и щелочноземельные металлы по увеличению их «эквивалентной массы». В 1863-1865 году аналогичные попытки были предприняты Джоном Ньюлендсом, который предложил правило октав. Ученый расположил элементы от водорода до тория в соответствии с увеличением их атомной массы и дал им номера от 1 до 56. Разделив их на восемь групп по семь элементов в каждой, Ньюлендс показал, что после каждого седьмого элемента их свойства повторяются, но в несколько измененном виде. В 1864 г. Мейер опубликовал таблицу, в которой 44 из известных тогда 63 элементов были расположены в порядке возрастания атомных масс в шести столбцах в соответствии с их высшей валентностью по водороду. Менделеевский подход к созданию периодического закона Опираясь на эти теории Д.И. Менделеев (1869) предположил, что между всеми элементами существует определенная взаимосвязь и сформулировал закон следующим образом: “Свойства простых тел, а также форма и свойства их химических соединений находятся в периодической зависимости от атомных весов элементов”. Вслед за этим он создает свою систему элементов. Периодический закон – это единственный закон, не имеющий математического выражения. Периодическая система - это графическое выражение периодического закона. Заслуги Д.И.Менделеева. 1. Он рассматривал периодичность не одного какого-либо свойства, а всех свойств - химических и физических. 2. Он ввел длинные ряды и периоды - таблица не представляет собой аккуратного прямоугольника, что предусматривает возможности дальнейшего развития. Современная формулировка периодического закона: Физические и химические свойства простых веществ, а также формы и свойства сложных соединений находятся в периодической зависимости от величины заряда ядра атома. Структура периодической системы. Существует несколько вариантов периодической системы. Наиболее распространены длиннопериодный и короткопериодный варианты. В нашей стране чаще всего встречается котороткопериодный вариант. Согласно этому варианту периодическая система включает в себя семь периодов и восемь групп. Период - горизонтальный ряд элементов расположенных в порядке возрастания заряда ядра. Или – ряд элементов с одинаковым значением главного квантового числа, т.е атомы элементов находящихся в одном периоде имеют одинаковое число энергетических уровней. Всего периодов 7. Различают большие и малые периоды. Малые периоды состоят только из одного ряда элементов. Их три: 1,2, и 3 периоды. В первом – 2 элемента, во втором и третьем по 8 элементов. Большие периоды (4,5,6) включают в себя два ряда. 4 и 5 период содержат по 18 элементов, 6-ой содержит 32 элемента. Любой период начинается щелочным металлом и заканчивается инертным газом. Группа - вертикальный ряд элементов, имеющих одинаковое число электронов на внешнем энергетическом уровне. Каждая группа включает в себя две подгруппы: главную и побочную. Нахождение в главной и побочной подгруппе определяется сходством электронной конфигурации внешнего энергетического уровня. В зависимости от порядка заполнения электронами внешнего энергетического уровня все элементы делятся на семейства: s, p, d, f. Отнесение элемента к тому или другому семейству определяется тем, какой подуровень заполняется последним. Если s, то s-семейству, если d, то к d –семейству и т.д. Главные подгруппы всегда содержат элементы только s - и p- семейств, побочные – d –семейства. Элементы f-семейства (лантаноиды и актиноиды) находятся в побочной подгруппе III-ей группы. Номер подгруппы определяется суммой s и р –электронов внешнего уровня элементов главных подгрупп и суммой s – электронов внешнего и d-электронов предвнешнего уровня для побочных подгрупп. Изменение свойств элементов в пределах системы носит периодический характер. Если рассматривается изменение свойств элементов в пределах периода – горизонтальная периодичность, если в пределах группы – вертикальная.
5) Периодичность изменения свойств атомов. Радиус – расстояние от ядра до наиболее удаленного от него максимума электронной плотности. В пределах одного периода с увеличением заряда ядра радиус уменьшается, так как увеличивается сила притяжения электронов к ядру по мере возрастания его заряда. С началом застройки нового слоя, более удаленного от ядра, то есть при переходе к следующему периоду атомные радиусы возрастают. Поэтому в главных подгруппах сверху вниз радиусы увеличиваются. В побочных подгруппах радиус сверху вниз остается неизменным, так как к обычному электростатическому сжатию добавляется d или f сжатие. В периодах радиусы ионов d-элементов одинакового заряда плавно уменьшаются, это так называемое d-сжатие, к примеру:
![]()
Аналогичное явление отмечается и для ионов f-элементов – в периодах радиусы ионов f-элементов одинакового заряда плавно уменьшаются, это так называемое f-сжатие, к примеру:
![]()
Радиусы однотипных ионов (имеющих сходную электронную “макушку”) в подгруппах плавно возрастают, к примеру:
![]()
2. Потенциал ионизации – энергия, необходимая для отрыва одного электрона от электронейтрального атома. В пределах одного периода слева направо с увеличением заряда ядра потенциал ионизации увеличивается. В главных подгруппах сверху вниз потенциал ионизации уменьшается, а в побочных незначительно растет, так как при неизменном радиусе растет заряд ядра. Величина потенциала ионизации может служить мерой «металличности» элемента: чем меньше потенциал ионизации, тем легче оторвать электрон от атома и тем сильнее будут выражены металлические свойства элементов. Отсюда – в периодах слева направо уменьшаются, в главных подгруппах сверху вниз усиливаются, а в побочных подгруппах сверху вниз ослабевают металлические свойства элементов. 3. Сродство к электрону – энергия, выделяющаяся при присоединении электрона к электронейтральному атому. В пределах одного периода слева направо сродство к электрону увеличивается. В главных подгруппах сверху вниз сродство к электрону уменьшается, а в побочных растет. 4. Электроотрицательность – относительная способность атома притягивать к себе электроны, обобществляемые при образовании химической связи. Электроотрицательность прямопропорционально зависит от заряда ядра. В пределах одного периода слева направо электроотрицательность увеличивается. В главных подгруппах сверху вниз электроотрицательность уменьшается, а в побочных растет. 5. В периоде с возрастанием заряда ядра атома металлические свойства ослабевают, т. к. увеличивается число электронов на последнем слое. В подгруппе с возрастанием заряда ядра металлические свойства усиливаются, т. к. увеличивается радиус атома и отдавать электроны становится легче.
6) Химия d-элементов происходит заполнение электронами d-подуровня. Они расположены в IВ–VIIIВ группах периодической системы элементов; у атомов d-элементов валентные электроны размещены на s-подуровне внешнего и d- подуровне предвнешнего энергетических уровней. В периодической системе элементов Д. И. Менделеева в настоящее время насчитывается 40 d-элементов: в четвертом, пятом, шестом и седьмом периодах находится по 10 d-элементов. Располагаются они между s- и р-элементами. Характерной особенностью d-элементов является то, что в их атомах заполняются орбитали не внешнего слоя (как у s- и р-элементов), а предвнешнего. На внешнем уровне атомы d-элементов имеют, как правило, по два электрона s2. Однако у девяти d-элементов (Nb, Rh, Cr, Mo, Ru, Рt, Cu, Ag и Аu) в результате «провала» одного электрона на внешнем уровне остается поодному электрону s1. В атоме палладия имеет место «двойной провал», а внешний уровень его не содержит электронов. Подобное строение электронных оболочек атомов d-элементов определяет ряд их общих свойств. Все d-элементы — металлы. Все d-элементы, за исключением Zn, Cd, Sc, Y, Ag, проявляют переменную степень окисления. Почти для всех d-элементов, в частности, возможна степень окисления +2 и +3. С химической точки зрения для d-элементов характерны три основные черты: склонность к проявлению окислительно-восстановительных свойств; кислотно-основные свойства и амфотерность; высокая способность к комплексообразованию. Максимум способности к комплексообразованию приходится на те d-элементы, которые расположены в VIIIВ группе (Fe, Co, Ni, Pt и др.). атомы характеризуются сравнительно невысокими значениями первой энергии ионизации. характер изменения энергии ионизации атомов по периоду в ряду d-элементов более плавный, чем в ряду s- и p-элементов. Наибольшее значение энергии ионизации имеет Zn (3d104s²), что находится в соответствии с полным завершением Зd-подслоя и стабилизацией электронной пары за счет проникновения под экран 3d10-конфигурации. В подгруппах d-элементов значения энергии ионизации атомов в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру. В подгруппах d-элементов радиусы атомов в общем увеличиваются. Важно отметить следующую особенность: увеличение атомных и ионных радиусов в подгруппах d-элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы атомов d-элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f-сжатием, вызванным заполнением электронами 4f-подслоя у f-элементов 6-го периода. В этом случае f-сжатие называется лантаноидным. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов и ионов для d-элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
7) Растворы электролитов. Все растворы можно разделить на две большие группы по отношению к возможности пропускания электрического тока: электролиты и неэлектролиты. Электролитическая диссоциация - пр-с распада электролита на ионы. Теор электролитич дисс. Аррениус 1835: при растворении электролита опред-я его часть диссоциирует на ионы (+ и –). Причиной диссоциации является интенсивный процесс взаимодействия растворенного вещества с молекулами растворителя, т.е. сольватация. Частный случай сольватации – гидратация. Сольвата́ция— электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольволиза объединение однородных частиц в растворе называют ассоциацией. Сольватация состоит в том, что молекула растворенного вещества оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул растворителя. В результате сольватации образуются сольваты-молекулы образования постоянного или переменного состава. Время жизни сольватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимодействия время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В зависимости от структуры растворяющегося вещества процесс диссоциации протекает по-разному. Наиболее типичны два случая: Диссоциация веществ с ионной связью Все вещества с ярко выраженной ионной связью диссоциируют полностью Na2SO4 = 2Na+ + SO42- Диссоциация веществ с ковалентно – полярной связью. H2SO4 = H+ + HSO4- ; HSO4- = H+ + SO42- Механизм электролитической диссоциации ионных веществ. При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли. Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации. Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор. Механизм электролитической диссоциации полярных веществ Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободн гидратирова ионы.
Гидратация ионов в растворе. Взаимодействие между молекулами и ионами растворяемого вещества и молекулами воды может состоять из нескольких процессов, протекающих последовательно или одновременно: молекулярной диссоциации, образования сольватов, ионизации и электролитической диссоциации. В зависимости от типа растворяющихся веществ число стадий может изменяться. Так, в случае ионных кристаллов стадии образования гидратов и электролитическая диссоциация совмещены. В случае ассоциированных веществ первой стадией является молекулярная диссоциация растворенного вещества. Процесс молекулярной диссоциации происходит вследствие химического взаимодействия между молекулами растворяемого вещества КА, (m+n) молекулами воды с образованием гидратированной молекулы КА(m+n)Н2О D КА(m+n)Н2О. (а)
Образующийся
гидрат диссоциирует на гидратированные
ионы (стадия электролитической
диссоциации): КА(m+n)Н2О
D К+·mН2О
+ А–·nН2О.
(б) Схематично процесс гидратации, на
примере реакций (а) и (б), представлен

9) Изменение кислотно-основных свойств оксидов и гидроксидов
В периоде слева направо основные свойства оксидов и гидроксидов постепенно сменяются амфотерными и затем к концу периода кис-ыми.
В каждой главной подгруппе всех групп, кроме 8-ой, сверху вниз усиливается основной харакер оксидов и гидр-ов, а кислотные св-ва ослаб
В побочных подгруппах сверху вниз усиливается кислотный характер оксидов и гидроксидов, а основные свойства их ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
8) Гидролиз солей
Гидролиз солей |
взаимодействие ионов соли с ионами воды, приводящая к изменению pH раствора. Причина гидролиза – поляризующее действие катионов и анионов на гидратную оболочку солей. Химическое равновесие процесса диссоциации воды смещается вправо: Н2О↔Н++ОН-. Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН-, и раствор соли показывает кислую или щелочную среду. |
Константа гидролиза |
Гидролиз – процесс обратимый для большинства солей: CH3COONa + Н2О ↔ CH3COOH + NaOH CH3COO-+Na++HOH ↔ CH3COONa +ОН суммарно: CH3COO- + НОН ↔ CH3COOH+ ОН- Применив закон действующих масс к данному необратимому процессу получим:
|
Степень гидролиза, h |
это отношение числа гидролизованных молекул соли к общему числу растворённых молекул
Слаб осн-е + сильн к-та или сильн осн-е и слаб к-та: h=sqrt(10-14/Kд *С соли) Слаб осн-е+ слаб к-та: h= sqrt (10-14/Kд кисл* Кд осн *С соли) Кд – слабого вещества всегда!!! Степень гидролиза зависит от: 1) природы соли: чем слабее кислота (основание), которая образуется в результате гидролиза, тем больше степень гидролиза; 2) концентрация соли: при разбавлении раствора, т.е. с уменьшением концентрации соли, степень гидролиза увеличивается; 3) температуры: при повышении температуры степень гидролиза увеличивается. |
Гидролиз по аниону |
гидролиз соли, образованной слабой кислотой и сильным основанием (Na2CO3, NaCN, CH3COOK). Анион связывает Н+ молекулы воды, образуя слабый электролит (кислоту). 1) Если соль образована слабой одноосновной кислотой, то гидролиз идёт в 1 ступень: СН3СООNa+НОН↔СН3СООН +NaОН СН3СОО-+Na++НОН↔СН3СООН+Na++ОН- CH3COO- + Н2О ↔ CH3COOH + OH- Среда щелочная, [ Н+ ] < [ ОН- ]; рН>7. |
Гидр по катиону |
это гидролиз соли, образованной слабым основанием и сильной кислотой (CuCl2, NH4Cl, FeSO4). Катион соли связывает гидроксид-ион воды, образуя слабый электролит (основание). 1) Если соль образована слабым однокислотным основанием, то гидролиз протекает в 1 ступень: NH4Cl+HOH↔NH4OH + HCl NH4++Cl+ + HOH↔NH4OH + Н+ + Cl+ NH4++HOH↔NH4OH+Н+ Среда кислая [ ОН- ] < [ Н+ ]; рН<7. |
Гидр катиону и аниону |
гидролиз соли, образованной слабой кислотой и слабым основанием. Катион слабого основания связывает ОН- и образуется слабое основание, анион слабой кислоты связывает Н+ и образуется слабая кислота. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной в зависимости от константы диссоциации слабой кислоты или слабого основания, которые образуются в результате гидролиза. СН3СООNH4+НОН ↔ СН3СООН + NH4ОН СН3СОО- + NH4+ +НОН ↔ СН3СООН + NH4ОН Среда близкая к нейтральной [Н+] ≈ [ОН-]. Гидролиз идет полностью. |
10) р-Элементы VI группы. Кислород, сера. Общая электронная формула внешнего слоя ns2np4. Максимальная валентность 6. Общая валентность 2, у S, Se, Te и Po есть 4 и 6, что возможно благодаря наличию d-подуровня. Степени окисления: общая -2; у S, Se, Te и Po -2, +4 и +6. В подгруппе сверху вниз увеличивается радиус атома и усиливаются металлические свойства. Кислород Самый распространенный элемент на Земле.(21% в возд) Способы получения:
1. Промышленные а) Перегонка (ректификация) жидкого воздуха. б) электролиз воды в присут H2SO4 и NaOH
2. Лабораторный способ (разложение некоторых кислородосодержащих веществ) 2KMnO4 –tK2MnO4+MnO2+O2 2KClO3=2KCl+ 3O2 2H2O2=2 H2O+O2
3. На космических станциях из пероксидов щелочных Ме: 2K2O2+2CO2=2K2CO3+O2
Химические свойства С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород - окислитель. 1. С неметаллами образует различные оксиды в зависимости от условий реакции C + O2 CO2 и 2C + O2 → 2CO
2. С металлами образует нормальные и смешанные оксиды, а также пероксиды и надпероксиды
2Mg + O2 = 2MgO 3Fe + 2O2 → Fe3O4 магнитный железняк (Fe2O3 • FeO) 2Na + O2 → Na2O2 K + O2 → KO2 (а также K2O2 )
3. Со сложными веществами 2H2S + 3O2 = 2SO2 + 2H2O CH4 + 2O2 = CO2 + 2H2O
4. С фтором (восстановитель) O2 + F2 −t или эл.разряд→ OF2 (а также F2O, O2F2)
Озон. Получение: 1) во вр грозы в прир, в лаб – в озонаторе 3O2 = 2O3
2. Д-е серной кислоты на пероксид бария: 3BaO2+3H2SO4 = 3BaSO4+3H2O+O3
Химич свойства: 1) неустойчив разлагается на O2 и атомарн O
2) сильный ок-ль: 2KI+O3+H2O= 2KOH+I2+O2 (качеств р-я) 8Ag+2O3= 4 Ag2O+O2 K+O3=KO3 – озонид 4KOH+4O3= 4KO3+O2+2H2O PbS+4O3= PbSO4+4O2
СЕРА В природе встречается как в свободном состоянии, так и в различных соединениях (гипс CaSO4*2H2O, пирит FeS2, свинцовый блеск PbS, цинковая обманка ZnS). В природном газе сероводород, в нефти – сульфиды. Общее содержание в земной коре 0,1%. 1)ромбическая желтые кристаллы. Наиболее устойчивая модификация 2) моноклинная - лимонно-желтые иглы. при обычных условиях превращается в ромбическую. 3) пластическая - коричневая резиноподобная (аморфная) масса образуется при выливании нагретой до кипения серы в холодную воду. Неустойчива, при затвердевании превращается в ромбическую. Получение 1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Неполное окисление сероводорода (при недостатке кислорода). 2H2S+O2=2S+2H2O
3.Вулканическая сера образуется по реакции 2H2S + SO2 = 3S + 2H2O Химические св-ва. Окислительные свойства 1) Сера реагирует со щелочными металлами без нагревания, с ост – при нагр: 2Na + S = Na2S 2) С некоторыми неметаллами сера образует бинарные соединения: H2 + S = H2S 2P + 3S=P2S3
Восстановительные свойства (в реакциях с сильными окислителями): 3) с кислородом O2+ S = SO2 4) c галогенами (кроме йода): S+Cl2=SCl2
5) c кислотами-ок-лями S+2H2SO4(конц)=3SO2+2H2O; S+6HNO3(конц)=H2SO4+ 2H2O+6NO2 6) Реакции диспропорционирования: 4S+6KOH=K2SO3+3K2S-+3H2O 7) сера растворяется в конц р-ре сульфита натрия: S+Na2SO3 = Na2S2O3 ( тиосульфат натрия)
СЕРОВОДОРОД Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде; в природе – в вулканических газах и в водах минеральных источников; образуется при гниении. Получение в промышленности как побочный продукт при очистке нефти, природного и коксового газов.
H2 + S −tH2S↑. в лаборатории в аппарате Киппа FeS + 2HCl = FeCl2 + H2S↑ Химические свойства 1) р-р сероводорода в воде – слабая двухосн к-та H2S= H++HS- HS-= H++S2- 2) Взаимодействует с основаниями: H2S + 2NaOH = Na2S + 2H2O 3) H2S проявляет очень сильные восстановительные свойства: H2S-2 + Br2 = S0 + 2HBr H2S-2 + 2FeCl3 = 2FeCl2 + S0 + 2HCl H2S+4Cl2+4H2O = H2SO4+8HCl 3 H2S + 8HNO3 = 3 H2SO4 +8 NO + 4 H2O 4) Сероводород окисляется: 2H2S-2 + O2 нед-к = 2S0 + 2H2O 2H2S-2 + 3O2 изб= 2S+4O2 + 2H2O 5)Серебро при контакте с сероводородом чернеет: 4Ag +2H2S+O2=2Ag2S+2H2O
6) Качественная реакция на сероводород и растворимые сульфиды - образование темно-коричневого (почти черного) осадка PbS: H2S+Pb(NO3)2=PbS+2HNO3. Сульфиды. Получение:1) мн-е сульфиды получ нагр Ме с S: Hg+S=HgS 2) раств сульфиды получ д-ем H2S на щелочи 3) нераств сульфиды получ по разл р-ям, н-р: CdCl2+NaS = CdS+NaCl
ZnSO4+Na2S = ZnS+Na2SO4 ОКСИДЫ СЕРЫ Оксид серы IV SO2 (сернистый ангидрид; сернистый газ) Бесцветный газ с резким удушливым запахом; хорошо растворим в воде. Обесцвечивает многие красители, убивает микроорганизмы. Оксид серы VI SO3 (серный ангидрид) Бесцветная летучая жидкость; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах). SO3 хорошо растворяется в 100%-ной серной кислоте, этот раствор называется олеумом. H2SO4 Тяжелая маслянистая жидкость нелетучая, хорошо растворима в воде – с сильным нагревом; очень гигроскопична, обладает водоотнимающими св. Производство серной к 1-я стадия. (Печь для обжига колчедана.) 4FeS2+11O2=2Fe2O3+8SO2+Q 2-я стадия. (в контактном аппарате) а) при контактном способе 2SO2 + O2= 2SO3
б) при нитрозном способе SO2+NO2+H2O→H2SO4+NO 3-я стадия. (поглотительная башня) nSO3+H2SO4(конц)=(H2SO4 • nSO3)(олеум)
1) Взаимодействие с металлами: a) разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода: Zn0 + H2+1SO4(разб) Zn+2SO4 + H2O в) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют также Fe, Al, Cr - пассивируются):
Щелоч и щелочнозем металлы MeSO4 + H2S + H2O |
Другие активные металлы MeSO4 + S + H2O |
d-металлы MeSO4 + SО2 + H2O |
2) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) C+4O2 + 2S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) 5S+4O2 + 2H3P+5O4 + 2H2O
с галогеноводородами и сероводородом 8HI + H2SO4 → 4I2 + H2S +4H2O H2S-2 + H2S+6O4(конц) S0 + S+4O2 + 2H2O
11) Принципы заполнения атомных орбиталей. Последовательность заполнения электронами различных подуровней в атоме определяется следующими принципами и правилами:
1. Принцип минимума энергии – отражает стремление любого атома находиться в состоянии с наименьшим значением всех энергий. Такое состояние называется основное или стационарное. В этом случае электроны стараются занять наиболее низкий энергетический уровень.
2. Принцип Паули. В одном атоме не может быть двух электронов с одинаковым набором значений всех четырех квантовых чисел. на одной орбитали могут находится только два электрона с противоположными по знаку значениями спина.
3. Правило Хунда. «В пределах одного подуровня электроны располагаются по орбиталям таким образом, чтобы их суммарный спин был максимальным, т. е. на подуровне должно быть максимальное число неспаренных электронов».
4. Правила Клечковского: а) «Заполнение подуровней электронами происходит в последовательности увеличения суммы соответствующих им значений главного и орбитального квантовых чисел». б) «В случае одинаковых значений этой суммы для нескольких подуровней, заполняется сначала тот подуровень, для которого главное квантовое число имеет наименьшее значение».
тип элемента (s, p, d или f) определяется тем, какой подуровень у атома заполняется последним. s-элементы расположены в главных подгруппах первой и второй групп периодической системы, у них заполняется s-подуровень. У s-элементов валентными являются s-электроны последнего энергетического уровня. p-элементы расположены в главных подгруппах третьей – восьмой групп периодической системы, у них заполняется p-подуровень. Валентными являются s- и p-электроны последнего энергетического уровня. d-элементы образуют побочные подгруппы с четвертого по седьмой периоды периодической системы. У них заполняется d- подуровень. Валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня. f- элементы «вклиниваются» в побочную подгруппу третьей группы шестого и седьмого периодов. У них происходит заполнение второго снаружи f-подуровня.
12) р-Элементы VIII группы БЛАГОРОДНЫЕ ГАЗЫ (инертные газы, редкие газы), хим. элементы VIII гр. периодич. системы: гелий (Не), неон (Ne), аргон (Аr), криптон (Кr), ксенон (Хе), радон (Rn). В природе образуются в результате разл. ядерных процессов. Космос более богат благородными газами, чем атмосфера Земли. Благородные газы содержатся также в прир. газах и нек-рых минералах. Атомы благородных газов имеют полностью заполненные внеш. электронные оболочки (s2 для Не и s2p6 для всех остальных), что обусловливает их низкую реакционную способность. Благородные газы - одноатомные газы без цвета и запаха (Они относительно трудно сжижаются, но тем легче, чем больше их атомная масса.. Благородные газы адсорбируются на активном угле и цеолитах при низких т-рах; Это св-во используется для разделения благородных газов и их очистки. Относительно хорошо раств. в воде (р-римость быстро возрастает от Не к Rn), лучше-во многих орг. р-рителях. Благородные газы (кроме Не) образуют неустойчивые соед. включения (клатраты— соединения включения. Образованы включением молекул вещества («гостя») в полости кристаллической решётки, образованной молекулами другого типа («хозяевами») (решётчатые клатраты), либо в полость одной большой молекулы-хозяина (молекулярные клатраты). с водой и орг. р-рителями. Различная способность благородных газов к образованию клатратов м.б. использована для их разделения и выделения из смесей. Способность благородных газов к образованию хим. соед. понижается от Хе к Аг наиб. число соед. получено для Хе (фториды, хлориды, оксиды, оксофториды, фосфаты, перхлораты,) В присут. катализаторов (к-т Льюиса) Хе энергично взаимод. уже при нормальных условиях с F2. Ксенон горит в атмосфере фтора ярким пламенем, при этом образуется смесь фторидов: Xe + F2 = XeF2 - Дифторид ксенона – летучие кристаллы. С резким специф запахом. Xe + 2F2 = XeF4 Тетрафторид ксенона XeF4, вполне устойчивое соединение, молекула его имеет форму квадрата с ионами фтора по углам и ксеноном в центре. Кристаллическое вещество, во влажном воздухе взрывоопасен. Гидролизуется в воде с образованием оксида ксенона ХеО3 бесцветные, расплывающиеся на воздухе кристаллы. Молекула ХеО3 имеет структуру приплюснутой треугольной пирамиды с атомом ксенона в вершине. Это соединение крайне неустойчиво; при его разложении мощность взрыва приближается к мощности взрыва тротила. Растворим, сильный окислитель:
6XeF4 + 12H2O → 2XeO3 + 4Xe + 3O2 + 24HF
XeO3+H2O= H2XeO4,
XeO4 — жёлтые кристаллы при температуре ниже −36 °C. Получают реакцией перксенатов с серной кислотой при охлаждении. Вещество это нестойко, при температуре выше 0°С разлагается на кислород и ксенон. Иногда разложение носит характер взрыва/
Ba2XeO6 + H2SO4 = BaSO4 + XeO4 + H2O
Xe + 3F2 = XeF6. Дифторид ксенона может быть получен при окислении ксенона фторидом серебра (I): 2AgF2 + 2BF3 + Xe = XeF2 + 2AgBF4. Xe + Cl2 → XeCl2
Перксенаты соли перксеноновой кислоты - H4ХеO6, кристаллич., устойчивы до 300°С, нерастворимы. Самые сильные из известных окислителей. Оксид-дифторид ксенона (XeOF2) • Оксид-тетрафторид ксенона (XeOF4) Криптон реагирует только с элементарным фтором при низких т-рах. Kr +F2 = KrF2 Различная реакционная способность благородных газов по отношению к F2 и нек-рым фторсодержащим окислителям м. б. использована для их разделения, утилизации радиоактивных изотопов и очистки. Благородные газы (кроме Не) получают как побочные продукты при произ-ве N2 и О2 из воздуха. Гелий выделяют из подземных гелионосных газов. В светотехнике признание получили ксеноновые лампы высокого давления. В таких лампах светит дуговой разряд в ксеноне, находящемся под давлением в несколько десятков атмосфер. Свет в ксеноновых лампах появляется сразу после включения, он ярок и имеет непрерывный спектр - от ультрафиолетового до ближней области инфракрасного. Ксеноновые лампы применяются во всех случаях, когда правильная цветопередача имеет решающее значение: при киносъемках и кинопроекции, при освещении сцены и телевизионных студий, в текстильной и лакокрасочной промышленности. Ксеноном пользуются и медики - при рентгеноскопических обследованиях головного мозга. Как и баритовая каша, применяющаяся при просвечивании кишечника, ксенон сильно поглощает рентгеновское излучение и помогает найти места поражения. При этом он совершенно безвреден. Используют благородные газы в кач-ве инертной среды в металлургии, атомной и ракетной технике, в произ-ве полупроводниковых материалов и др., как наполнитель в электронике, электротехнике и др., рабочее в-во в лазерной технике. При повышенных давлениях благородные газы оказывают вредное действие на нервную систему (усиливающееся с увеличением атомной массы элемента), к-рое быстро проходит при вдыхании чистого воздуха.
13) Основные положения теории Аррениуса 1835 г . При растворении электролита определенная его часть диссоциир на ионы: положит – катионы и отрицат – анионы. Эта теория объясняла накопл к тому вр многочисл работы по электролизу и электропроводности растворов. Процесс диссоциации. Причиной диссоциации является интенсивный процесс взаимодействия растворенного вещества с молекулами растворителя, т.е. сольватация. Частный случай сольватации – гидратация. Сольвата́ция— электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества и растворителя. Сольватация в водных растворах называется гидратацией. Образующиеся в результате сольватации молекулярные агрегаты называются сольватами (в случае воды гидратами). В отличие от сольволиза объединение однородных частиц в растворе называют ассоциацией. Сольватация состоит в том, что молекула растворенного вещества оказывается окруженной сольватной оболочкой, состоящей из более или менее тесно связанных с ней молекул растворителя. В результате сольватации образуются сольваты-молекулы образования постоянного или переменного состава. Время жизни сольватов определяется характером и интенсивностью межмолекулярных взаимодействий; даже в случае сильного взаимодействия время жизни отдельного сольвата мало из-за непрерывного обмена частицами в сольватной оболочке. В зависимости от структуры растворяющегося вещества процесс диссоциации протекает по-разному. Наиболее типичны два случая: Диссоциация веществ с ионной связью Все вещества с ярко выраженной ионной связью диссоциируют полностью Na2SO4 = 2Na+ + SO42- Диссоциация веществ с ковалентно – полярной связью. H2SO4 = H+ + HSO4- ; HSO4- = H+ + SO42- - 1 Соли, кислоты и основания при растворении в воде и некоторых других полярных растворителях диссоциируют на ионы. 2 Ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, и коллигативные св-ва электролитов возрастают в i раз. 3 Процесс диссоциации протекает обратимо. При уменьшении концентрации диссоциация становится практически полной
1884С помощью теории электролитической диссоциации дают определения и описывают свойства кислот, оснований и солей.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н3РО4 > Н+ + Н2РО-4(первая ступень)
Н2РО-4 > Н+ + НРO2-4 (вторая ступень)
НРО2-4 > Н+ PОЗ-4 (третья ступень)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы. KOH > K+ + OH-;
NH4OH > NH+4 + OH-
Солями называются электролиты, при диссоциации которых образуются катионы металлов а также катион аммония ( NH+4) и анионы кислотных остатков. Например: (NH4)2SO4 > 2NH+4 + SO2-4; Na3PO4 > 3Na+ + PO3-4
Так диссоциируют средние соли. Кислые же и основные соли диссоциируют ступенчато.
У кислых солей вначале отщепляются ионы металлов, а затем катионы водорода. Например:
KHSO4 > K+ + HSO-4
HSO-4 > H++SO2-4
У основных солей вначале отщепляются кислотные остатки, а затем гидроксид-ионы.
Mg(OH)Cl > Mg(OH)++Cl- Mg(OH)+ > Mg2++OH-
Теории кислот и оснований. Кислота – это вещество, для которого характерны следующие свойства:
В чистом виде это неэлектролиты, однако, становятся электролитами, если их растворить в воде.
Изменяют окраску индикаторов 3. Реагируют с оксидами металлов с образованием соли и воды 4.Реагируют с металлами с образованием водорода 5.Реагируют с карбонатами с образование диоксида углерода.
Основание – это вещество которое нейтрализует кислоту. Не все основания растворимы в воде. Растворимые называются щелочами. В 1884 Аррениус предположил что кислота, это вещество, которое образует протон водорода, а основание – гидроксид-анион. Хотя теория Аррениуса актуальна до сих пор, ей присущи некоторые ограничения. В 1923 году Брендстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории кислота- вещество, которое является донором протонов, а основание – вещество акцептор протонов. Такие определения кислот и оснований позволяют включать в число кислот и оснований не только молекулы, но и ионы: Согласно протонной теории кислоты подразделяют на три типа: Нейтральные кислоты: НСI, H2SO4, H3PO4 и т.д. HCI = H+ + Cl- Катионные кислоты: NH4+, H3O+ NH4+ = NH3 + H+ Анионные кислоты, представленные анионами многоосновных кислот: HSO4- HSO4- = H+ + SO42-
Такая
же классификация имеется для оснований
Нейтральные основания: аммиак, вода,
этиловый спирт. Анионные основания:
отрицательные ионы кислотных остатков.
Катионные основания – катион гидрозония
NH2
– NH2+
Существуют вещества, которые могут
проявлять как кислотные, так и основные
свойства - амфолиты. Например, вода или
раствор аммиака. Процесс диссоциации
электролита происходит в контакте с
растворителем. При этом растворитель
выполняет функцию либо кислоты, либо
основания. Согласно протонной теории
кислота отдавая протон превращается в
основание, сопряженное с данной кислотой,
и наоборот, принимая протон основание
превращается в сопряженную кислоту.
 Соответственно
каждой кислоте обязательно соответствует
сопряженное основание. В
1938 году Льюис создает
теорию, в которой кислота и основание
имеют еще более широкий смысл. По Льюису
кислота – это вещество, имеющее вакантную
атомную орбиталь, т.е. обладает способностью
образовывать ковалентные химические
связи, акцептируя электронную пару.
Основание – донор неподеленной
электронной пары. Например – ВF3
– кислота, NH3
– основание.
Металлы – кислоты Льюиса. Ионы неметаллов
– основания Льюиса.
Соответственно
каждой кислоте обязательно соответствует
сопряженное основание. В
1938 году Льюис создает
теорию, в которой кислота и основание
имеют еще более широкий смысл. По Льюису
кислота – это вещество, имеющее вакантную
атомную орбиталь, т.е. обладает способностью
образовывать ковалентные химические
связи, акцептируя электронную пару.
Основание – донор неподеленной
электронной пары. Например – ВF3
– кислота, NH3
– основание.
Металлы – кислоты Льюиса. Ионы неметаллов
– основания Льюиса.
14) Электролиз – совокупность окислительно-восстановительных процессов, протекающих при прохождении электрического тока(направленного потока е-в от в-ля к ок-лю) через систему, состоящую из электродов и раствора или расплава электролита. В отличии от гальванического элемента, который вырабатывает электрический ток за счет окислительно-восстановительных реакций, для электролиза необходим электрический ток который подается из вне.Электролиз протекает на электродах, на которые подается постоянный электрический ток. Положительный электрод ( на нем происх пр-сы ок-я – анод, отрицательный – катод. Катод имеет большее значение ок-восст потенциала.Итак, катодные процессы при электролизе. На катоде могут протекать три вида процессов:
Восстановление ионов металла: Меn+ + ne → Me
2 Восстановление молекул воды в нейтральных или щелочных растворах:
2Н2о + 2е → н2 + 2он– ен2о/н2 = –0,828 в.
3 Восстановление ионов водорода в кислотных растворах:
2Н+ + 2е → н2, ен+/н2 = 0,000 в.Уравнение 2 и 3 относятся к водородному или угольному электродам (то есть в случае кислой среды водород может быть получен по 3-ему уравнению реакции, а в случае нейтральной и кислой среды — по 2-ому уравнению реакции)Так как на катоде идет реакция восстановления, т.е прием электронов окислителем, то в первую очередь должны реагировать наиболее сильные окислители. На катоде прежде всего протекает реакция с наиболее положительным потенциалом.
На аноде также могут протекать три вида процессов:
1 Окисление атомов металла: Ме – ne → Men+
2 Окисление молекул воды в кислотных и нейтральных растворах:
2Н2о – 4е → о2 + 4н+ ео2/н20 = +1,229 в.
3 Окисление гидроксид-ионов в щелочных растворах:
4ОН– – 4е → О2 + 2Н2О, ЕН+/Н2 = +0,04 В.
Так
как на аноде идет реакция окисления,
т.е отдача электронов восстановителем, то
в первую очередь должны реагировать
наиболее сильные восстановители. На
аноде прежде всего протекает реакция
с наиболее
отрицательным потенциалом.Различают
электролиз расплава и раствора
электролита. В расплаве
электролита,
процесс распада на ионы протекает под
действием высоких температур.
Например,
электролиз расплава хлорида натрия: 2
NaCl
= 2 Na
+ Cl2К

 атод
Na+
+1e
Na
Анод 2Сl-
- 2e
Cl2.
При электролизе
водных растворов процесс распада
электролита осуществляется при помощи
диссоциации. Наряду с ионами самого
электролита в водных растворах всегда
присутствуют ионы Н+
и ОН-
, которые в свою очередь могут принимать
участие в процессе электролиза. Какие
именно процессы будут протекать на
электродах, в первую очередь зависит
от значения
стандартного электродного потенциала.
Если стандартный электродный потенциал
больше, чем –0,41 В, тогда на катоде будет
протекать процесс восстановления
металла, (такие
металлы располагаются от олова и дальше)
если меньше, то процесс восстановления
водорода, (от
лития до цинка)
если приблизительно =, то наряду с
металлом будет восстанавливаться и
водород (цинк, хром, никель, железо,
кадмий). Выделение водорода из кислых
растворов происходит в результате
разрядки протонов водорода 2Н+
+ 2е Н2
В случае нейтральных растворов –
за счет восстановления молекул воды:
2Н2О
+ 2е Н2
+ 2 ОН -Т
атод
Na+
+1e
Na
Анод 2Сl-
- 2e
Cl2.
При электролизе
водных растворов процесс распада
электролита осуществляется при помощи
диссоциации. Наряду с ионами самого
электролита в водных растворах всегда
присутствуют ионы Н+
и ОН-
, которые в свою очередь могут принимать
участие в процессе электролиза. Какие
именно процессы будут протекать на
электродах, в первую очередь зависит
от значения
стандартного электродного потенциала.
Если стандартный электродный потенциал
больше, чем –0,41 В, тогда на катоде будет
протекать процесс восстановления
металла, (такие
металлы располагаются от олова и дальше)
если меньше, то процесс восстановления
водорода, (от
лития до цинка)
если приблизительно =, то наряду с
металлом будет восстанавливаться и
водород (цинк, хром, никель, железо,
кадмий). Выделение водорода из кислых
растворов происходит в результате
разрядки протонов водорода 2Н+
+ 2е Н2
В случае нейтральных растворов –
за счет восстановления молекул воды:
2Н2О
+ 2е Н2
+ 2 ОН -Т аким
образом, характер катодного процесса
определяется как значением стандартного
электродного потенциала металла, так
и значением рН раствора. При рассмотрении
анодных процессов следует иметь в виду,
что материал анода может быть изготовлен
из вещества, способного окисляться.
Поэтому выделяют два типа анодных
процессов: с инертными электродами и
активными электродами. Анодный
процесс с пассивными электродами. В
анодном пространстве концентрируются
отрицательно заряженные ионы, это как
правило анионы кислотных остатков и
гидроксид анионы, которые образуются
при диссоциации воды. Стандартный
электродный потенциал окисления воды
= 1,229 В. Если электродный потенциал аниона
меньше чем 1,229 В, то окисляться будет
именно он, если больше, то вода:В
нейтральной и кислой среде: 2Н2О
– 4е О2
+ 4Н+
В щелочной: 4ОН-
- 4е= О2
+ 2Н2О
Анодный
процесс с активными электродами. Если
материал анода изготовлен из металла,
стандартный электродный потенциал
которого меньше чем 1,229 В, то окисляться
будет сам анод.
Например,
электролиз раствора сульфата меди с
медным анодом.
аким
образом, характер катодного процесса
определяется как значением стандартного
электродного потенциала металла, так
и значением рН раствора. При рассмотрении
анодных процессов следует иметь в виду,
что материал анода может быть изготовлен
из вещества, способного окисляться.
Поэтому выделяют два типа анодных
процессов: с инертными электродами и
активными электродами. Анодный
процесс с пассивными электродами. В
анодном пространстве концентрируются
отрицательно заряженные ионы, это как
правило анионы кислотных остатков и
гидроксид анионы, которые образуются
при диссоциации воды. Стандартный
электродный потенциал окисления воды
= 1,229 В. Если электродный потенциал аниона
меньше чем 1,229 В, то окисляться будет
именно он, если больше, то вода:В
нейтральной и кислой среде: 2Н2О
– 4е О2
+ 4Н+
В щелочной: 4ОН-
- 4е= О2
+ 2Н2О
Анодный
процесс с активными электродами. Если
материал анода изготовлен из металла,
стандартный электродный потенциал
которого меньше чем 1,229 В, то окисляться
будет сам анод.
Например,
электролиз раствора сульфата меди с
медным анодом.
E 0Cu2+/Cu = 0,34 В, что <чем 1,229 В Анод Cu - 2e Сu2+ Катод Сu2+ + 2е Сu
16)
Сильные и слабые электролиты. Аррениус
объяснил что лишь часть электролита в
растворе распадется на ионы. Т.Е. в
системе наступает состояние динамического
равновесия, где наряду с ионами
присутствуют недиссоциированные
молекулы. Параметр, который характеризует
распад электролита на ионы называется
степенью диссоциации, который показывает
отношение числа молекул электролита
распавшегося на ионы, к общему числу
молекул электролита находящегося в
растворе.
 Между значением изотонического
коэффициента и степенью диссоциации
существует определенная взаимосвязь.
i=1+альфа(k-1) или альфа=(i-1)(k-1)
Степень
диссоциации зависит от природы электролита
и растворителя, концентрации раствора,
температуры, присутствия одноименного
иона и других факторов.
Позже было установлено, что все электролиты
по степени диссоциации можно разделить
на две группы: сильные и слабые. Сильные
электролиты диссоциируют практически
полностью и степень их диссоциации
приближается к 100%, т.е. понятие степени
диссоциации к ним практически не
применимо. В растворах слабых электролитов
устанавливается динамическое равновесие
между ионами и недиссоциированными
молекулами СН3СООН=СН3СОО-
+ Н+
Между значением изотонического
коэффициента и степенью диссоциации
существует определенная взаимосвязь.
i=1+альфа(k-1) или альфа=(i-1)(k-1)
Степень
диссоциации зависит от природы электролита
и растворителя, концентрации раствора,
температуры, присутствия одноименного
иона и других факторов.
Позже было установлено, что все электролиты
по степени диссоциации можно разделить
на две группы: сильные и слабые. Сильные
электролиты диссоциируют практически
полностью и степень их диссоциации
приближается к 100%, т.е. понятие степени
диссоциации к ним практически не
применимо. В растворах слабых электролитов
устанавливается динамическое равновесие
между ионами и недиссоциированными
молекулами СН3СООН=СН3СОО-
+ Н+
 Константа
равновесия, характеризующая диссоциацию
слабого электролита, называется
константой диссоциации. Данный параметр
зависит от природы электролита,
растворителя, температуры, но не зависит
от концентрации.
Она характеризует способность данного
электролита распадаться на ионы. Чем
больше величина константы диссоциации,
тем сильнее электролит распадается на
ионы. Многоосновные кислоты, а также
основание двух или более валентных
металлов диссоциируют ступенчато. И
для каждой ступени можно записать
константу равновесия.
Константа
равновесия, характеризующая диссоциацию
слабого электролита, называется
константой диссоциации. Данный параметр
зависит от природы электролита,
растворителя, температуры, но не зависит
от концентрации.
Она характеризует способность данного
электролита распадаться на ионы. Чем
больше величина константы диссоциации,
тем сильнее электролит распадается на
ионы. Многоосновные кислоты, а также
основание двух или более валентных
металлов диссоциируют ступенчато. И
для каждой ступени можно записать
константу равновесия.
H2CO3 = H+ + HCO3- Kд = [H+] * [HCO3-] / [H2CO3] = Кд1 НСО3 = Н+ + СО32- Kд = [H+] * [CO3-2] / [HCO3 -] = Кд2
Суммарная константа равновесия равна Кд1* Кд2 Доказано, что Кд1 >> Кд2. Это объясняется тем, что энергия, которую необходимо затратить на отрыв иона минимальна в случае. нейтральной молекулы и становится больше при диссоциации по каждой следующей ступени.
Между
степенью и константой диссоциации
существует определенная взаимосвязь,
которая выражается в законе разбавления
Освальда (1888), который приложил закон
действующих масс к процессу диссоциации.
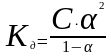 Для слабых электролитов, когда α <<
1, выражение закона Освальда упрощается
К = Сα2
.
Выделяют теоретическую или расчетную
концентрацию и реальную или эффективную,
которая называется активностью. Между
ними существует определенная взаимосвязь
А
= f*C
В
разбавленных растворах сильных
электролитов природа ионов незначительно
влияет на значение коэффициентов
активности, поскольку межионное
взаимодействие в первую очередь
определяется зарядом ионов и их
концентрацией. При этом количественной
характеристикой межионных взаимодействий
служит величина ионной силы раствора,
которая определяется как полу сумма
произведения концентраций ионов на
квадрат их заряда.
Для слабых электролитов, когда α <<
1, выражение закона Освальда упрощается
К = Сα2
.
Выделяют теоретическую или расчетную
концентрацию и реальную или эффективную,
которая называется активностью. Между
ними существует определенная взаимосвязь
А
= f*C
В
разбавленных растворах сильных
электролитов природа ионов незначительно
влияет на значение коэффициентов
активности, поскольку межионное
взаимодействие в первую очередь
определяется зарядом ионов и их
концентрацией. При этом количественной
характеристикой межионных взаимодействий
служит величина ионной силы раствора,
которая определяется как полу сумма
произведения концентраций ионов на
квадрат их заряда.
 Для
разбавленных растворов сильных
электролитов где
Для
разбавленных растворов сильных
электролитов где
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствора.Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом:
![]() ,
,
Диссоциация
воды. Водородный показатель. Чистая
вода очень плохо проводит электрический
ток, но однако, обладает избирательной
электропроводностью, которая объясняется
малой диссоциацией воды на ионы. Н2О
= Н+
+ ОН-
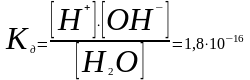 Константа
диссоциации воды при 298 К определена
методом электрической проводимости
равна 1,8*10-16
моль/л. Константа диссоциации зависит
от температуры. При повышении температуры
константа диссоциации возрастает, так
как процесс диссоциации эндотермический
= +56,5 кДж/моль.
Константа
диссоциации воды при 298 К определена
методом электрической проводимости
равна 1,8*10-16
моль/л. Константа диссоциации зависит
от температуры. При повышении температуры
константа диссоциации возрастает, так
как процесс диссоциации эндотермический
= +56,5 кДж/моль.
Степень
диссоциации воды очень мала, поэтому
активности протонов водорода и
гидроксид-анионов можно считать равными
их концентрации. Поскольку вода в
растворах присутствует в значительно
больших количествах, то ее концентрацию
можно считать величиной постоянной. На
1 литр это 1000/18 = 55,6 моль/л. Подставляя
это значение в выражение константы
диссоциации получаем [H+][OH-]
= 10-14
при 298 К. Данное выражение получило
название ионного произведения воды. В
чистой воде [H+]
= [OH-]
= 10-7
Растворы, для которых сохраняется это
выражение, называются нейтральными.
Растворы, у которых [H+]
> 10-7
называются кислыми, у которых < 10-7
– щелочными. Зная концентрацию протонов
водорода всегда можно определить
концентрацию гидроксид-анионов и
наоборот. Мерой кислотности среды
принято считать водородный показатель
(рН), который равен рН = - lg[H+]
Ионное произведение воды в логарифмируемом
виде выглядит следующим образом рН +
рОН = 14 Расчет
рН для сильных и слабых кислот и
оснований..
Кислоты: сильные
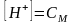 слабые
слабые
 Основания: сильные
Основания: сильные
 слабые
слабые

15) р-Элементы IV группы. Углерод, кремний. Общая характеристика Включает C, Si, Ge, Sn, Pb. Внешний слой ns2np2. Проявляют степени окисления от -4 до +4. C и Si типичные неметаллы, Ge - проявляет металлические и неметаллические свойства, Sn и Pb типичные металлы.
УГЛЕРОД Один из распространенных элементов, встречается как в свободном, так и в связанном виде. Свободный - в виде алмаза и графита. Соединения углерода: карбонаты кальция (мел, мрамор, известняк) и магния (магнезит - MgCO3), малахит [(CuOH)2CO3]нефть, каменный и бурый уголь, сланцы, природный газ. Около 0,03% воздуха составляет СО2. Входит в состав живых организмов. Алмаз Кристаллическое вещество, прозрачное, очень твёрдое, не проводит электрический ток, плохо проводит тепло. Атомы углерода находятся в sp3- гибридизации и образуют атомную кристаллическую решётку с прочными ковалентными σ- связями. Если без доступа алмаз сильно нагреть, то он превращается в графит. Применение Шлифовальный порошок, буры, стеклорезы, после огранки - бриллианты. Графит Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток. В кристаллической решётке атомы углерода находятся в sp2- гибридном состоянии и образуют слои из шестичленных колец; между слоями действуют межмолекулярные силы. Разновидностью графита являются: каменный и древесный уголь, кокс, сажа. Применение Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав смазочных материалов. Карбин Чёрный мелкокристаллический порошок, полупроводник. Различают α-карбин (–C≡C–C≡C– ) и β-карбин (=С=С=С=С=). При нагревании переходит в графит. Фуллерены Молекулярный углерод, модификация углерода, состоящая из полых шарообразных частиц по 60 атомов углерода в каждой. С60 – фуллерит. Это твердое вещество черного цвета, полупроводник. Окисляется с образованием СО и СО2 . Химические свойства. Углерод - малоактивен, на холоде реагирует только со фтором С+F2 = CF4 - Восстановительные свойства ; химическая активность проявляется при высоких температурах. Восстановительные свойства 1) с кислородом C0 + O2 –t→ CO2 углекислый газ
при недостатке кислорода наблюдается неполное сгорание: 2C0 + O2 –t→ 2C+2O угарный газ
2) с водяным паром (конверсия) C0 + H2O –1200→ С+2O + H2 водяной газ СО + Н2О → СО2 + Н2
3) с оксидами металлов C0 + 2CuO –t→ 2Cu + C+4O2
4) с кислотами – окислителями: C0 + 2H2SO4(конц.) → СO2 + 2SO2 + 2H2O С0 + 4HNO3(конц.) → СO2 + 4NO2 + 2H2O 5) c N2 gjl djpl-tv ‘k hfphzlf 2C+ N2 = C2N2 (N≡C-C≡N) дициан
Окислительные свойства 6) с некоторыми металлами образует карбиды 4Al + 3C0 → Al4C3 7) с водородом C0 + 2H2 → CH4
9) с бором образуются очень твердые карбиды используемые в качестве абразивов С + 4В –t→ В4С 10) с si образ карборунд Si+C=SiC
Оксид углерода (II) CO Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит.
Получение 1) В промышленности (в газогенераторах): C + O2 –t→ CO2 CO2 + C –t→ 2CO
2)В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.): HCOOH –t→ H2O + CO H2C2O4 = CO+CO2+H2O
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид. 1) с кислородом 2C+2O + O2 –t→ 2C+4O2
2) с оксидами металлов C+2O + CuO –t→ Сu + C+4O2 3) c Cl2 насвету CO+Cl2 = COCl2 фосген 4) при нагрев с серой CO+S = COS сульфоксид углерода 5) при нагрев под давл-ем вз-ет с H2: CO+2H2 = CH3OH 6) процесс конверсии СО + Н2О → СО2 + Н2
7) реагирует с расплавами щелочей (под давлением) CO + NaOH –t→ HCOONa (муравьинокислый натрий - формиат натрия) 8 ) C перех Ме образ карбонилы CO+Ni = Ni(CO)4
Оксид углерода (IV), бесцветный, без запаха, малорастворим в воде, тяжелее воздуха; твёрдый CO2 называется "сухой лёд"; не поддерживает горение.
Получение 1. Промышленный способ. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка: CaCO3 –t→ CaO + CO2 и СH4+O2 = CO2+H2O
2. Лабораторный способ. Действием сильных кислот на карбонаты и гидрокарбонаты в аппарате Киппа: CaCO3+2HCl –t→ CaCl2+H2O+CO2
Химические свойства
Качеств р-я на СО2: вз-е с Сa(OH)2
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 –t→ Na2CO3 2NaOH + CO2 –t→ Na2CO3 + H2O NaOH + CO2 –t→ NaHCO3
При повышенной температуре может проявлять окислительные свойства
С+4O2 + 2Mg –t→ 2Mg+2O + C0 6СО2 + 6Н2О –hν→ С6Н12О6 + 6О2 процесс фотосинтеза
Ок-ль: СО2+Са = СаС2+СаО
Угольная кислота и её соли H2CO3 Кислота слабая, существует только в водном растворе: CO2 + H2O ↔ H2CO3
Cредние соли - карбонаты (СO32-). Кислые соли - бикарбонаты, гидрокарбонаты (HCO3-).
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –t→ Na2CO3 + H2O + CO2 Na2CO3 + H2O + CO2 –t→ 2NaHCO3
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида: CuCO3 –t→ CuO + CO2
Качественная реакция - "вскипание" при действии сильной кислоты: К2CO3 + 2HCl → 2КCl + H2O + CO2
КРЕМНИЙ Второй по распространённости элемент в земной коре (27,6% по массе). Встречается только в виде соединений. Образует два типа минералов. Первый тип состоит из SiO2 – это полудрагоценные камни (агат, аметист, яшма), горный хрусталь, кварц, кремнезём. Второй тип – силикаты (каолинит Al2O3•2SiO2•2H2O, полевые шпаты NaAlS3O8, слюда K2O•3Al2O3•6SiO2). Степени окисления: +4, -4.
Аллотропия Алмазоподобная модификация – тёмно-серое кристаллическое вещество с металлическим блеском, большая твёрдость, хрупкое, полупроводник. Инертен. Графитоподобная модификация - бурый порошок, гигроскопичен, более реакционноспособен.
Получение 1) технический кремний 2С + Si+4O2 –t→ Si0 + 2CO
2 Mg+SiO2 = MgO+si
2) чистый кремний SiCl4 + 2Zn –t→ Si + 2ZnCl2 SiH4 –t→ Si + 2H2
Химические свойства Типичный неметалл, инертен.
Восстановительные свойства:
1) С кислородом Si0 + O2 –t→ Si+4O2
3) С углеродом Si0 + C –t→ Si+4C
5) С кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот: 3Si + 4HNO3 + 18HF → 3H2[SiF6] + 4NO + 8H2O
6) Со щелочами (при нагревании): Si0 + 2NaOH + H2O –t→ Na2SiO3+ 2H2
Окислительные свойства:
7) С металлами (образуются силициды): Si0 + 2Mg –t→ Mg2Si-4
Силан SiH4 Бесцветный газ, ядовит Получение Mg2Si + 4HCl → 2MgCl2 + SiH4
Химические свойства 1) SiH4 + 2O2 → SiO2 + 2H2O 2) SiH4 –t→ Si + 2H2
Оксид кремния (IV) (SiO2)nСуществует в виде нескольких модификаций: аморфная и кристаллическая. В природе это кварц, кристобалит и тридимит, отличающиеся структурой кристаллической решетки. Твёрдое, тугоплавкое вещество, нерастворимое в воде, химически стойкое. При температуре 1600°С легко плавится, переходя в стеклообразное состояние. Это типичный кислотный оксид. При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
1) С основными оксидами: SiO2 + CaO → CaSiO3 2) Со щелочами: SiO2 + 2NaOH → Na2SiO3 + H2O
4) С солями: SiO2 + CaCO3 → CaSiO3 + CO2 5) С плавиковой кислотой: SiO2 + 4HF → SiF4 + 2H2O
6) сплавлением песка, известняка и соды получают стекло 6SiO2 + CaCO3 + Na2СO3 → Na2O • CaO • 6 SiO2 + 2CO2
Кремниевая к-та (метакремниевая). Общ ф-ла xSiO3*yH2O Na2SiO3+2HCl = H2SiO3 + 2NaCl При нагревании разлагается до оксида кремния IV
17) Основные виды химической связи: Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, металлическая. Все эти виды связи относятся к внутримолекулярному взаимодействию, т.е. в пределах одной молекулы.
Ковалентная связь – двуцентровая двуэлектронная связь, 2 ядра, 2e.
Ковалентная неполярная – связь, образованная между атомами химических элементов, не отличающихся друг от друга значительно по электроотрицательности. При образовании этой связи зона повышенной электронной плотности в равной степени принадлежит всем взаимодействующим атомам. Разрыв данной связи, как правило, сопровождается образованием радикалов. СН3-СН3 СН3 + СН3
При разрыве образуется 2 метильных радикала. Такой разрыв связи называется гомолитическим. Ковалентная полярная – связь, образованная между элементами, отличающимися друг от друга по электроотрицательности. В этом случае в пределах молекулы происходит частичное перераспределение зарядов. Существует 3 основных механизма образования ковалентной связи: ОБМЕННЫЙ В основе данного механизма лежит предположение о том, что химсвязь образуется при перекрывании атомных орбиталей внешнего энергетического уровня каждого из взаимодействующих атомов. При перекрывании образуется зона повышенной электронной плотности, находящейся между ядрами. Суммарный отрицательный заряд в этой области значительно больше, чем в каждом атоме отдельно. Именно скопление отрицательного заряда между ядрами взаимодействующих атомов удерживает их друг относительно друга. Т.е. в данной с-ме возник силы эл-стат притяж-я м/ду ядром и зоной повыш е-й плотн-ти – зона связывания. Чем больше зона ат орбитали, тем прочнее связь, но ат орбитали, тем прочнее связь, но бесконечного перекрывания не будет, т.к. это приведет к увеличению сил отталкивания между ядрами и атомы разойдутся. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ Если один из атомов имеет неподеленную е-ю пару (донор), а второй – свободную АО (акцептор), по принципу Паули и праволо Гунда собл-ся и образ-ся связь.
Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать одновременно в роли и донора, и акцептора неподеленных пар электронов. Взаимодействие двух атомов, при котором каждый из них выступает в роли донора и акцептора электронных пар одновременно, называется дативным механизмом образования связи. Классическим примером проявления дативного механизма является взаимодействие атомов хлора в молекуле Cl2.
![]()
Насыщенность ковалентной связи обусловлена тем, что одна атомная орбиталь может принимать участие в образовании только одной ковалентной связи.
Геометрическая направленность ковалентных связей соответствует направлениям наибольшего перекрывания атомных орбиталей.
Кратность ковалентной связи проявляется в том, что два атома могут связываться между собой более чем одной ковалентной связью.
Прочность ковалентной связи в основном определяется степенью перекрывания электронных орбиталей взаимодействующих атомов.
ИОННАЯ СВЯЗЬ - предельный случай ковалентной полярной связи. При образовании ионной связи происходит практически полное перераспределение е плотности в пределах образованной молекулы. Ион. связь также как и ковал. характеризуется Е связи, но в отличии от ковал. связи, не обладает насыщенностью и направленностью.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ – связь сужду атом-ионами Ме, осущ-мая электронатомами, свободно перемещ-ся по всему объему Мет реш. Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Межмолек-е вз-я, возник-е между целыми мол-ми (силы ВДВ)
18)Электронный характер химической связи. Химическая связь – явление взаимодействия атомов, обусловленное перекрыванием электронных облаков связывающихся частиц, которое сопровождается уменьшением полной энергии системы по сравнению с энергией изолированных атомов. Хим связь – это связь м/ду фт любой хим с-мы (прост или сложн в-во), приводящее к образованию устойч мол-лы. Парам связи: 1. Энергия химической связи является мерой ее прочности. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи: ковалентную, ионную и металлическую. Кроме того, между атомами соседних молекул могут возникать взаимодействия, такие как водородная связь и вандерваальсовые силы. Энергия связи — это энергия, выделяющаяся при образовании одного моля связей данного типа или энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества (количество связей равное числу Авогадро). Чаще всего энергию связи измеряют в кДж/моль. Наиболее прочными являются ионные и ковалентные связи, энергии этих связей составляют величины от десятков до сотен кДж/моль. Металлическая связь, как правило, несколько слабее ионных и ковалентных связей, но величины энергий связи в металлах близки к значениям энергии ионных и ковалентных связей. 2. Длина связи – расстояние между ядрами взаимодействующих атомов. 3. Валентный угол или угол связи – угол между линиями двумя напр-ми связей, исходящ из одного и того же атома. Очевидно, что понятие валентного угла применимо только к молекулам (ионам, радикалам), содержащим три и более атомов в молекуле (ионе, радикале).
4) направленность связи подразумевает строго определенную ориентацию мол-лы в трехмерном пр-ве. Зависит от формы и ориентации е-х облаков взаимодействующих ат. Из понятия «направленность» определяют типы связей. I) cигма-связь, (одинарная связь) область перекрывания электр облаков находятся на прямой,соед-щей ядра ат. s-s, s-p и s-d связь. II) Пи-связь (двойная связь) область перекрыв-я орбиталей нах-ся по обе стороны от прямой,соед-щей ядра p-dю. III) дельта-связь образуют только d-орбитали 5) Насыщенность связи – кол-во возможных атомных орбиталей, кот участвуют в образовании хим связи.
Ковалентная связь характеризуется направленностью и насыщаемостью. Ионная и металлическая связи не имеют определенной направленности. Насыщаемость ковалентной связи обусловлена ограниченными валентными возможностями атомов, т.е. их способностью к образованию строго определенного числа связей, которое обычно лежит в пределах от 1 до 6. Общее число валентных орбиталей в атоме, т.е. тех, которые могут быть использованы для образования химических связей, определяет максимально возможную валентность элемента. Число уже использованных для этого орбиталей определяет валентность элемента в данном соединении. Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной.
19) Электролиз. Законы Фарадея. Электролизом называют процессы, протекающие на электродах под действием электрического тока, подаваемого от внешнего источника тока через электролиты. При электролизе на электродах непрерывно протекают окислительно-восстановительные реакции. На катоде (К(-)) происходит процесс восстановления, на аноде (А(+)) – процесс окисления. Продукты этих реакций или откладываются на электродах, или вступают во вторичные реакции (взаимодействуют между собой, с молекулами растворителя или с веществом электрода), или накапливаются в растворе у электродов. Течение первичных анодных и катодных реакций подчиняется законам Фарадея.
Первый закон Фарадея: масса вещества m, выделяемая на электроде электрическим током, пропорциональная количеству электричества Q, прошедшему через электролит: m = kQ, но Q =It где I – сила тока, А; t – время пропускание тока, с. m = kIt 1
k – коэффициент пропорциональности, равный количеству вещества, выделяемого при прохождении одного кулона (Кл) электричества (электрохимический эквивалент).
Мерой электричества явл-ся 1 Фарадей = 96500 Кулонов/моль.
Второй закон Фарадея: если через электролизеры проходят одинаковые количества электричества, то массы веществ, выделившихся на электродах, относятся между собой как их эквивалентные массы,
при эл-зе разл хим соед равное кол-во эл-ва выделяется на электродах эквивалентные кол-ва в-в):
![]() для
выделения 1 грамма эквивалента вещества
требуется пропустить через электролит
одно и тоже количество электричества,
равное приблизительно 96500 Кл (число
Фарадея). Следовательно:
для
выделения 1 грамма эквивалента вещества
требуется пропустить через электролит
одно и тоже количество электричества,
равное приблизительно 96500 Кл (число
Фарадея). Следовательно:
![]() Подставив
последнее уравнение в 1 получим формулу,
объединяющую оба закона Фарадея.
Подставив
последнее уравнение в 1 получим формулу,
объединяющую оба закона Фарадея.
![]() Соотношение
используют в расчетах процессов при
электролизе. При практическом проведении
электролиза всегда некоторая часть
электрической энергии затрачивается
на побочные процессы. Важной характеристикой
рентабельности установки для проведения
электролиза (электролизера) является
выход по току (h, %):
Соотношение
используют в расчетах процессов при
электролизе. При практическом проведении
электролиза всегда некоторая часть
электрической энергии затрачивается
на побочные процессы. Важной характеристикой
рентабельности установки для проведения
электролиза (электролизера) является
выход по току (h, %):
h
= ![]() где
mпр –
масса фактически выделенного вещества;
mтеор –
масса вещества, которая должна была
выделиться в соответствии с законом
Фарадея. На процесс электролиза
существенно влияет плотность тока, то
есть сила тока, приходящаяся на единицу
рабочей поверхности электрода.
где
mпр –
масса фактически выделенного вещества;
mтеор –
масса вещества, которая должна была
выделиться в соответствии с законом
Фарадея. На процесс электролиза
существенно влияет плотность тока, то
есть сила тока, приходящаяся на единицу
рабочей поверхности электрода.
20)Предмет органической химии. Органи́ческая хи́мия — раздел химии, изучающий соединения углерода, их структуру, свойства, методы синтеза. Органическими называют соединения углерода с другими элементами. Наибольшее количество соединений углерод образует с так называемыми элементами-органогенами: H, N, O, S, P. Углерод выделяется среди всех элементов тем, что его атомы могут связываться друг с другом образуя длинные цепи или циклы. Это св-во позв углероду образ-ть миллионы соед. Важн знач-е в орг химии имеет период конца 19- нач 20 вв. Этот период отмечен рождением научн теор химич строения орг соед, основоположенник этой теор – русск химик – Александр Мих-ч Бутлеров. Основные положения теории химического строения орг соедА.М.Бутлерова можно свести к следующему. 1. В молекулах атомы соединены др с др в опред порядке в соотв с их валентностью. Этот порядок называется химич строением. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. 2. Физич и химич свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от его химического строения. Химическое строение – это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга – как соседних, так и через другие атомы. В результате каждое вещество имеет свои особые физические и химические свойства.. 3.Ат или группы ат, образующие молекулу влияют др на др, от чего зависит реакционная способн молекулы или в-ва. Теор строения орг соед Бултерова позв объяснить сущ-е соед с одинак брутт-формулой, но с разл св-вами. Изомеры – вещества, имеющие один и тот же состав, но разное строение, а, следовательно, и разные свойства. Изомерия бывает 2х видов I. Структурная изомерия, обусловленная различным взаимным расположением атомов в молекулах. При этом возможны следующие виды структурной изомерии: 1. Изометрия углеродного скелета. Обусловлена различным порядком соединения атомов углерода в цепи. 2. Изометрия положения кратных связей и функциональных групп. 3. Межклассовая изомерия. Этот тип изомерии характерен для соединений, содержащих в цепи помимо углеродных атомов другие атомы, например O, N. II. Пространственная изомерия (стереоизомерия). Этот тип изомерии обусловлен различным пространственным расположением атомов при одинаковом порядке их связывания. Возможны следующие виды пространственной изомерии: 1. Конформационная изомерия. атомы и группы атомов, связанные друг с другом σ-связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга. Для изображения конформационных изомеров удобно пользоваться формулами – проекциями Ньюмена. (заслоненная, заторможенная) конфигурационная изомерия бывает 2 типов: 2. Геометрическая изометрия (цис-, транс- изомерия). Характерна для непредельных органических соединений, содержащих двойную связь. 3. Оптическая изометрия Следует обратить внимание на существование органических соединений, имеющих одинаковый состав, одинаковое строение и свойства, но по-разному относящихся к плоскополяризованному свету. Так, при пропускании через такие соединения луча поляризованного света происходит отклонение плоскости поляризации на определенный угол. Соединения, которые вращают плоскость поляризации, называют оптически активными. Изомер, вращающий плоскость поляризации света против часовой стрелки, называют левовращающим [L(–)-форма], а по часовой стрелке – правовращающим [D(+)-форма]. Такие изомеры называются оптическими, или зеркальными изомерами (оптическими антиподами, энантиомерами). Оптическая изомерия обусловлена наличием асимметрического атома углерода С*, связанного с четырьмя различными заместителями. Так, например, оптические изомеры молочной кислоты отличаются друг от друга как предмет от своего зеркального изображения. Формулы фишера - соон-сн(он)сн3. Молекулы, которые нельзя совместить в пространстве и которые относятся друг к другу как предмет к своему зеркальному изображению, называют хиральными, а явление существования таких веществ называется хиральностью. Смесь равных количеств L- и D-форм называется рацематической смесью. Рацематическая смесь оптически неактивна. Гомологи́ческий ряд — ряд химических соединений одного структурного типа (например, алканы или алифатические спирты — спирты жирного ряда), отличающихся друг от друга по составу на определенное число повторяющихся структурных единиц — так называемую гомологическую разность. Гомология – явление, когда вещества имеют сходные строения и свойства, но отличаются между собой на одну или несколько групп СН2. Гомология – принадлежность веществ к 1 классу. Гомо́логи — вещества, входящие в один и тот же гомологический ряд. алканы (общая формула СnH2n+2): метан CH4, этан C2H6, пропан С3H8 и т. д.; гомологич. разностью этого ряда является СН2 группа. Общепринят кл-я орг соед по углер скел: 1 алиф-е (ациклические) 2 карбоциклические 3 гетероциклич. Все они мб насыщ и ненас.


21) Алканы. . Предельные насыщенные парафины. Общ формула – СnH2n+2. В соответствии с этой формулой они образуют гомологический ряд, в котором гомологи отличаются на гомологическую разность – группу СН2 (метан, этан, пропан, бутан, пентан, гексан, гептан, октан, нонан, декан, ундекан, додекан и т.д.) В молекулах алканов ат. С соед между собой только простой сигма-связью. Атомы С нах в sp – 3 гибридизации. Валентный угол между орбиталями – 109,28. соединения этого класса рассматриваются, как родоначальники орг соед. При удалении одного атома Н из алкана образуется радикал, назв которого строится от названия алкана с заменой окончания на –ил (метил,этил) в молекуле алкана атомы С м/б первичными, вторичными, третичными ит.тд.(в зависимости от того со сколькими группами соединен помимо Н). Изомерия. Для алканов характерна структурная изомерия, а именно изомерия углеводородного скелета, она появляется у бутана. С увеличением кол-ва ат С в цепи кол-во изомеров растет. Линейна лк часто наз нормальными (перед ними став букву н) для обозн-я разветвл цепей исп приставки изо- мезо- трет-. Для алканов также характерна конформационная изомерия – возник за сч вращения групп ат вокр прост сигма-св.. Основными и наиболее важными источниками различных предельных углеводородов являются нефть и природный газ. Способы получения.
промышленные – 1.фракционная перегонка нефти ( в России газообр алканы из прир газа) ; 2. гидрогенизация угля – процесс превр орг молекулы угля при т=400-500°С под давлением в жидкие и газообразные продукты С+2Н2→t, pt, kt СН4
каталитическое гидрирование оксидов углерода(2) – синтез Фишера nСО+2nH2=CnH2n=CnH2n+2
лабораторные 1. гидрирование алкенов и алкинов СН2=СН2+Н2→PdСН3-СН3 kt – Pt,Pd,Ni
2.
реакция Вюрца – действие моногалоген
алканов на натрий.
![]()
3.сплавение
солей карбоновых кислот со щелочами –
реакция Дюма![]()
электролиз растворов солей карбоновых кислот – синтез Кольбе
 NaOH
в межкатодн пр-ве, водород - на катоде
NaOH
в межкатодн пр-ве, водород - на катодевостановление галогеналканов C2Н5Cl+H2=C2H6+HCl
Восст-лями мб – LiAlH4, NaBH4 – борогидрид натрия, H2
kt - Pt,Pd,Ni
Алкил-иодиды мб восст-ны нагреванием с HI
C2H5I+ HI= t C2H6+I2
6 получение метана Al3C4+12H2O= 2 CH4+ 4 Al(OH)3
23) Химические с-ва алканов. Алканы относят к наиб инертным в хим отн в-вам. Их часто наз парафинами, т.е. лишенными сродства. Для алканов не характерны реакции по ионн мех-му. Химическая устойчивость алканов объясняется высокой прочностью связей С-С и С-Н, а также их неполярностью. Е разр связи С-С = 350 кДж/моль, С-Н –связей – 415 кДж/моль. Поэтому С-С и С-Н в алканах способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции, в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов, реакции окисления, изомеризац и расщепл-я. Следовательно, алканы вступают в реакции, протекающие по механизму радикального замещения, SR . Галогенирование. При взаимодействии алканов с галогенами (хлором и бромом) под действием УФ-излучения или высокой температуры образуется смесь продуктов
|
Сl2 |
|
Сl2 |
|
Сl2 |
|
Сl2 |
|
|
|
СН4 |
→ |
СН3Сl |
→ |
СН2Сl2 |
→ |
СНСl3 |
→ |
ССl4 |
|
(*) |
|
-HCl |
|
-HCl |
|
-НСl |
|
-HCl |
|
|
|
Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями: I) инициирование цепи: Cl2=hn2Сl* II) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода: Cl*+ СН4→НСl + СН3* При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора: СН3* + Сl2→СН3Сl + Сl* Эти реакции повторяются до тех пор, пока не произойдет III) обрыв цепи по одной из реакций: Cl*+ Cl* → Сl2, СН3* + СН3* → С2Н6, СН3* + Cl* → СН3Сl. Реакционн способн Hal уь-ся от фтора к брому, I2 с алканами не реагир! Галогенир-е алканов, сод-щих неэквивал ат водор прив к обрз-ю смеси изомерных продуктов замещения. легче всего замещаются атомы водорода у третичных, затем у вторичных и первичных атомов углерода (правило региоселективности). Нитрование алканов (реакция Коновалова) осуществляется в жидкой фазе при температурах 140-150оС под давлением .(Свободные радикалы образующиеся в результате термического гомолиза азотной кислоты. Реакция протек по радик мех-му, не имеет цепного х-ра. СH3-CH2-CH3 = CH3- CH(NO2)-CH3 Мех-м: I) Инициирование цепи: HO:NO2=HO*+NO2* (гомолитич разр – гомолиз) II) Рост цепи 1) СH3-CH2-CH3+ HO* = СH3-C*H-CH3 + H2O; 2) СH3-C*H-CH3+ NO2* = CH3- CH(NO2)-CH3 III)Обрыв цепи 1)HO*+ HO*= H2O2 2) NO2*+ NO2*= N2O4 3) HO*+ NO2*=HNO3 4) СH3-C*H-CH3+ СH3-C*H-CH3 = СH3-C(СH3-C*H-CH3)H-CH3 5) СH3-C*H-CH3+HO* = СH3-CH(OH)-CH3
24) Алкены. (олефины) – ненасыщенные ациклические углеводороды с одной двойной связью, общая формула гомологического ряда CnH2n.
Углеводороды с общей формулой CnH2n, в молекулах которых между атомами углерода имеется одна двойная связь, называют углеводородами ряда этилена. Члены гомологического ряда отличаются на CH2 разность. Так как в гибридизации участвуют s - электрон и два p - электрона, то такой ее вид называется sp2 - гибридизацией. Валентный угол: 120 градусов. Изомерия:Названия углеводородов ряда этилена образуют путем изменения суффикса соответствующего предельного углеводорода на -ен или –илен и указывая положение 2-й связи. Главн цепь выбирается т.о., чтобы она обязат вкл в себя 2-ю связь. Нумерация ат начинают от С ближн к 2-ой связи. Для простейш предст прим-ся исторически сложившиеся назв – этилен, пропилен и.т.д. В номенкл разл классов орг соед исп-ют одновал-е радикалы алкенов – CH2=CH- винил, CH2=CH-CH2- алил. Изомерия 1) углер скелета, 2 полож-я 2-ой связи, 3 межкласс с циклоалканами 4 пространств (цис, транс) Методы получения алкенов 1. Дегидрирование алканов
![]() 2.
крекинг
алканов, входящих в состав нефти. При
более высоких температурах происходит
также разрыв связей С-С и получаются
смеси различных алканов и алкенов, у
которых молекулярная масса меньше, чем
у исходных алканов (крекинг)
2.
крекинг
алканов, входящих в состав нефти. При
более высоких температурах происходит
также разрыв связей С-С и получаются
смеси различных алканов и алкенов, у
которых молекулярная масса меньше, чем
у исходных алканов (крекинг)
.

2. Лабораторн способы
1. Вз-е Hal-алканов со спирт р-ром щелочи C2Н5Cl +KOHСП = C2H4+KCl +H2O Реакция прох по прав Зайцева: водород отщепляется от наименее гидрогенезированного атома углерода.
б)
термическое дегидрогалогенирование в
паровой фазе.
![]() 4.
4.
2. Дегидратация спиртов
.
![]()
В
качестве катализаторов используются
Бренстедовские или Льюисовские кислоты,
например H3PO4 и
Al2O3.
Особенностью этих реакций является
порядок отщепления воды, определяемый
правилом Зайцева: при отщеплении воды
наиболее легко отщепляется водород от
соседнего наименее гидрированного
атома углерода.
![]()
3. Восст-е алкинов CH≡CH+H2 =t,Ni CH2=CH2. Взаимодействие с 4-мя и более ат углер может прох стереоселективно с пол-ем отдельно цис или транс – алкена
4.. Взаимод. дигалогеналканов с Zn или Mg.

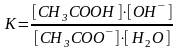 [Н2О]
– растворе соли постоянна, поэтому
величину [Н2О]
модно объединить с К:
[Н2О]
– растворе соли постоянна, поэтому
величину [Н2О]
модно объединить с К: ,
где Кг
–
константа гидролиза, количественная
характеристика процесса, зависит от
природы соли, t; чем больше значение
Кг,
тем
в большей степени протекает гидролиз
,
где Кг
–
константа гидролиза, количественная
характеристика процесса, зависит от
природы соли, t; чем больше значение
Кг,
тем
в большей степени протекает гидролиз где
n
– число молекул соли, подвергшихся
гидролизу
N
– общее число растворённых молекул
соли
где
n
– число молекул соли, подвергшихся
гидролизу
N
– общее число растворённых молекул
соли