
3.1.1. Первинна та вторинна будова білків
Амінокислотна послідовність у поліпептидному ланцюзі становить первинну структуру білка. Важливим етапом дослідження структури білків є встановлення послідовності у них амінокислотних залишків (аналіз виконується автоматично секвінаторами). Первинна структура білка – це одновимірне зображення білкової молекули (рис. 3.1). Знання первинної структури дає змогу передбачити вторинну та третинну струк-тури білка. Одночасне використання амінокислотної послідовності і кристалографічних карт електронної густини дає змогу відобразити просторову локалізацію всіх атомів у білку.
-
поліпептидному ланцюзі пептидна група є плоскою і жорсткою. Тоді поліпептидний ланцюг являє собою послідовність пептидних груп (однотипних площин), які з’єднані між собою поодинокими зв’язками
105
N–Ca і С–Са. Обертання навколо цих зв’язків не повністю довільне через стеричні обмеження. Конформації білкових молекул стабілізуються слабкими взаємодіями пептидних (вторинна структура) і бокових груп амінокислотних залишків (третинна структура). Вторинна структура білка – це швидке локальне впорядкування поліпептичнoгo ланцюга внаслідок утворення водневих зв’язків між пептидними групами (рис. 3.2, а). Енергетично і стерично вигідною вторинною структурою в білках є права α-спіраль. Лише теоретично можлива π-спіраль, яку екс-периментальними методами у білках не було виявлено. Вторинними структурами в білках є паралельні та антипаралельні або β-структури.

Рис. 3.1. Первинна структура білка
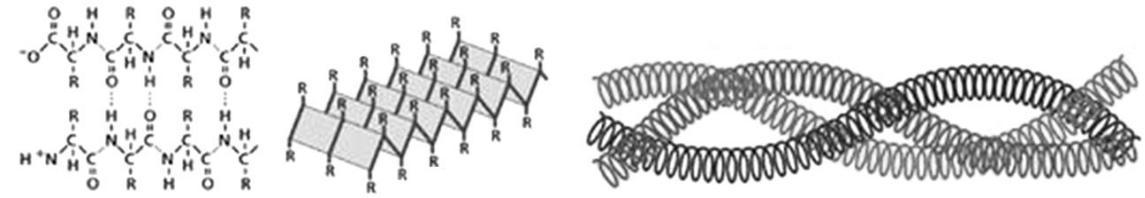
а б
Рис. 3.2. Вторинна (а) та надвторинна (б) структури білка
106
Надвторинна структура. Наступним рівнем організації білкових молекул є надвторинні структури (рис. 3.2, б). Прикладом таких струк-тур є суперспіральні структури, в яких дві α-спіралі (у тропоміозині, легкому мероміозині, параміозині) чи три α-спіралі (у фібриногені) скручені одна з одною.
За амінокислотною послідовністю в поліпептидному ланцюзі тео-ретично передбачено вторинну структуру білка, існування якої ґрунту-ється на припущенні, що конформації поліпептидних ланцюгів визна-чаються локальними, ближніми взаємодіями.
Оптичні методи дисперсії оптичного обертання (ДОО) та колового дихроїзму (КД) широко використовують для дослідження вторинної структури білків. Їх основу становить фізичне явище – взаємодія ліній-но поляризованого світла з оптично активними молекулами. Амінокис-лоти мають асиметричні атоми вуглецю, які зумовлюють появу оптич-ної активності. Спектри ДОО і КД реєструються в ділянці поглинання пептидних груп (ультрафіолетова ділянка спектра 180…230 нм).
Дисперсія оптичного обертання. Розглянемо взаємодію оптично активної речовини з лінійно поляризованим світлом. Кут обертання пропорційний різниці nL – nR і товщині шару d (товщина кювети) оптич-но активної речовини:
![]()
|
|
|
|
180 |
n |
n |
|
d. |
|
|
|
|
R |
|
|||||
|
|
|
|
L |
|
|
|
||
|
|
|
|
|
|
|
|
|
![]()
Питоме обертання розчину з концентрацією речовини С (г∙см–3) і товщиною d (дм) становить:
|
|
|
|
|
|
|
. |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
dC |
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
Молярне обертання |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
M |
|
|
|
M |
|
|
|
|
, |
|
|||||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
100dC |
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||||
![]()
де М – молекулярна маса речовини, моль.
107
Кут обертання залежить від довжини хвилі світла, яке поглинається оптично активною речовиною. Залежність [α]λ або [M]λ від λ називаєть-ся дисперсією оптичного обертання. Спектральні прилади, які з висо-кою точністю реєструють ДОО, називають спектрополяриметрами.
-
максимумі λ0 смуги поглинання речовини ДОО стає аномальним, набуваючи нульового значення (ефект Коттона). За ділянкою смуги поглинання ДОО плавно змінюється залежно від λ, що відповідає рів-
нянню Друде:
Рис. 3.3. Ефект Коттона в смузі поглинання:
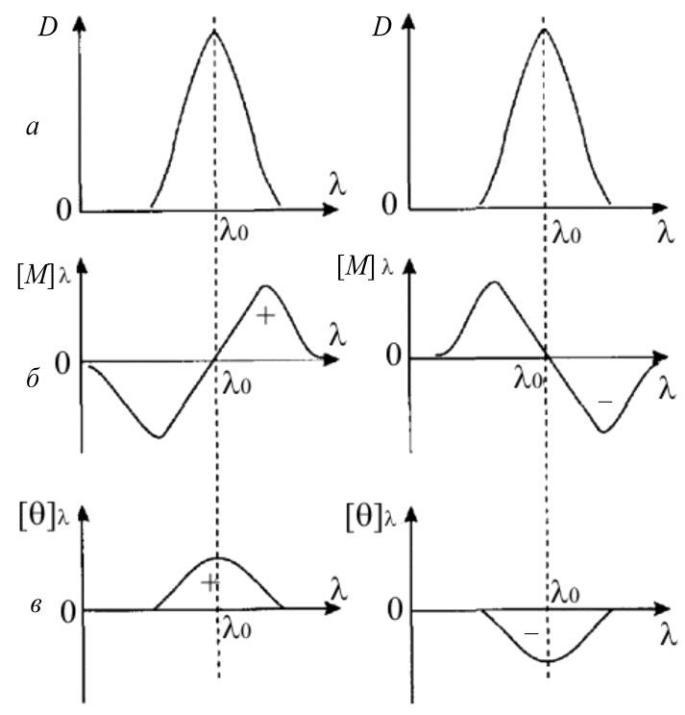
-
– смуга поглинання з оптичною густиною D;
-
– ДОО; в – КД; «+» – додатний коттон-ефект; «–» – від’ємний коттон-ефект
|
M |
|
|
|
K |
, |
|
|
|
2 |
2 |
|
|||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
![]()
де К – стала Коттона.
Залежно від форми ДОО можливі два ефекти Коттона. Якщо λ > λ0 і величина [М]λ має додатне значення, тоді ма-ємо додатний коттон-ефект, якщо від’ємне – від’ємний коттон-ефект (рис. 3.3).
Коловий дихроїзм. Оп-тично активна речовина по-різному поглинає L- та R-компоненти світла і тому має різні коефіцієнти молярної екстинції εL та εR. Як результат
різних оптичних густин D для L- та R-компонент лінійно поляризоване світло після проходження розчину з оптично активною речовиною пе-ретворюється в еліптично поляризоване світло. Вимірюють еліптичність речовини так:
-
2,303180DL
4
![]()
-
DR 33DL
DR
,
де DL та DR – оптична густина для L- та R-компонент відповідно.
108
Молярна еліптичність
|
|
|
100 |
|
|
|
|
|
. |
|
|
|
|
3300 |
L |
|
R |
|
|||
|
|
|
dC |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
![]()
Залежність [θ]λ від λ називають спектром колового дихроїзму. При-лад, на якому реєструють спектри КД, називають дихрографом.
За допомогою методів ДОО і КД доведено, що білки надто розріз-няються за кількістю упорядкованих структур. Фібрилярні білки – висо-ковпорядковані, глобулярні білки – менш упорядковані.
Змінення температури, кислотності, додавання до розчину денату-рованих речовин, таких як сечовина, хлорид гуанідину, спричиняє пере-хід поліпептидного ланцюга від упорядкованої конформації до неупо-рядкованої структури.
