
- •Дәріс сабақтардың тезистері
- •1 Тақырып. Термодинамикаға тарихи шолу. Классикалық статистика. Лиувиль теоремасы.
- •2 Тақырып. Термодинамикадағы энергияның рөлі.
- •4 Тақырып. Энтропия. Макроскопиялық қозғалыс.
- •5 Тақырып. Қысым, жұмыс және жылу мөлшері. Жылу функциясы. Еркін энергия.
- •6 Тақырып. Термодинамикалық потенциал (Гельмгольцтың энергиясы).
- •7 Тақырып. Термодинамикалық потенциалдың
- •8 Тақырып. Гиббстің функциясы. Гиббстің үлестіруі. Максвеллдің үлестіруі.
- •9 Тақырып. Идеал газдар. Тепе-теңсіздік күйдегі Больцманның идеал газдары.
- •Тақырып. Кванттық статистикадағы үлестірулер. Ферми-Дирак үлестіруі. Бозе-Эйнштейн үлестіруі.
- •12. Тақырып. Элементар бөлшектердің Ферми және Бозе газдары.
- •13 Тақырып. Сиретілген электронды газ. Қара сәулелену.
- •14 Тақырып. Конденсацияланған деңелер.
- •Энтропия.
- •2) Келесі теңдеуді табу үшін энтальпия: бұдан, ,
4 Тақырып. Энтропия. Макроскопиялық қозғалыс.
Тепе теңдікті сипаттау үшін Ньютон қозғалысы, не қозғалыс интегралы деген ұғым еңгізіп, физикаға 7 сақталу занын әкелдік. Сол сияқты тепе-теңдік жағдайды термодинамикада сипаттау үшін Гибсс қосымша күй өзгерісі деген ұғым еңгізді.
1)
қозғалыс интегралы (Ньютон)
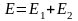 (1)
(1)
2) күй өзгерісінің сипаттау үшін энтропия S деген ұғым еңгізеді, ол тұрақты, аддитивті.
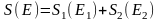 (2)
(2)
Энтропияның энергияға байланыстығын көрсету үшін мына өрнекті жазайық:
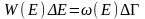 (3)
(3)
(3)
– тендеудің ерекшелігі
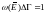 ,
норма, Е – орташа шама.
,
норма, Е – орташа шама.
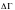 -статистикалық
салмақ арқылы ықтималдылықты энтропия
мен байланыстырды:
-статистикалық
салмақ арқылы ықтималдылықты энтропия
мен байланыстырды:
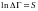 ,
,
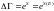
- статистикалық салмақ деу себебіміз, бұл көлем энергияға байланысты, энегрияның алатын орнын көрсететін шама және да аддитивті шама.
Энтропияның анықтамасы:
1. Гиббстың анықтамасы: Тұрақты көлемде термодинамикалық жүйені жылытқанда, сол жылудың бір мөлшері сол термодинамикалық жүйені құрып тұрган молекулардың ішкі құрылымына ауысуы. Бұны ішкі жұту дейді. Осы жұту процесін энтропия дейді.
Гиббс мынадай ұғымдар енгізді: термодинамикалық потенциал; химиялық потенциал.
Термодинамикалық потенциалдар – көлемнің, қысымның, энергияның, энтропияның, температураның өзгеруіне байланысты күй өзгерісі.
Химиялық потенциал – химиялық реакция жүрген кезде күйдің өзгеруі.
Термодинамикалық потенциал термодинамикалық процес жүргендегі, химиялық реакция жүргендегі өзгерісті Гиббс ансамблі деп атайды.
2. Больцман принципі (анықтамасы).
Термодинамикалық жүйенің бір күйде болуының ықтималдылығының өлшемі - энтропия.
3. Жалпы анықтама. Қыздыру кезінде, не болмаса бір күйден екінші күйге ауысқан кезде, ауысуға кететін жылу мөлшерінің сол моменттегі температураға қатынасын энтропия дейді:
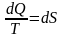
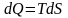
бұл белгілі тұрақты көлемде жүретін процесс.
Енді бұл шаманың энергиямен, температурамен байланысын қарастырайық..
(1),
(2) теңдеудегі
 термодинамикалық тепе-теңдік күйде
(2) – теңдеу 2 күйден тұрады дейік, оны
термодинамикалық тепе-теңдік күйде
(2) – теңдеу 2 күйден тұрады дейік, оны
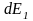 бойынша дифференциалдайық :
бойынша дифференциалдайық :
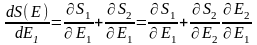
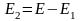
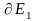 бойынша
дифференциалдайық :
бойынша
дифференциалдайық :
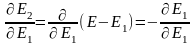
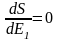 ,
,
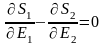
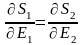 (5)
(5)
(5)
– теңдеу термодинамикалық жүйе тұйық
тепе-теңдік күйде болған уақытта әрбір
бөлшектердің энтропияның өзгерісінің
энергиясының өзгерісіне қатынасы
бірдей болады. Егере де  (6) белгілесек, онда
(6) белгілесек, онда
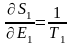
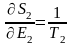 (7)
(7)
Т – абсолюттік температура. Себебі энтропия - өлшемсіз шама. Т-Дж-мен Эрг-пен өлшенеді. k=1,38 10-16 Эрг/град. ТЭ=kТ
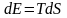 (8)
(8)
егерде
энтропия уақытқа байланысты өзгеретін
болса, онда тепе-теңдік күйде болмайды.
Тепе- тендік сол уақытта болады, егер
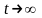 уақытында. Энтропия уақыт шексіздікке
ұмтылғанда өзгерісі, ол шама уақыт
өткен сайын өсе береді.
уақытында. Энтропия уақыт шексіздікке
ұмтылғанда өзгерісі, ол шама уақыт
өткен сайын өсе береді.
Энтропиряның уақытқа байланысты өзгерісін қарастыратын болсақ, :
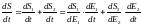 (9)
(9)
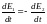 (10)
(10)
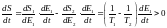 (11)
(11)
егер
T1=T2
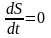 (12)
(12)
бұл (12) теңдеу тепе-теңдіктің шарты.
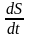 -өзгерісі
оң шама болғандықтан, температура әр
түрлі нүктеде әр түрлі болғандықтан,
энтропия өзгерісі оң шама болу үшін,
жылу температурасы жоғары денеден
төмен денеге өтуі керек. Энтропияның
қасиеті жылудың ыстық денеден суық
денеге өтуі. Сондықтан энтропия өседі.
Кері де болуы мүмкін, егер де
термодинамикалық жүйеде химиялық
реакция жүрсе. Термодинамикалық дене
әр уақытта тепетеңдікке ұмтылады.
-өзгерісі
оң шама болғандықтан, температура әр
түрлі нүктеде әр түрлі болғандықтан,
энтропия өзгерісі оң шама болу үшін,
жылу температурасы жоғары денеден
төмен денеге өтуі керек. Энтропияның
қасиеті жылудың ыстық денеден суық
денеге өтуі. Сондықтан энтропия өседі.
Кері де болуы мүмкін, егер де
термодинамикалық жүйеде химиялық
реакция жүрсе. Термодинамикалық дене
әр уақытта тепетеңдікке ұмтылады.
Макроскопиялық қозғалыс.
dE=TdS (1)
Сол сияқты импульс пен импульс моментіде аддитивті шама:
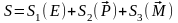
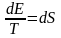
Бұл теңдеу бойынша энтропияның өзгерісі энергияның өзгерісіне байланысты. Сол сияқты, импульс пен импульс моментінің өзгерісіне де байланысыты.
Сондықтан энтропия 3 түрлі өзгерісте болады:
1.энергия,
2. импульс,
3. импульс моменті.
Энтропия ішкі энергияға байланысты, яғни ішкі энергиның өзгеруіне байланысты.
Ал
ішкі энергия Eіш=Eтол
-
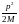 ,
ал
,
ал
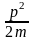 - кинетикалық энергия.
- кинетикалық энергия.
Болшектерге:
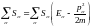 ,
бұнда
m-масса,
,
бұнда
m-масса,
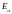 -энергия,
-энергия,
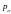 -болшектердін
импульсі,
-болшектердін
импульсі,
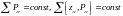 импульс моменті.
импульс моменті.
Онда
энтропияның толық жүиесі:
 .
.
Максимум шарты:
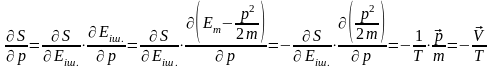
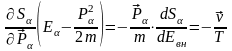 ;
;

Онда
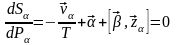
осыдан
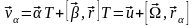
(3)
u
- ілгерлемелі қозғалыстың жылдамдығы,
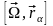 -
айналмалы қозғалыстың жылдамдығы.
-
айналмалы қозғалыстың жылдамдығы.
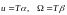 -
макроскопиялық термодинамиканың
денелердің жылдамдықтарының теңдеулері
дейді.
-
макроскопиялық термодинамиканың
денелердің жылдамдықтарының теңдеулері
дейді.
Себебі: Еіш=Етол-Ек
Максималдық жағдайда немесе тепе-теңдік шарты орындалғанда S=const ;
(3)-ші теңдеу температураның жылдамдыққа байланысты шама екенін көрсетеді. Сондықтан температура дегеннің өзі 2 түрлі жылдамдық. . Бұл ішкі энергия емес.
Әдебиеттер: негізгі және қосымша.
