
- •2.1. Масса атомов и молекул
- •30. Что называют константой скорости? Каков физический смысл этой величины и от каких факторов она зависит?
- •31. Какой формулой выражается правило Вант-Гоффа? Что называют температурным коэффициентом скорости реакции?
- •32. Что называют химическим равновесием? Почему оно называется динамическим? Какие концентрации реагирующих веществ называют равновесным?
- •33. Что называют константой равновесия? Зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления?
- •34. Какой фактор определяет возможность осуществления химических реакций при столкновении частиц реагирующих веществ? Что называют энергией активации?
- •35. Что называют каталитическими реакциями, катализаторами и ингибиторами?
- •36. Что выражает величина, которую называют концентрацией данного компонента в системе?
- •37. Перечислите и охарактеризуйте способы выражения количественного состава растворов?
- •38. Что такое растворимость веществ, в каких единицах она может быть выражена и от чего зависит?
- •39. Какие растворы называют ненасыщенными, насыщенными, пересыщенными? Что определяет произведение растворимости (пр)?
- •40. Какие физические свойства в разбавленных растворах неэлектролитов можно назвать общими свойствами? Чем это определяется и от чего зависят эти свойства?
- •41. Что называют осмосом и осмотическим давлением? От каких факторов зависит осмотическое давление и каким уравнением эта зависимость выражается?
- •42. Дайте формулировку и математическое выражение законов Рауля. Какие два следствия вытекают из закона Рауля, определяющие температуры кипения и замерзания растворов нелетучих веществ?
- •43. Что называют криоскопической и эбуллиоскопической константой? Зависят ли они от природы растворенного вещества и природы растворителя?
- •44. Какие вещества называют электролитами? Чем отличаются их водные растворы от растворов неэлектролитов?
- •К чему сводятся реакции в растворах электролитов? Покажите на примере, как составляются ионно-молекулярные уравнения (в полной и сокращенной форме).
- •Что такое степень электролитической диссоциации? На какие группы условно делят электролиты по величине степени их диссоциации?
- •Классификация
- •Что называют ионным произведением воды? в каком соотношении находится эта величина с константой диссоциации воды? Ионное произведение воды
- •Дайте общие определения химическому процессу, который называют гидролизом?
- •Для каких солей гидролиз проходит ступенчато? Чем определяется их число и как изменяется интенсивность гидролиза от первой степени до последней?
- •Что называют степенью гидролиза, от каких факторов она зависит? Как можно повысить или уменьшить ее значение?
- •Как объяснить взаимоусиление гидролиза двух солей при смешении двух растворов? Любая ли пара солей дает такой эффект?
- •Что положено в основу классификации реакций на реакции обмена и окислительно-восстановительные?
- •54. Что называется окислением и воостновителем? Назовите вещества, наиболее известные как сильные окислителем и восстановителем.
- •55. Почему окисление и восстановление – два взаимосвязанных процесса, которые не могут осуществляться один без другого?
- •60. Что называют стандартным водородным электродом, для каких целей его используют?
- •61. Какие элетродные потенциалы называют стандартными? в какой последовательности их следует располагать?
- •62. Как называют процесс, при котором электрическая энергия превращается в химическую? в каких устройствах это осуществляется?
- •63. Чем обусловлено направление движения ионов электролита в процессе электролиза? Какие электроды называют катодом и анодом?
- •64. Какие электрохимические процессы протекают на электродах при электролизе расплавленных электролитов? Приведите примеры.
- •67. Дайте формулировку законов Фарадея и их математические выражения. Что называют числом Фарадея f? Чему равна эта величина в кулонах и ампер-часах?
- •68. Что называют коррозией металлов? Какие различают виды коррозии?
- •69. Какое железо корродирует быстрее – находящееся в контакте с оловом или медью? Объясните.
- •71. Какие вещества называют ингибиторами коррозии?
- •72. Дайте краткую характеристику физических и химических свойств элементов ia группы периодической системы.
- •Физические свойства
- •Химические свойства
- •73. Каков характер связи образуемых атомами щелочных металлов и типы кристаллических решеток их соединений?
- •74. Приведите примеры реакций, иллюстрирующих большую химическую активность щелочных металлов.
- •Взаимодействие с неметаллами
- •Взаимодействие с водой
- •Взаимодействие с кислотами
- •76)Дайте общую характеристику физических и химических свойств d-элементов ib группы периодической системы.
- •77) Напишите электронные формулы и назовите все s-элементы II группы периодической системы.
- •78) Назовите природные соединения элементов iia группы периодической системы.
- •81) Какое место занимает алюминий по распространенности на Земле? Назовите важнейшие природные соединения алюминия.
- •83)Чем определяется возможность применения алюминия для восстановления других металлов и их оксидов? Приведите пример.
- •85) Основы органической химии. Теория Бутлерова.
- •86) Получение предельных углеводородов.
- •87)Физические и химические свойства предельных углеводородов.
- •88) Применение предельных углеводородов.
- •89)Какие степени окисления возможны и характерны для железа? Приведите примеры соединений.
33. Что называют константой равновесия? Зависит ли эта величина от природы реагирующих веществ, их концентрации, температуры, давления?
В состоянии химического равновесия
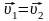 ,
тогда
,
тогда
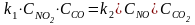 .
.
Поскольку k1 и k2 при данной температуре постоянны будет постоянным и их отношение
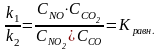
Кравн. – константа равновесия выражает закон действующих масс для процессов, находящихся в состоянии динамического равновесия. Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями.
Для гомогенных реакций в газообразной среде, вместо концентраций компонентов удобнее пользоваться величинами соответствующих парциальных давлений. Тогда константа равновесия для реакции аА+вВ mM+nN будет
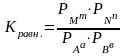
Р – парциальное давление.
Для реакций в гетерогенных системах с участием твердой и газообразной фаз давление твердой фазы ничтожно и основная его масса не участвует, поскольку взаимодействие протекает только с поверхности. Константу равновесия Кравн. можно выразить лишь через парциальное давление газообразных веществ, например:
С(тв)+СО2(г)=2СО(г)
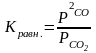
Константа равновесия является важной характеристикой химического взаимодействия. Чем больше значение Кравн., тем глубже протекает реакция, т.е. тем больше выход ее продуктов, для необратимых реакций Кравн. к бесконечности. Если К0, то это свидетельствует о практически полном отсутствии взаимодействия. Энергия Гиббса связана с константой равновесия соотношением
G= -RTlnKp
34. Какой фактор определяет возможность осуществления химических реакций при столкновении частиц реагирующих веществ? Что называют энергией активации?
Взаимодействие возможно, если сталкивающиеся частицы обладают энергией достаточной для преодоления сил отталкивания (энергетического барьера), возникающих между их электронными оболочками. Такие реакционно способные частицы называют активными, а энергия, необходимая для преодоления энергетического барьера – энергией активации.
Энергия активации – это та энергия, которая необходима для превращения реагирующих веществ в состояние активного комплекса. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости от энергии активации выражается уравнением Аррениуса
k=ZPe-Eа/RT
Z – число столкновений молекул в сек в единице объема;
е – основание натурального логарифма;
Р – стерический множитель, учитывающий подходящее расположение молекул в момент столкновения
Из уравнения Аррениуса следует, что константа скорости реакции тем больше, чем меньше энергия активации.
35. Что называют каталитическими реакциями, катализаторами и ингибиторами?
Химические реакции подразделяются на каталитические и некаталитические. Каталитические реакции проводятся в присутствии катализаторов – веществ, которые, не вступая в химическое взаимодействие, способны изменять скорость реакции. Химическое явление ускорения реакции с помощью катализатора называется положительным катализом или просто катализом. Отрицательным катализом называется явление уменьшения скорости протекания реакции под действием специальных веществ – ингибиторов.
